王冠华, 荆宝琴, 高畅, 杨波, 张云. 间充质干细胞的毒性作用研究[J]. 药物评价与研究, 2015, 38(3): 271-273.

WANG Guan-hua, JING Bao-qin, GAO Chang, YANG Bo, ZHANG Yun. Study on acute toxicity of mesenchymal stem cell in mice[J]. Drug Evaluation Research, 2015, 38(3): 271-273.

间充质干细胞的毒性作用研究
王冠华1
,
荆宝琴2,
高畅1,
杨波1,
张云1
1. 顺昊细胞生物技术(天津)股份有限公司, 天津 300308;
2. 天津市新药安全评价研究中心, 天津 300301
收稿日期: 2015-02-13
基金项目: 重大新药创制专项:重大疾病治疗的干细胞药物品种临床试验研究及其制药工艺标准化研发(2014ZX09101042);子宫内膜再生细胞药物临床前及临床研究(2014ZX09101042-003)
作者简介:王冠华(1977—),女,生物化学与分子生物学硕士,制药工程师,主要研究方向分子生物学、细胞生物学。E-mail:semmywang@163.com
摘要:目的 研究间充质干细胞对小鼠的急性毒性作用, 初步探讨其毒性反应, 为间充质干细胞在临床上安全使用提供指导。方法 选用ICR小鼠, 根据预试结果, 实验分为3组:对照组和间充质干细胞高、低剂量组, 每组分别采用20只实验动物, 雌雄各半, 分别观察小鼠对间充质干细胞的反应。结果 实验期间, 各给药组小鼠各检查时间点平均体质量与对照组比较均无明显差异, 且小鼠被毛光泽, 精神状态和自主活动均正常, 分泌物和排泄物等均未见明显异常。表明间充质干细胞制剂静脉给药对小鼠体质量增长无明显影响。与对照组比较, 间充质干细胞低、高剂量组雄性小鼠脾、肺质量及系数明显升高, 高剂量组雌性大鼠肺脏系数明显升高。结论 间充质干细胞制剂无明显的毒副作用, 且在肺脏和脾脏等部位滞留。
关键词:
间充质干细胞
急性毒性
ICR小鼠
脏器系数
Study on acute toxicity of mesenchymal stem cell in mice
WANG Guan-hua1
,
JING Bao-qin2,
GAO Chang1,
YANG Bo1,
ZHANG Yun1
1. Shunho Cell Biotechnology (Tianjin) Co., Ltd, Tianjin 300308, China;
2. Tianjin Center for New Drug Safety Assessment and Research, Tianjin 300301, China
Abstract: Objective To observe the acute toxicity of mesenchymal stem cell (MSC) in ICR mice, discuss the toxicity, and provide a basis for safe and reasonable medication in clinic. Methods the mice were divided into three groups (20 in each group, male and female), they were high-dose of MSC group, low-dose of MSC group, and normal saline (NS) group. And then all the cells were tested respectively by the classic methods for the acute toxicity in ICR mice. Results There was no evident difference in the weight and the mood of mice among the three groups. But compared with the NS group, the weight and weight index of the spleen and lung in male mice were obviously increased in the high-dose group and low-dose group. Besides, the weight index of lung in female mice was increased evidently. Conclusion There is no obvious side-effect after administrating MSC.
Key words:
mesenchymal stem cell
acute toxicity
ICR mice
organ coefficient
间充质干细胞是来源于中胚层的一类多能干细胞,在细胞治疗应用中具有广阔的前景,主要有两个特征:自我更新和分化潜能,因此这些细胞能够在体外扩增,可来源于不同的器官和组织,间充质干细胞已经应用于组织修复、自身免疫性疾病等临床治疗中,并取得了良好的治疗效果,经血源性干细胞具有间充质干细胞的特性,由于其来源方便,无伦理问题,增殖活性高等优点,近两年受到极大地关注。本实验拟通过从月经血中提取间充质干细胞,并检测其在小鼠体内的急性毒性,为临床安全使用提供依据。
1 材料与方法
1.1 间充质干细胞
间充质干细胞来源于自愿捐献的女性经血,顺昊细胞生物技术(天津)有限公司实验室分离提取和扩增,用细胞培养液配制至所需浓度的细胞悬液。
1.2 实验动物
ICR小鼠,SPF级,60只,雄雌各半,体质量18.1~21.1 g。北京维通利华实验动物技术有限公司提供,生产单位许可证编号:SCXK(京)2012-0001。动物饲养于天津市新药安全评价研究中心动物房(屏障环境),实验动物使用许可证号:SYXK(津) 2011-0005。饲养环境温度20~26 ℃,湿度40%~70%,换气次数8~10次全新风/h,光照12 h明12 h暗。
1.3 试剂
RPMI-1640培养基(Hyclone),DMEM-F-12培养基(Hyclone),10%胎牛血清(百灵生物科技有限公司),1%青-链霉素(Sigma),胰酶(Sigma),T-75培养瓶(Corning),淋巴细胞分离液(天津市灏洋生物制品科技有限公司),白蛋白(Baxter)。
1.4 仪器
MCO-18AIC(UV) CO2培养箱,三洋公司;BD Facsealibur流式细胞仪,碧迪医疗器械有限公司;Eppendorf 5424离心机,艾本德有限公司;CKX22显微镜,奥林巴斯有限公司;E1200-1电子天平,常熟市双杰测试仪器厂生产;ML203电子天平,梅特勒-托利多仪器有限公司生产。
1.5 间充质干细胞的分离提取和扩增
经血干细胞来源于自愿捐献的女性经血,经与捐献者本人签署知情同意书,在无菌条件下收集经血,立即将其转入含RPMI-1640培养基,10%胎牛血清,1%青-链霉素的细胞保护液中,转移至实验室处理分离提取。将采集后的经血及细胞保护液用100 μm细胞筛过滤,滤液离心,弃上清,离心所得沉淀用20 mL生理盐水重悬,以2∶1的体积比缓慢加入淋巴细胞分离液中,慢升慢降离心,所得细胞用10 mL DMEM-F-12培养基重悬,接种至T-75培养瓶中。细胞生长至80%时,进行胰酶消化传代,离心后弃上清,然后加入细胞培养液吹打混匀,收集细胞悬液,接种于细胞培养瓶,置于37 ℃、5% CO2培养箱中培养。
1.6 间充质干细胞的质量检测及表型鉴定
将所培养的细胞悬液进行微生物检测、支原体检测及内毒素检测。细胞培养至所需数量,消化收集所需细胞,调整细胞浓度104/μL,取12支Ep管,每管分FITC-CD90、FITC-CD105、FITCCD73、PE-CD34、PE-CD45、PE-HLA-DR及其各自的同型对照品,室温避光孵育30 min,用PBS洗2次,流式细胞仪检测细胞表面标记。
1.7 间充质干细胞制剂的制备
样品检测合格后,消化细胞,1 500 r/min离心5 min,生理盐水+1%白蛋白稀释所需数量的细胞样品分别至5×105 cells/mL(临床拟用浓度)、1×107 cells/mL(临床拟用浓度的20倍)。
1.8 急性毒性实验
实验设置2个试验组:低剂量组(1.0×107 cells/kg)尾iv 5×105 cells/mL的间充质干细胞注射液,高剂量组(2.0×108 cells/kg)尾iv 1×107 cells/mL的间充质干细胞注射液;另设置1个对照组,尾iv 0.9%氯化钠注射液,每组20只。各组给药体积均为20 mL/kg。观察给药当天及药后14 d内小鼠的毒性反应症状及死亡情况;给药前和药后第1、3、7、14天进行体质量检查;给药后14 d对所有存活动物进行系统的大体解剖检查,剪取各组小鼠心、肝、脾、肺、肾、胸腺,称取脏器质量,并计算脏器系数(脏器系数=脏器质量/体质量×1 000)。计算各组动物体质量和脏器质量及系数的平均值和标准差(雌雄分别统计),各给药组与对照组之间采用组间t检验进行差异性比较。
2 结果
2.1 间充质干细胞的微生物检测及表型鉴定
由于培养细胞的形状不能作为鉴别细胞类型的主要特征标志,因此,通常都采用流式细胞术对细胞表面抗原分子进行鉴定[1, 2, 3]。本实验中,对所获得的间充质干细胞表面抗原鉴定结果表明该细胞可表达CD29、CD44、CD105等间充质干细胞表面标志,证明所分离的细胞属于间充质干细胞。流式结果表明,细胞表面CD73表达率为98%,CD105表达率为99%,CD34、CD45表达率均小于2%。从经血中提取的间充质干细胞微生物检测、支原体及内毒素检测均为阴性,完全符合间充质干细胞的特性,可以作为制剂在临床上使用[4, 5]。
2.2 急性毒性试验
2.2.1 一般观察及体质量检查
对照组、间充质干细胞低剂量组及高剂量组小鼠在单次给药后均未观察到任何明显的毒性反应症状。在给药后14 d观察期内,小鼠被毛光泽,精神状态和自主活动均正常,分泌物和排泄物亦未见异常。试验期间无动物死亡。实验期间,各给药组小鼠各检查时间点平均体质量与对照组比较均无明显差异,表明间充质干细胞制剂静脉给药对小鼠体质量增长无明显影响。见表 1。
表 1(Table 1)
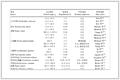
表 1 间充质干细胞制剂单次静脉给药对小鼠体质量的影响 (x±s, n=20)
Table 1 Effect of MSC preparation by single iv adminstration on body weight in mice (x±s, n=20)
| 组别 | 剂量/(cells∙mL−1) | 检查时间 | 体质量/g | | 雄性 | 雌性 | | 对照 | | 给药前 | 21.0±0.5 | 19.1±1.0 | | | 药后1 d | 22.6±0.8 | 20.3±1.1 | | | 药后3 d | 25.4±0.9 | 21.5±1.5 | | | 药后7 d | 28.6±0.9 | 23.7±1.5 | | | 药后14 d | 31.9±0.8 | 25.1±1.8 | | 低剂量组 | 5×105 | 给药前 | 21.2±0.7 | 19.7±1.0 | | | | 药后1 d | 22.6±0.7 | 20.4±1.1 | | | | 药后3 d | 25.3±1.0 | 22.1±1.2 | | | | 药后7 d | 28.6±1.5 | 24.1±1.7 | | | | 药后14 d | 31.9±1.5 | 25.1±1.7 | | 高剂量组 | 1×107 | 给药前 | 20.8±0.6 | 19.4±0.8 | | | 药后1 d | 22.2±1.2 | 20.2±1.1 | | | 药后3 d | 24.8±1.3 | 21.9±0.9 | | | 药后7 d | 27.9±1.6 | 23.4±0.9 | | | 药后14 d | 30.9±1.6 | 24.2±1.3 |
|
表 1 间充质干细胞制剂单次静脉给药对小鼠体质量的影响 (x±s, n=20)
Table 1 Effect of MSC preparation by single iv adminstration on body weight in mice (x±s, n=20)
|
2.2.2 解剖检查及脏器统计
药后14 d,各给药组及对照组小鼠毛顺,有光泽,营养状况良好,各脏器均未见肉眼可见的病理改变。脏器统计发现,低剂量组及高剂量组雄性小鼠脾、肺质量及系数明显升高,高剂量组雌性小鼠肺脏系数明显升高,其他脏器统计未见异常。见
表 2。
表 2(Table 2)

表 2 间充质干细胞制剂静脉给药对小鼠脏器质量和脏器系数的影响(x±s, n=20)
Table 2 Effect of of MSC preparation by single iv adminstration on on organ weight and organ coefficient inmice (x±s, n=20)
| 组别 | 剂量/(cells∙mL−1) | 项目 | 脏器质量/g | 脏器系数/(mg∙g−1) | | 雄性 | 雌性 | 雄性 | 雌性 | | 对照 | | 心 | 0.174±0.020 | 0.150±0.020 | 5.453±0.707 | 5.941±0.555 | | | 肝 | 1.936±0.134 | 1.449±0.264 | 60.601±3.549 | 57.428±7.827 | | | 脾 | 0.120±0.010 | 0.136±0.043 | 3.763±0.338 | 5.393±1.511 | | | 肺 | 0.209±0.024 | 0.193±0.026 | 6.533±0.673 | 7.653±0.711 | | | 肾 | 0.540±0.063 | 0.364±0.065 | 16.889±1.826 | 14.484±2.294 | | | | 胸腺 | 0.051±0.017 | 0.072±0.020 | 1.603±0.550 | 2.835±0.776 | | 低剂量组 | 5×105 | 心 | 0.177±0.015 | 0.146±0.011 | 5.570±0.486 | 5.836±0.454 | | | 肝 | 1.919±0.194 | 1.412±0.170 | 60.225±4.755 | 56.283±5.860 | | | 脾 | 0.152±0.020** | 0.137±0.030 | 4.752±0.457** | 5.461±1.191 | | | 肺 | 0.230±0.017 | 0.211±0.027 | 7.222±0.440 | 8.401±0.923 | | | 肾 | 0.561±0.055 | 0.351±0.043 | 17.626±1.524 | 13.965±1.358 | | | 胸腺 | 0.104±0.175 | 0.068±0.017 | 3.330±5.705 | 2.722±0.730 | | 高剂量组 | 1×107 | 心 | 0.179±0.018 | 0.151±0.021 | 5.813±0.566 | 6.247±0.826 | | | 肝 | 1.845±0.164 | 1.384±0.158 | 59.662±2.977 | 57.092±3.949 | | | 脾 | 0.151±0.017** | 0.119±0.021 | 4.888±0.362** | 4.904±0.723 | | | 肺 | 0.236±0.021 | 0.209±0.032 | 7.636±0.603** | 8.650±1.184 | | | 肾 | 0.543±0.068 | 0.335±0.032 | 17.580±1.852 | 13.861±1.093 | | | 胸腺 | 0.051±0.016 | 0.068±0.012 | 1.656±0.504 | 2.832±0.473 |
与对照组相比:*P<0.05,**P<0.01
*P < 0.05, **P < 0.01 vs control group |
|
表 2 间充质干细胞制剂静脉给药对小鼠脏器质量和脏器系数的影响(x±s, n>=20)
Table 2 Effect of of MSC preparation by single iv adminstration on on organ weight and organ coefficient inmice (x±s, n=20)
|
3 结论
小鼠单次静脉注射5×105 cells/mL(临床拟用浓度)和1×107 cells/mL(远大于临床拟用浓度)的间充质干细胞制剂,除引起动物肺脏及脾脏增重外,未出现其他明显毒性反应,也未观察到动物死亡。实验结果提示,间充质干细胞制剂临床单次使用的耐受性较好。
4 讨论
根据文献[6, 7, 8]报道,悬浮的MSCs的平均直径为15~19 μm,而肺部毛细血管的直径为10~15 μm,另外,MSCs具有很强的附着能力,因此会大量滞留在肺部。多数研究者证实移植的BMSCs往往易于分布在肺、脾、肾和皮肤等含血量多的器官中,而肾脏、心脏、肝脏和肌肉等也有报道,可见其分布的部位虽然广泛,但对某些脏器存在倾向性。含血量多的器官具有丰富的微血管系统,血流量大, 血流相对缓慢,使MSCs易于滞留。脾的主要功能是过滤和储存血液,血流丰富,因此MSC在此滞留的可能性大。这可能是本实验中小鼠肺脏和脾脏重量及系数的升高的主要原因,小鼠肺脏和脾脏质量及系数的升高可能对肺脏和脾脏具有一定的保护和修复功能。
参考文献
| [1] |
李秋晨. 人间充质干细胞表面标记分子的研究进展 [J]. 组织工程与重建外科杂志, 2013, 9(4): 229-234.
|
| [2] |
Delorme B, Charbord P. Culture and characterization ofhuman bone marrow mesenchymal stem cells [J].Methods Mol Med, 2007, 140: 67-81.
|
| [3] |
裴雪涛. 干细胞生物学 [M]. 北京: 科学出版社, 2003.
|
| [4] |
人体细胞治疗研究和制剂质量控制技术指导原则 [S]. 2003.
|
| [5] |
中国药典 [S]. 2010.
|
| [6] |
Schrepfer S, Deuse T, Reichenspurner H, et al. Stem cell transplantation: the lung barrier [J]. Transplant Proc, 2007, 39(2): 573-576.
|
| [7] |
李培蕾, 林 明. 骨髓间充质干细胞归巢研究进展 [J]. 中国心血管病研究, 2010, 8(1): 65-67.
|
| [8] |
王 洋, 肖 扬. 静脉输注骨髓间充质干细胞的归巢路径 [J]. 中国组织工程研究, 2012, 16(1): 143-147.
|
 2015, Vol. 38
2015, Vol. 38

