2. 南京医科大学附属常州市第二人民医院血液科, 江苏 常州 213000
2. Department of Hematology, Affiliated Changzhou No. 2 People's Hospital of Nanjing Medical University, Changzhou 213000, China
白血病是发病率较高的血液系统恶性肿瘤之一。随着联合化疗在临床中的应用,完全缓解率明显提高,但仍有部分患者对化疗产生耐药,成为化疗失败的主要原因。苦参碱(matrine)是豆科植物苦参的干燥根、植株、果实中提取出的一种生物碱,具有抗感染、升高白细胞数、缓解癌痛等多种药理活性,也是一种理想的肿瘤诱导分化药物[1, 2, 3, 4]。以往的研究中,本课题组发现苦参碱对多个白血病细胞株体外生长都具有明显抑制作用[5],本研究拟进一步观察苦参碱对原代白血病细胞的体外作用,以期为苦参碱临床应用提供更多实验依据。
1 材料与方法 1.1 材料 1.1.1 苦参碱
相对分子质量248.36,质量分数为99.9%,购自陕西省科学院西安植物园植物化学开发研究所。双蒸水配制成10 g/L的储存液于−20 ℃保存备用。 1.1.2 细胞株及培养
研究对象为南京医科大学附属常州市第二人民医院血液科收治的白血病初诊患者,经血象和骨髓病理活检临床确诊,共8例,其中急性髓细胞白血病(acute myeloid leukemia,AML)有5例,慢性粒细胞白血病(chonic myeloid leukemia,CML)有3例。抽取患者外周血2~3 mL,置于肝素抗凝无菌试管中,加入人淋巴细胞分离液,在超净工作台中进行无菌分离。离心后吸取中间层细胞,置于另一无菌离心管中,以0.01 mol/L PBS液洗涤1次后,2 000 r/min离心5 min。重复上述操作1次后弃上清,分离可得单个核细胞。所余下层细胞经红细胞裂解液,在37 ℃、5 min后,1 000 r/min离心3 min,弃上清。以0.01 mol/L PBS液洗涤1次后,可得粒细胞。将单个核细胞与粒细胞混合,为实验用白血病细胞。于含10%胎牛血清(FBS)、青、链霉素(分别为100 U/mL和100 μg/mL)的PRMI 1640培养基重悬后,0.4%台盼蓝法染色计数活细胞≥95%,调整为细胞密度(3~5)×105/mL后,37 ℃、5% CO2、饱和湿度培养箱中培养。 1.1.3 主要试剂和仪器
胎牛血清(FBS),细胞培养基(PRMI 1640)为Gibco产品。人淋巴细胞分离液(批号20100827)购自上海华精生物高科技有限公司。台盼蓝(Trypan Blue)购于Sigma公司。cck-8(Cell counting kit-8)购于东仁公司。凋亡试剂盒Annexin V/PI Dead Cell Apopotosis Kit为Invitrogen公司产品。IX71-22FL/PH倒置荧光显微镜为OLYMPUS公司产品。BD Biosciences FACS Calibur流式细胞仪为BD公司产品。 1.2 方法 1.2.1 形态学观察
原代白血病细胞,调整密度为2×105/mL,按每孔2 mL接种于6孔板中。实验组加入终质量浓度分别为0.2、0.5、0.8 mg/mL的苦参碱药液,阴性对照组加入等体积1640培养液,作用24、48 h后倒置光学显微镜下观察白血病细胞形态学改变。 1.2.2 苦参碱对原代白血病细胞作用浓度–时间曲线的测定
原代白血病细胞调整密度为1.5×105/mL,按每孔1 mL接种于24孔板中。实验组加入苦参碱药液,终质量浓度分别为0.2、0.5、0.8 mg/mL,阴性对照组加入等体积1640培养液,每组设6个平行孔。细胞于37 ℃、饱和湿度、5% CO2培养箱中常规培养。每天各实验组取出1孔,台盼蓝染色计数活细胞,连续计数6次,绘制苦参碱对白血病细胞的作用浓度和时间曲线。每个实验至少重复3次。 1.2.3 CCK-8增殖实验
原代白血病细胞调整密度为2×105/mL,按每孔200 μL接种于96孔板中。实验组加苦参碱药液,终质量浓度分别为0.2、0.5、0.8 mg/mL,另设不加药组为对照组,无细胞单加药组为空白组,每组设3个平行孔。细胞分别培养24、48 h后,CCK-8法检测苦参碱对细胞的影响。细胞增殖活性计算公式:[(实验组A450-空白组A450)/(对照组A450-空白组A450)]×100%。每个实验至少重复3次。 1.2.4 Annexin V-FITC/PI双标记法检测细胞凋亡
原代白血病细胞调整密度为2×105/mL,按每孔3 mL接种于6孔板中。实验组分别加入0.2、0.5、0.8 mg/mL苦参碱处理。24 h后,收集细胞以预冷0.01 mol/L PBS洗涤2次,以100 μL 1×Annexin-binding buffer重悬细胞,调整细胞数目在1×106个/mL,实验组和对照组细胞内依次加入5 μL Annexin-V和1 μL PI工作液;另设Annexin-V和PI单染对照,分别加入5 μL Annexin-V或1 μL PI工作液;避光室温孵育15 min,各管内加入400 μL 1×Annexin-binding buffer,混匀避光至于 冰上。以FITC标记的Annexin-V和碘化丙啶(propidium iodide,PI)染色流式细胞仪检测各组细胞凋亡情况。每个实验至少重复3次。 1.2.5 细胞周期分析
原代白血病细胞调整密度为2×105/mL,按每孔5 mL接种于6孔板中。实验组分别加入终质量浓度0.2、0.5、0.8 mg/mL苦参碱处理。48 h后,收集细胞以预冷0.01 mol/L PBS洗涤2次,以500 μL冰70%乙醇固定细胞,−20 ℃过夜。后离心弃上清,以预冷0.01 mol/L PBS洗涤2次,实验组和对照组细胞内依次加入100 μL Triton X-100(0.1%)破膜,5 min。后离心弃上清,以预冷0.01 mol/L PBS洗涤2次,加入终质量浓度0.2 mg/mL RNAseA,50 μg/mL PI,避光室温孵育30 min,流式细胞仪检测各组细胞周期情况。每个实验至少重复3次。 1.3 统计学分析
数据用采用SPSS17.0统计软件处理,计量资料以x±s表示。组间比较采用单因素方差分析,并进行组间两两比较。 2 结果 2.1 形态学观察
原代白血病细胞经苦参碱处理前后,细胞形态发生明显变化。见图 1,对照组经24 h培养后,细胞数量略有增加,形态呈圆形透亮状,折光性减弱,胞质中出现细颗粒状物质;而经苦参碱处理24 h,细胞数量虽有增加,但胞体胀大,内有空泡,核内染色质固缩,可见死亡细胞及碎片。培养48 h后,对照组细胞略有增加,细胞形态胀大,可见些许死亡细胞及碎片;苦参碱处理组细胞数量减少,核内染色质固缩,细胞破裂降解,细胞开始大量死亡。
 | 图 1 不同浓度苦参碱作用24、48 h后原代白血病细胞形态学改变 Fig. 1 Morphological changes of primary leukemia cells treated with matrine at indicated concertration for 24 h, 48 h |
不同浓度苦参碱对原代白血病细胞的生长均显示抑制作用,呈药物浓度相关性。由图 2A生长曲线可见,随着苦参碱处理浓度的增加,细胞的增值速度减慢。苦参碱0.2 mg/mL组48 h细胞计数为 (15.33±1.04)×104,苦参碱0.5 mg/mL组为(9±0.87)×104,对照组为(17.83±1.26)×104。随着苦参碱作用时间的延长,处理组细胞数减少更加明显。5 d时,苦参碱0.2、0.5、0.8 mg/mL组细胞计数依次为(10±1)×104、(6.67±1.15)×104、(5.67±0.58)×104。
随着苦参碱处理浓度的增加,抑制作用逐渐增强,见图 2B。24 h苦参碱处理组细胞活性依次为(66.10±11.02)%、(45.02±18.21)%、(27.04± 7.89)%。其中0.5、0.8 mg/mL与对照组差异显著(P<0.01)。而且0.2 mg/mL与0.8 mg/mL之间也存在显著差异(P<0.05)。苦参碱处理时间延长后,48 h苦参碱0.2 mg/mL组细胞活性为(79.68±6.59)%,抑制作用有所减弱;苦参碱0.8 mg/mL组细胞活性为(25.88±21.01)%,抑制作用略有增加,但是差异无显著性。苦参碱对原代白血病细胞的抑制作用呈剂量相关性,其中苦参碱0.5 mg/mL在24、48 h均呈现半数抑制。
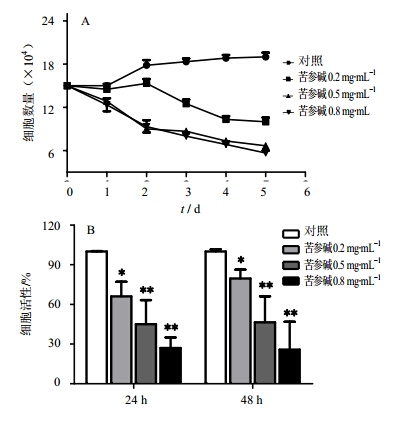 | A-不同浓度苦参碱作用后原代白血病细胞的生长曲线MAT(mg/mL);B-不同浓度苦参碱抑制原代白血病细胞的体外增殖。与对照组比较:*P<0.05,**P<0.01
A-The cells were grown in 24-well culture plate and counted everyday. B- Cells were incubated with CCK-8 solution. *P < 0.05, **P < 0.01 vs control group 图 2 苦参碱抑制原代白血病细胞体外增殖 Fig. 2 Inhibition of matrine on primary leukemia cells proliferation in vitro |
苦参碱对原代白血病细胞诱导凋亡作用具有剂量相关性,见图 3。苦参碱作用24 h,对照组的细胞凋亡率约为8.71%,随着苦参碱加药浓度的增加,细胞凋亡率分别为13.37%、40.62%、63.21%,其中早期凋亡率分别为11.8%、37.6%、54.7%。
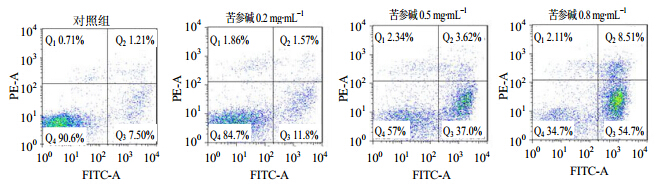 | 图 3 苦参碱诱导原代白血病细胞凋亡(Annexin V-PI) Fig. 3 Induction of matrine to primary leukemia cells into apoptosis (Annexin V-PI) |
苦参碱处理48 h后,原代白血病细胞的周期发生改变。其中G0/G1期细胞逐渐增多,S和G2期细胞比例显著降低,见图 4。G0/G1期细胞逐渐增多,其中对照组为74.7%,苦参碱0.5 mg/mL组为88.06%,苦参碱0.8 mg/mL组为90.4%。S和G2期细胞比例显著降低,S期对照组为8.22%,苦参碱0.5 mg/mL组为4.42%。G2期对照组为17.08%,苦参碱0.2、0.5、0.8mg/mL组依次为16.75%,7.52%,2.48%。显示细胞周期阻滞于G0/G1→S期。
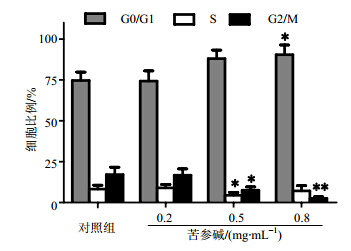 | 与对照组比较:*P < 0.05, **P < 0.01
*P < 0.05, **P < 0.01 vs control group图 4 不同浓度苦参碱作用后原代白血病细胞周期流式分析Fig. 4 DNA cell cycle analyses in primary leukemia cells exposed to matrine at different concentration |
白血病是一种造血系统恶性肿瘤,在我国青少年中发病率较高,其高度增生和恶性侵袭的生物学特性使其临床防治始终是一个难点。白血病的常规疗法主要是放疗和化疗,但是由于缺乏选择特异性,往往对正常组织、器官(特别是骨髓和消化道)造成功能性或器质性损伤。因此,寻找新的治疗方法和有效的抗癌药物具有重要意义。中草药以其副作用小,价廉易得在肿瘤综合防治中越来越受到关注。
苦参碱是提取于豆科植物苦参、苦豆子、广豆根等中草药的活性成分[6]。近年来,有关苦参碱类抗肿瘤机制的研究目前已成为抗肿瘤中药研究的一个热点,研究结果表明作为抗肿瘤联合用药在肿瘤综合防治中具有较好的应用前景。以往研究发现,苦参碱能明显抑制人慢粒白血病细胞K562、早幼粒白血病细胞HL-60、U937细胞增殖,诱导凋亡增加,其中抑制K562细胞内DNA复制;诱导T淋巴细胞白血病JM多个凋亡基因差异表达,其中Caspase8表达上调5倍以上[5, 6, 7]。以上这些都是在白血病细胞株中的研究,苦参碱对原代白血病细胞的作用尚没有更多报道。
本研究发现,苦参碱对原代白血病细胞也具有明显的增殖抑制作用,呈剂量相关性。随着时间的延长,其抑制效应有所减弱,但高浓度仍具有较强抑制效果,苦参碱0.5 mg/mL在24、48 h均呈现半数抑制。细胞凋亡也与肿瘤之间关系密切,正常细胞通过增生和凋亡来维持自身稳定,若两者失衡,则会导致肿瘤发生[8]。本次研究,24 h苦参碱诱导凋亡作用显著,其中早期凋亡占较大比例。肿瘤细胞的无限增殖与细胞周期的失控有关,G1/S是其重要的调控点。本次研究,苦参碱处理48 h,原代白血病细胞G0/G1期细胞逐渐增多,S和G2期细胞比例显著降低,显示细胞周期阻滞于G0/G1→S期。
本课题组在以往研究中发现,苦参碱可以抑制K562细胞生长,诱导其凋亡、分化,其作用可能与Bcl-2、C-myc、CyclinD1、P53的表达有关[9, 10, 11]。有报道称苦参碱作用后的K562、HL-60细胞Bcl-2蛋白表达明显的下调,与苦参碱浓度呈反比。近年来的研究表明Bcl-2在内源性凋亡途径中起着重要作用[12]。另外,苦参碱作用K562细胞后,P53表达增强。P53是一种肿瘤抑制基因,对细胞生长、凋亡和DNA修复有调控作用[13]。此外,苦参碱作用K562细胞后,伴随着DNA合成能力的降低,C-myc的mRNA水平表达降低,CyclinD1表达增强并几乎同步达到最高。C-myc、CyclinD1作为一种细胞周期蛋白,其表达水平受苦参碱影响,在G0期到S期的过程中起重要作用[14, 15]。因此,推测苦参碱对原代白血病细胞生长抑制作用可能与Bcl-2,C-myc基因表达水平的下调,CyclinD1表达增强,P53活化有关。
以往的研究提供了一些可能,苦参碱抑制原代白血病细胞增殖,诱导细胞凋亡,阻滞细胞周期于G0/G1→S期,其作用机制是否与这些分子相关,还有待更深入的研究。这些涉及到的相关分子将是本课题组下一步的研究方向。
| [1] | Wu D, Shao K, Sun J, et al. Matrine cooperates with all-trans retinoic acid on differentiation induction of all-trans retinoic acid-resistant acute promyeloc-ytic leukemia Cells (NB4-LR1): possible mechanisms [J]. Planta Med, 2014, 80(5): 399-408. |
| [2] | Luo C, Zhong H J, Zhu L M, et al. Inhibition of matrine against gastric cancer cell line MNK45 growth and its anti-tumor mechanism [J]. Mol Biol Rep, 2012, 39(5): 5459-5464. |
| [3] | Li LQ, Li X L, Wang L, et al. Matrine inhibits breast cancer growth via miR-21/PTEN/Akt pathway in MCF-7 cells [J]. Cell Physiol Biochem, 2012, 30(3): 631-641. |
| [4] | 任 峰, 王 丰, 许洪卫. 复方苦参注射液经P13K/Akt信号通路抑制胃癌细胞株BGC-823生长 [J]. 中华实验外科杂志, 2011, 28(5): 814. |
| [5] | 樊 丽, 高吉照. 苦参碱对吡柔比星诱导HL-60细胞凋亡及核因子-kBp65活性的影响 [J]. 中华实用儿科临床杂志, 2014, 29(3): 212-214. |
| [6] | 张丽华, 陈邦恩, 潘明佳. 苦参碱药理作用研究进展 [J]. 中草药, 2009, 40(6): 1001-1003. |
| [7] | 张永清, 黄高昇, 陈协群, 等. 苦参碱诱导T淋巴细胞白血病JM细胞凋亡相关基因表达变化及其机制研究 [J]. 中国实验血液杂志, 2009, 17(5): 1207-1210. |
| [8] | 覃遵科, 殷小成. 苦参碱对急性淋巴细胞性白血病细胞Bcl-2表达的影响 [J]. 中国当代儿科杂志, 2004, 6(6): 497-499. |
| [9] | 吕晓霞, 蒋丽佳, 范 静, 等. 苦参碱抑制慢性粒细胞白血病K562细胞生长和诱导凋亡作用研究 [J]. 现代中西医结合杂志, 2010, 19(2): 147-150. |
| [10] | 马玲娣, 张 彦, 文世宏, 等. 苦参碱抗肿瘤作用及其机制的初步研究 [J]. 中医与免疫, 2007, 23(5): 434-437. |
| [11] | Ma L D, Zhou M, Wen C, et al. effect of lentiviral shRNA-mediated STAT3 shRNA on Biological characteristics of chronic myelogenous leukemia K562 cells [J]. Leuk Lymph, 2010, 51(7): 1326-36. |
| [12] | 董海林, 宋永平. 苦参碱诱导HL-60细胞株凋亡作用的实验研究 [J]. 白血病淋巴瘤, 2011, 20(8): 480-489. |
| [13] | Joe Tam, 张莉萍, 蒋纪恺. 苦参碱对白血病细胞癌基因和细胞周期调控蛋白表达的影响 [J]. 中国肿瘤临床, 2001, 28(5): 347-361. |
| [14] | Guo L, Xue T Y, Xu W, et al. Matrine promotes G0/G1 arrest and down-regulates cyclinD1 expression in human rhabdomyosarcoma cells [J]. Panminerva Med, 2013, 55(3): 291-296. |
| [15] | 鲍娇琳, 陆金建, 陈修平, 等. 苦参碱与氧化苦参碱抗肿瘤作用及其机制的研究进展 [J]. 中药新药与临床药理, 2012, 23(3): 369-373. |
 2015, Vol. 38
2015, Vol. 38


