2. 鲁南制药集团 药理中心, 山东 临沂 273400
2. Center of Pharmacology, Lunan Pharmaceutical Group Corporation, Linyi 273400, China
连翘苷元(forsythiaside),又称连翘脂素、连翘脂苷A,是从木犀科连翘属植物连翘Forsythia suspensa (Thunb.) Vahl干燥果实连翘中分离提取的一种单体化合物。作为连翘提取物的主要有效成 分[1],连翘苷元具有抗肿瘤、抗氧化等多种药理活 性[2, 3, 4],但对免疫性肝纤维化的影响还没有报道。本实验利用牛血清白蛋白(bovine serum albumin,BSA)诱导免疫性肝纤维化大鼠模型,考察连翘苷元对免疫性肝纤维化的影响,为其临床应用提供参考。 1 材料 1.1 实验动物
Wisata大鼠,体质量120~160 g,雄性,北京维通利华实验动物技术有限公司提供,质量合格证号11400700047208;动物饲养于屏障环境中,温度20~26 ℃,湿度40%~70%,光照12 h明暗交替。 1.2 药物与试剂
连翘苷元(质量分数98.6%),山东新时代药业提供;水飞蓟宾葡甲胺片(Silibin),湖南千金协力药业有限公司;BSA、弗氏不完全佐剂,Sigma公司;羟脯氨酸(Hyp)试剂盒,南京建成生物工程研究所;透明质酸(HA)、层黏蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)Elisa试剂盒,武汉博士德生物工程有限公司;总蛋白(TP)、白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)测试盒,深圳迈瑞生物医疗电子股份有限公司。 1.3 仪器
BS200全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;MK3 GO酶标仪,美国赛默飞世尔科技公司;TG16-WS高速离心机,长沙维尔康湘鹰离心机有限公司;BS124 Sartorius精密电子天平,赛多利斯科学仪器北京有限公司;Olympus显微镜。 2 方法 2.1 大鼠免疫性肝纤维化模型的制备
参考文献方法[5, 6],选取健康雄性Wisatr大鼠90只,留取10只作为正常对照,其余大鼠均多点sc 9 mg/mL BSA弗氏不完全佐剂乳剂,每次0.5 mL,连续注射5次致敏,前2次注射间隔2周,后3次间隔1周。末次致敏后第10天,大鼠眼眶静脉丛采血检测抗体,取BSA抗体阳性大鼠尾静脉攻击注射BSA生理盐水溶液,每次0.4 mL,每周2次,剂量由每次2.0 mg递增至3.0 mg,以后每次增加0.2 mg,直至4 mg,共攻击注射16次。正常对照组用生理盐水代替BSA。 2.2 动物分组及给药
80只造模大鼠共有76只BSA抗体呈阳性,BSA生理盐水攻击注射后,大鼠出现不同程度的抽搐、俯卧、呼吸急促等过敏反应,其中6只大鼠症状严重死亡。剩余70只大鼠按照体质量分为模型组、连翘苷元低、中、高剂量(0.1、0.3、1.0 mg/kg)组和阳性对照水飞蓟宾葡甲胺组(50 mg/kg),每组14只。分组后即刻开始给药,除阳性对照组按照10 mL/kg ig给药外,其他各组均按照2 mL/kg体积sc给药,每天给药1次,连续给药直至造模结束后2周。正常对照组和模型组给予生理盐水;连翘苷元组给予连翘苷元注射液;阳性对照组给予水飞蓟宾葡甲胺。 2.3 指标测定
给药结束后动物禁食不禁水12~16 h,ip 50 mg/kg戊巴比妥钠溶液麻醉,腹主静脉取血,3 500 r/min离心10 min,分离上层血清用全自动生化分析仪检测血清AST、ALT、TP、ALB的量,用Elisa试剂盒检测血清HA、LN、PCⅢ、Ⅳ-C水平;放血处死大鼠,迅速摘取肝脏,称质量后剪取0.5 g肝组织,按照试剂盒说明书检测Hyp;摘取肝脏左叶放入10%中性甲醛中固定,常规取材、脱水,HE染色,显微镜下观察肝脏纤维化程度,根据纤维结缔组织的纤维化程度将其分为0~4级。0级:无纤维化;1级:纤维结缔组织仅局限于汇管区或汇管区有扩大,有向小叶发展的倾向;2级:纤维结缔组织增生明显,超过小叶的2/3并伴有1级改变;3级:纤维结缔组织进入肝小叶中央静脉周围;4级:纤维结缔组织在全小叶呈多处弥漫性增生,有假小叶形成,并有3级改变。 2.4 统计处理
数据用x±s表示,采用SPSS 11.5软件进行分析,组间比较采用ANOVA统计学检验。 3 结果 3.1 连翘苷元对免疫性肝纤维大鼠血清蛋白和转氨酶的影响
表 1结果显示,与对照组相比,模型组血清TP、ALB水平未见明显降低,ALT、AST也未见明显升高;与模型组相比,连翘苷元组和水飞蓟宾葡甲胺组上述指标也未见显著差异。
| 表 1 连翘苷元对免疫性肝纤维化大鼠血清 TP、ALP、ALT、和AST、的影响(x±s) Table 1 Effect of forsythiaside on levels of TP,ALB,ALT,and AST in rats with immunological hepatic fibrosis induced by BSA (x±s) |
与对照组相比,模型组肝脏Hyp水平显著升高(P<0.01),肝纤维化模型成功;与模型组比较,连翘苷元0.1 mg/kg即能显著降低肝脏组织Hyp水平(P<0.05),0.3、1.0 mg/kg剂量组降低更为显著(P<0.01),降低程度与剂量呈正相关,水飞蓟宾葡甲胺也能显著降低肝脏Hyp水平(P<0.01),见表 2。
| 表 2 连翘苷元对免疫性肝纤维大鼠Hyp、HA、LN、PCⅢ和Ⅳ-C水平的影响(x±s) Table 2 Effect of forsythiaside on contents of Hyp,HA,LN,PCⅢ,and Ⅳ-C in rats with immunological hepatic fibrosis induced by BSA (x±s) |
表 2结果显示,与对照组相比,模型组血清HA、LN、PCⅢ、Ⅳ-C水平均显著升高(P<0.01);与模型组相比,连翘苷元0.1、0.3、1.0 mg/kg剂量组均能显著降低血清HA、LN、PCⅢ、Ⅳ-C水平(P<0.01),降低程度与剂量呈正相关,阳性药水飞蓟宾葡甲胺亦有类似作用。 3.4 连翘苷元对免疫性肝纤维化大鼠肝脏质量和系数的影响
表 3结果显示,与对照组相比,模型组大鼠肝脏湿质量升高(P<0.05),脏器系数提升(P<0.01);与模型组相比,连翘苷元能够降低大鼠肝脏质量,1.0 mg/kg剂量组差异有统计学意义(P<0.05);能够降低脏器系数,0.3、1.0 mg/kg剂量组差异显著(P<0.01);阳性药水飞蓟宾葡甲胺亦能够降低大鼠肝脏湿质量(P<0.05)和系数(P<0.01)。
| 表 3 连翘苷元对免疫性肝纤维大鼠肝脏湿质量和系数的影响(x±s) Table 3 Effect of forsythiaside on weight and coefficients of rats with immunological hepatic fibrosis induced by BSA(x±s) |
对照组大鼠肝小叶结构完整,肝细胞未见明显水肿、变性、坏死,肝组织未见明显肝纤维化;模型组动物肝脏肝小叶内可见新生肝细胞,间质见纤维组织广泛性增生,新生毛细胆管细胞纤维化严重,纤维结缔组织增生并进入肝小叶中央静脉周围。与模型组相比,连翘苷元组肝纤维化程度有所减轻,减轻程度与剂量正相关,水飞蓟宾葡甲胺亦能减轻大鼠肝脏的纤维化程度。肝纤维化程度分级结果见表 4,显微图片见图 1。
| 表 4 连翘苷元对免疫性肝纤维化大鼠肝纤维化的影响 Table 4 Effect of forsythiaside on hepatic fibrosis of rats with immunological hepatic fibrosis induced by BSA |
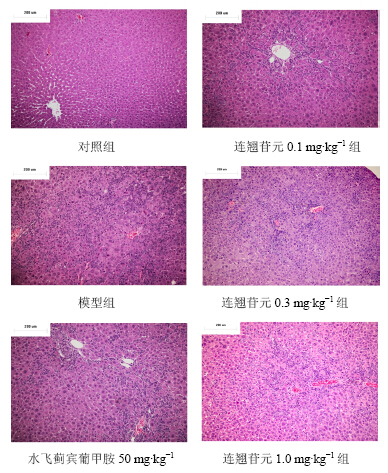 | 图 1 连翘苷元对肝纤维化的影响Fig. 1 Effects of forsythiaside on hepatic fibrosis |
肝纤维化是一种疾病状态,是各种慢性肝脏疾病发展为肝硬化的前期过程[7]。对肝纤维化的有效治疗能够有效降低肝硬化的发病率,提高患者生活质量,因此近年来对肝纤维化的研究受到越来越多学者的关注。异种血清诱导的免疫性肝纤维化模型是研究肝纤维化治疗药物的重要筛选工具,其主要发病机制类似于Ⅲ过敏反应,与临床病毒性肝炎引起的肝纤维化类似,与化学性肝纤维化模型相比较,该模型与人类肝纤维化的病理机制更为接近[8],而且肝纤维化形成稳定,肝细胞受损较轻,动物总体状态良好,有利于进行长期的研究。
血清HA、LN、PCⅢ、Ⅳ-C“肝纤四项”是临床上理想的诊断慢性肝病患者病情发展情况和治疗效果以及衡量炎症活动度、纤维化程度的重要血清学指标,它们在血清中的水平伴随炎症及其肝纤维化的进展存在逐渐升高的趋势,与肝纤维化的严重程度具有正相关性[9]。在本实验中,模型组动物“肝纤四项”显著升高,伴随肝脏重量增加,Hyp含量升高,显微镜下可见明显的组织纤维化,但血清AST、ALT未见明显升高,这可能与可能与动物肝脏细胞受损较轻有关,与文献报道相一致[10]。肝纤维化大鼠给予连翘苷元治疗后能够显著减轻组织纤维化程度,包括“肝纤四项”水平降低,肝脏重量减轻,组织纤维增生减少等,结果表明,连翘苷元对大鼠免疫性肝纤维化有较好的治疗作用。
| [1] | 王曙宾, 郑亚杰.连翘提取物和连翘酯苷A原料中连翘酯苷A的稳定性研究 [J].中草药, 2010, 41(6): 909-911. |
| [2] | Su B N, Zhu Q X, Gao K, et al.Ligand and Phenylpropanoid Glycosides from Lancea tibetica and Their Antitumor Activity[J].Planta Med, 1999, 65: 558-561. |
| [3] | 赵晨阳, 邱 嵘, 郑荣梁.呋喃骈呋喃木脂素的体外抗肿瘤活性 [J].兰州大学学报: 自然科学版, 2000, 36(4): 66-68. |
| [4] | 秦 宇, 张文丽, 林媛媛.连翘化学成分与抗氧化活性研究 [J].中国实验方剂学杂志, 2013, 19(10): 149-152. |
| [5] | 王慧明, 姜 溪, 陈芙蓉.清肝化淤胶囊对大鼠免疫性肝纤维化的影响 [J].中草药, 2012, 43(6): 1157-1159. |
| [6] | 邢 伟, 孔维涵, 方步武.蒿鳖养阴软坚方对免疫性肝纤维化大鼠的治疗作用 [J].中草药, 2010, 41(10): 1667-1672. |
| [7] | 中华肝病学会.肝纤维化诊断及疗效评估共识 [J].中华肝脏杂志, 2002, 10(5): 327. |
| [8] | Zhao X Y, Zeng X, Li X M, et al.Pirfenidone inhibits carbon tetrachloride and albumin complex-induced liver f ibrosis in rodents by preventing activation of hepatic stellate cells [J].Clin Exp Pharmacol Physiol, 2009, 36(10): 963-968. |
| [9] | 孙 宇, 姜美凤.“肝纤四项”检测在肝纤维化诊断中的价值 [J].实用临床医药杂志, 2011, 15(7): 141. |
| [10] | Wang H, Wei W, Wang N P, et al.Effects of total glucosides of peonyon immunological hepatic fibrosis in rats [J].World J Gastroenterol, 2005, 11(14): 2124-2129. |
 2015, Vol. 38
2015, Vol. 38


