2. 军事医学科医学院毒物药物研究所, 国家北京药物安全评价研究中心, 北京 100850;
3. 抗毒药物与毒理学国家重点实验室(军事医学科学院), 北京 100850;
4. 河北神威药业有限公司, 河北 三河 065201;
5. 河北省中药注射剂工程技术研究中心, 河北 石家庄 051430
2. National Beijing Center for Drug Safety Evaluation and Research, Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China;
3. State key Laboratory of Toxicology and Medical Countermeasures, Academy of Military Medical Sciences, Beijing 100850, China;
4. Shineway Pharmaceutical Group Limited, Sanhe 065201, China;
5. Hebei Engineering Technology Research Center of Chinese Materia Medica Injection, Shijiazhuang 051430, China
中药注射剂是采用现代工艺将中药单方或复方加工精炼而成的一种新剂型,具有见效快、效果稳定、使用方便的特点,在临床急、重症方面应用广泛,但药物不良反应(adeverse durg reaction,ADR)报道亦逐渐增多,以过敏性反应较为常见[1, 2]。然而,研究表明,类过敏反应和过敏反应的症状极为相似,最大的区别是类过敏反应首次用药即可发生,无免疫系统参与,无需IgE介导[3, 4],分析临床报道可知,很多中药注射剂归类为过敏反应的ADR应属于类过敏反应的范畴。因此,有必要加强中药注射剂致机体的类过敏反应的评价。
中药注射剂产生类过敏反应的机制有多种,但最主要的机制是药物直接刺激嗜碱性细胞或肥大细胞脱颗粒并释放过敏性介质而引起类过敏反应[5]。在中药注射剂类过敏反应评价方面,体内一般选择Wistar大鼠、豚鼠和Beagle犬等易发生过敏性反应的动物来进行评定,体外通常选取肥大细胞或嗜碱性细胞的原代细胞或细胞系进行评价,但是体内法因成本高、重复性差而导致其应用受到局限,体外法则相对来说成本较低、重复性较高而广泛应用于类过敏反应的初步评价。目前,常用作中药注射剂类过敏性反应的体外评价的细胞系为RBL-2H3细胞,它源于大鼠嗜碱性白血病细胞株,具有肥大细胞相似的生物学特性,已在生脉注射液[6]、清开灵注射液[7]、血塞通注射液[8]等多种中药注射剂中得到应用,评价的结果与ADR监测的结果基本一致。
参麦注射液(Shenmai Injection,SMI)作为一种广泛适用于治疗充血性心力衰竭、冠心病、心绞痛、肿瘤化疗辅助的中药注射剂,临床ADR的报道也以过敏反应居多[9, 10],但这些过敏反应报道中是否存在类过敏反应尚不明确。因此,本研究首先选择化合物48/80(Compound 48/80,C48/80)为工具药,建立RBL-2H3细胞脱颗粒模型,通过分析不同浓度的SMI及其溶剂与RBL-2H3细胞直接作用后的脱颗粒形态学变化和活性物质的释放程度来初步评价SMI的类过敏反应,为SMI的临床使用提供参考。
1 材料与方法 1.1 受试药物及主要试剂配制方法SMI原液,含0.2 kg/L的生药(红参和麦冬)和5 g/L的Tween-80,神威药业有限公司生产,批号1310133;SMI溶剂原液,仅含5 g/L的Tween-80,神威药业有限公司生产,批号12101539,使用前用台氏液稀释。台氏液[11](20 mmol/L HEPES,135 mmol/L NaCl,5 mmol/L KCl,1.8 mmol/L CaCl2,1 mmol/L MgCl2,5.6 mmol/L glucose,0.05% BSA,pH 7.4);DMEM培养基、胎牛血清购自Gibco公司。C 48/80购自Sigma公司,批号014M4062V,以台氏液配成250 mg/L的储存液;Triton X-100购自Sigma公司,批号W XBB2203V,取原液用9% NaCl配制体积分数为1%。中性红试剂,国药集团化学试剂有限公司生产,批号20120806;β-己糖苷酶底物(4-niroPheny 1-N-acety-β-D-glucosaminide)购自Sigma公司,批号SLBF1695V,用0.05 mol/L柠檬酸盐缓冲液(pH=4.5)配成1 mmol/L溶液;N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(N-benzoyl-DL-arginine p-nitrophenyl amide hydrochloride,BAPNA)购自Sigma公司,批号BCBM1688V,用DMSO配成20 g/L的溶液;组胺二盐酸盐、邻苯二甲醛购自Sigma公司;细胞计数试剂盒(Cell Counting kit-8),日本同仁化学研究所,批号FQ659。
1.2 主要仪器Victor 1420多功能酶标仪,美国Perkin Elmer公司;CKX41显微镜,日本Olympus公司;3000T二氧化碳培养箱,美国Revco公司;3-18k离心机,德国Sigma公司。
1.3 细胞培养RBL-2H3细胞是大鼠嗜碱性白血病细胞株的一个亚系,购自中国科学院上海生命科学研究院细胞资源中心,本实验室保存。细胞采用含有10%胎牛血清的DMEM培养液于37 ℃,饱和湿度,5%的CO2培养箱中进行培养。当细胞生长铺满约80%培养皿底面时,进行传代,传代比例为1∶2~1∶3,每2天传代1次。
1.4 RBL-2H3细胞脱颗粒模型的最佳的药物作用条件和考察指标选择分别用台氏液配制质量浓度为5、10、20、50和100 mg/L的C48/80溶液,每个质量浓度按作用的时间分为15、30、45、60 min 4个亚组,每亚组4个复孔。取对数生长期细胞,重悬后以2×105/mL,200 μL种板,37 ℃培养24 h,吸掉旧培养基,用PBS清洗3遍,每孔加入200 μL上述配制好的C48/80溶液,分别作用对应时间后取上清于0.2 mL EP管中,3 000 r/min离心10 min,取上清测定β-己糖苷酶、类胰蛋白酶;此外用间接荧光法检测组胺,用CCK-8法测定细胞的活力。
1.5 SMI致RBL-2H3细胞脱颗粒作用研究 1.5.1 药物浓度的选择[12]SMI的临床标注量为100 mL/次,相当于20 g生药/次,其溶剂Tween-80的量为0.5%。本试验模拟临床体内细胞接触药物的血药浓度,以正常人血液量4.5 L计,临床体内药物浓度(简称临床浓度)相当于标注量/血容量。考虑到个体差异和量效关系,分别将SMI和溶剂用台氏液等比稀释成5个浓度,等级比为3倍(表 1)。
| 表 1 实验药物剂量设置 Table 1 Setting of drug dose in experiment |
取对数成长期的RBL-2H3细胞按2×105/mL的密度接种于96孔板,每孔200 μL,培养24 h贴壁后,弃去培养液,用台氏液洗3次,设置空白组(台氏液)、阳性组(40 mg/L的C48/80)、总酶组(1% Triton X100)和给药组(用台氏液稀释的各质量浓度的SMI和溶剂)。各组均于37 ℃与细胞作用30 min后,吸取细胞上清液,3 000 r/min离心10 min,收集离心上清液用来检测β-己糖苷酶释放率,用间接荧光法检测组胺释放率,用CCK-8法检测细胞存活率。取过上清后细胞用台氏液清洗3次,加入0.5%的中性红染液染色3 min,在光学显微镜下观察细胞脱颗粒的形态变化。
1.6 β-己糖苷酶释放率测定(显色法)各组取50 μL上清液加入96孔板中,每份待测液5孔,同时添加5孔本底液,向各孔加入50 μL基质液(将底物β-己糖苷酶溶于0.1 mol/L的pH=4.5的柠檬酸-柠檬酸钠缓冲盐中,使其终浓度为1 mmol/L)在37 ℃孵育1 h,加入150 μL的0.1 mol/L NaHCO3-Na2CO3缓冲液终止反应,5 min内测定405 nm处的吸光度(A)值。
β-己糖苷酶释放率=(A上清-A本底)/(A总酶-A空白)
1.7 类胰蛋白酶释放率测定(专一性底物法)各组依次加入上清液100、200 μL BAPNA底物(溶于DMSO,终质量浓度为20 g/L)和30 μL Tri-HCl(0.1 mol/L,pH=7.4),每组5孔,同时添加本底对照。37 ℃反应30 min后,每孔加50 μL 30%的乙酸,在405 nm波长处检测其A值。
类胰蛋白酶释放率=(A上清-A本底)/(A总酶-A空白)
1.8 组胺释放率测定(间接荧光法[13])各组加药处理后,除总组胺组外,加药组和空白组弃去上清,用PBS洗3遍,加入200 μL 1%的TritonX-100,37 ℃处理30 min后,吸取上清,3 000 r/min离心10 min,收集离心上清液待测组胺。待测样品每组设置5个复孔,同时添加组胺对照品(用0.1 mol/L HCl稀释,质量浓度为2 000、1 000、500、250、100、50、20、10、0 μg/L)对照,各孔分别加100 μL上清液、50 μL 0.4 mol/L的NaOH和10 μL的1 g/1的OPT甲醇溶液,反应10 min后加入50 μL 0.5 mol/L的HCl终止反应,在激发波长355 nm,发射波长460 nm条件下检测荧光值。
组胺释放率=(细胞总荧光值-胞内荧光值)/细胞总荧光值
1.9 RBL-2H3细胞活力测定(CCK-8法)各组加药处理后,弃去上清,用PBS洗3次,每孔依次加100 μL DMEM培养液和10 μL的CCK-8试剂,同时添加本底和DMEM组作为对照,继续在培养箱中培养3 h,在450 nm波长检测A值,并计算细胞活力。
细胞活力=(A加药−A本底)/ (ADMEM−A本底)
1.10 统计学处理应用SPSS19.0软件进行数据处理,结果以x±s 表示。采用独立样本t 检验比较组间的差异性。
2 结果 2.1 RBL-2H3细胞脱颗粒模型的最佳药物作用条件和考察指标选择不同浓度的C48/80与RBL-2H3细胞作用后,结果显示,各组细胞上清液类胰蛋白酶几乎没有释放;组胺和β-己糖苷酶释放程度较高并且具有良好的量-时-效关系:在相同作用时间下,其释放率均随浓度增加而增高;同一浓度释放率也均随作用时间延长而提高(图 1)。但是,CCK-8结果显示,当C48/80质量浓度超过50 mg/L,作用时间超过45 min后,细胞的活力低于80%,大于20%细胞死亡,易造成评价结果的假阳性。因此,选择考察的指标以组胺和β-己糖苷酶释放率为佳,C48/80浓度不应超过50 mg/L,最佳作用时间为30 min。
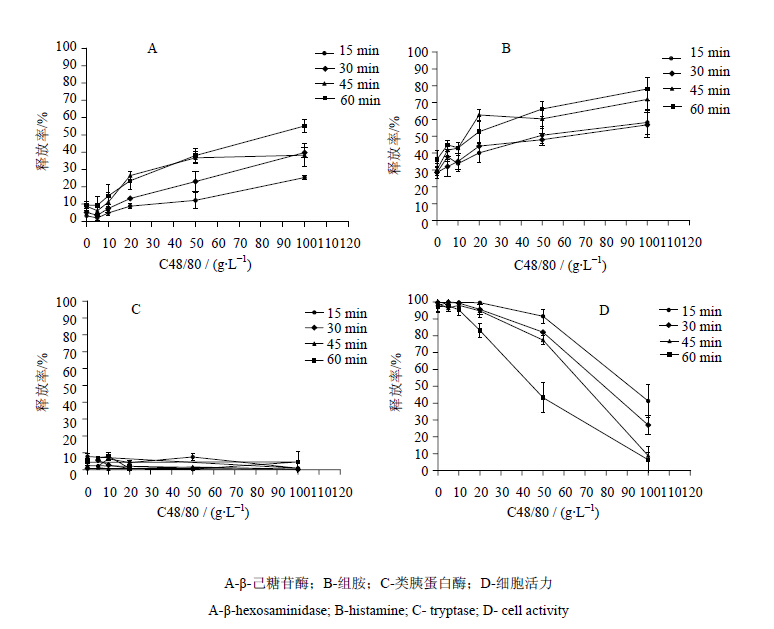 | 图 1 C48/80对RBL-2H3细胞类过敏活性物质释放和活力的影响(x±s,n=3)Fig. 1 Effect of C48/80 to RBL-2H3 cells on release of active substances of allergies and viability(x±s,n=3) |
RBL-2H3细胞与药物作用30 min后,用中性红染色,在光学显微镜下观察可知,空白组细胞生长状态良好,呈长梭形,着色较浅,折光性较好;阳性组细胞呈圆形或椭圆形,着色较深,细胞内可见颗粒状物质。与阴性组相比,SMI溶剂组Tween- 80质量浓度大于0.33 g/L后会出现较明显的脱颗粒作用;而SMI 40 g生药/L组细胞有轻微脱颗粒作用外,其他浓度组均未见脱颗粒现象(图 2)。
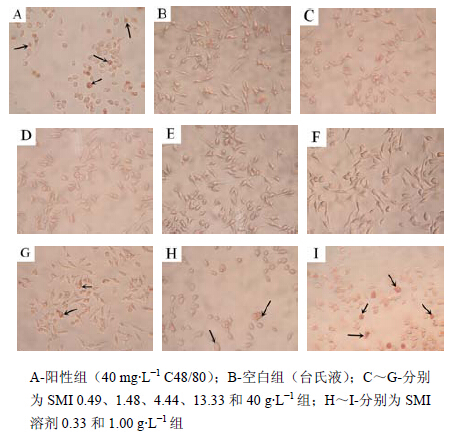 | 图 1 RBL-2H3细胞中性红染色结果)Fig. 1 Result of neutral red staining of RBL-2H3 cells |
实验结果表明:与空白组相比,阳性组细胞上清β-己糖苷酶释放明显,与预期结果相符;SMI溶剂组Tween-80质量浓度大于0.33 g/L后,细胞β-己糖苷酶的释放率明显增高(P<0.05);SMI浓度在13.33 g生药/L(3倍临床浓度)以下时,β-己糖苷酶释放无差异;而在Tween-80质量浓度为1.00 g/L时,SMI 40 g/L(9倍临床浓度)组和溶剂1.00 g/L组细胞β-己糖苷酶释放率均明显增加(P<0.05)(表 2)。提示质量浓度为40 g生药/L的SMI能致RBL-2H3细胞脱颗粒,且这种脱颗粒作用可能与溶剂Tween-80有关。
| 表 2 SMI对RBL-2H3细胞β-己糖苷酶和组胺释放率的影响(x±s,n=5) Table 2Effectof SMI on release rates of β-hexosaminidase and histamine of RBL- 2H3 cells(x±s,n=5) |
2.4.1 组胺对照品质量浓度-荧光值工作曲线 以组胺对照品质浓度为横坐标,荧光值为纵坐标作图,得标准曲线为y=0.374 3x+11.214(R2=0.994 7),可知组胺-OPT缩合物的荧光值与底物组胺对照品的浓度之间存在明显的线性关系,说明用此方法检测待测样品中的组胺可行。
2.4.2 药物刺激RBL-2H3细胞的组胺释放率实验结果显示,与空白组相比,阳性组细胞上清组胺释放显著,与预期相符;SMI溶剂组Tween-80质量浓度在0.11~1.00 g/L组胺释放显著;SMI质量浓度在0.49~4.44 g生药/L组胺释放不明显;而在Tween-80的质量浓度分别为0.33~1.00 g/L时,SMI质量浓度在13.33~40.00 g生药/L,SMI和溶剂组细胞组胺释放率均明显升高(P<0.05)(表 2)。以上结果说明,SMI在高于13.33 g生药/L& lt; span style='font-family:宋体'>(3倍临床浓度)后能刺激RBL-2H3细胞脱颗粒,且脱颗粒程度与其所含Tween-80的量呈正相关。
2.5 SMI对RBL-2H3细胞活力的影响结果显示,与空白组相比,SMI溶剂1.00 g/L组细胞活力明显降低(P<0.05),而SMI各浓度组细胞活力均无统计学差异,提示各浓度的SMI对RBL-2H3细胞的毒性作用不明显(表 3)。
| 表 3 SMI对RBL-2H3细胞活力的影响(x±s,n=5) Table 3 Effectof SMI on viability of RBL-2H3 cells(x±s,n=5) |
近年来,具有操作简便、成本低、重复性高的特点的RBL-2H3细胞脱颗粒模型,已成为评价中药注射剂类过敏性反应的一种常见的模型[14],其评价结果的准确性也逐步提高。就评价的指标而言,组胺[15]、类胰蛋白酶、白三烯和β-己糖苷酶[16]等 RBL-2H3细胞释放的活性物质是检测类过敏反应常见的指标[14],但不同指标的释放程度和敏感性也不一,因而需要筛选敏感性较好的指标。而C48/80作为一种非免疫型刺激剂,极小剂量就能明显刺激RBL-2H3脱颗粒,是建立RBL-2H3细胞脱颗粒模型常用的阳性药,通过检测细胞的各种活性物质的释放程度可进行检测指标的优化[17]。本研究选择C48/80为工具药,来筛选RBL-2H3细胞脱颗粒模型最佳的检测指标,结果表明β-己糖苷酶和组胺的释放程度较高且均有量-效关系,而类胰蛋白酶几乎没有释放。因此,评价SMI的脱颗粒时最佳的指标为β-己糖苷酶和组胺释放率。此外,考虑到SMI为黄色的澄明液体,药物本身颜色会干扰需经比色法原理的指标的检测,因而检测β-己糖苷酶时添加本底对照,检测组胺时采用灵敏度较高的间接荧 光法。
就RBL-2H3细胞脱颗粒模型的最佳条件选择来说,本研究采用正交实验法,设置浓度和作用时间两个因子,在细胞活力大于80%情况下选择细胞活性物质释放程度较高的条件作为最优条件,结果表明,C48/80质量浓度不应超过50 mg/L,最佳作用时间为30 min。而临床中所见的类过敏反应具有速发性的特点,一般在初次给药30 min之内发生[14],故选择SMI处理RBL-2H3细胞的时间为30 min。
中药注射剂产生类过敏反应的原因有多种,主要是由药物本身成分或添加剂所致。研究表明,作为中药注射剂常用辅料的Tween-80可通过激活补体途径或者直接诱导肥大细胞脱颗粒而导致类过敏性反应的发生[18, 19, 20]。故此,本研究在评价SMI的类过敏性反应时,将SMI和其溶剂(Tween-80)原液进行等比稀释分别作用于RBL-2H3细胞,来探究SMI致细胞脱颗粒作用程度以及与溶剂的关系。本研究结果显示,药物与RBL-2H3细胞作用30 min后,与空白组相比,SMI溶剂Tween-80质量浓度在大于0.11 g/L(临床浓度)后确能刺激RBL-2H3细胞脱颗粒,与预期相符;SMI质量浓度低于13.3 g生药/L(3倍临床浓度)时,细胞中性红染色未见脱颗粒现象,组胺和β-己糖苷酶释放率亦无差异;而在所含Tween-80质量浓度同为1.00 g/L时,SMI 40 g/L组和溶剂& lt; span lang="EN-US">1.00 g/L组细胞中性红染色亦可见脱颗粒现象β-己糖苷酶和组胺释放均明显增加,提示,SMI在质量浓度为40 g生药/L时能诱导RBL-2H3细胞脱颗粒,且这种脱颗粒作用可能与所含溶剂Tween-80有关。
与此同时,有文献报道,药物引起的细胞的凋亡或坏死也可以直接刺激细胞释放大量的炎症介质[21],干扰对实验结果的评定。因此,本研究用CCK-8法检测了药物对RBL-2H3细胞的活力的影响,结果发现,药物与RBL-2H3细胞作用30 min后,与空白组相比,SMI各剂量组无差异,说明SMI对RBL-2H3细胞无药源性毒性。
综上所述,在本试验的条件下,SMI在质量浓度低于13.33 g生药/L(3倍临床浓度)对RBL-2H3细胞无明显的脱颗粒作用;而在质量浓度为40 g生药/L(9倍临床浓度)下能明显刺激RBL-2H3细胞脱颗粒,且这种脱颗粒作用与溶剂Tween-80的质量浓度有关,与其对细胞的毒性无关。提示SMI在低于3倍临床浓度下相对安全,在9倍临床浓度时具有潜在致类过敏性反应的风险。
但是,由于人体内的类过敏反应是药物与机体多种靶细胞的综合作用,RBL-2H3细胞脱颗粒与类过敏反应的相关性还有待进一步探究,要想客观评价SMI的类过敏性反应,还需结合其他细胞或整体动物模型[4],通过各种模型评价结果的综合分析来确定SMI所致类过敏反应的剂量和程度,从而指导临床用药。
| [1] | 张惠霞, 陈建玉, 宋 成.3 414例中药注射剂不良反应分析 [J].药物警戒, 2006, 2(3): 232-235. |
| [2] | 张 頔, 屈 哲, 霍桂桃, 等.中药注射剂诱发过敏性反应的临床前安全性评价 [J].药物评价研究, 2013, 36(4): 241-244. |
| [3] | 李黎明, 金若敏, 李小月.中药注射剂类过敏反应实验研究进展 [J].中药药理与临床, 2012, 28(1): 187-190. |
| [4] | 马宏图, 睢凤英.中药注射剂安全性与类过敏反应 [J].中国医院药学杂志, 2009, 29(10): 838-840. |
| [5] | Szebeni J.Complement activation-related pseudoallergy: a new class of drug-induced acute immune toxicity [J].Toxicology, 2005, 216(2-3): 106-121. |
| [6] | 朱远洪, 王 青, 董 燕, 等.生脉注射剂致RBL-2H3细胞与大鼠腹腔肥大细胞脱颗粒研究 [J].广州中医药大学学报, 2014, 31(3): 410-413. |
| [7] | 刘 炯, 汤家铭, 吴文斌.中药注射剂致RBL-2H3细胞脱颗粒的研究 [J].上海中医药大学学报, 2012, 26(5): 85-90. |
| [8] | 罗 霞, 王 青, 周 联, 等.几种常见中药注射剂对RBL-2H3细胞脱颗粒的影响 [J].中药新药与临床药理, 2009, 20(6): 506-510. |
| [9] | 陈萌霞.参麦注射液不良反应52例分析 [J].湖南中医药大学学报, 2013, 33(11): 63-67. |
| [10] | 万凯化, 高 菁, 付辉政, 等.参麦注射液致349例不良反应病例报告分析 [J].中国药物滥用防治杂志, 2014, 20(2): 71-73. |
| [11] | Momoko Ishida a, Kosuke Nishi a, Hisashi Watanabe, et al.Inhibitory effect of aqueous spinach extract on degranulation of RBL-2H3 cells [J].Food Chem, 2013, 136(2): 322-327. |
| [12] | 易娟娟, 谢家骏, 张立波, 等.RBL-2H3细胞体外试验评价药物类过敏的方法学研究和适用性考察 [J].中国实验方剂学杂志, 2014, 20(13): 180-184. |
| [13] | 向军俭, 陈华粹.组胺的荧光测定法的研究 [J].中国医学科学院学报, 1981, 3(3): 183-187. |
| [14] | 赵 吟, 李 钦, 张信岳.基于RBL-2H3细胞模型的Ⅰ型过敏反应和类过敏反应研究 [J].中国临床药理学与治疗学, 2010, 15(11): 1310-1314. |
| [15] | 邓向亮, 朱远洪, 王 青, 等.检测原代肥大细胞组胺释放分析中药注射剂致类过敏性 [J].中国实验方剂学杂志, 2013, 19(21): 271-275. |
| [16] | Hepbildikler S T, Sandhoff R, Kolzer M, et al.Physiological Substrates for human lysosomal β-Hexosaminidase [J].J Boil Chem, 2002, 277(4): 2562-2572. |
| [17] | Jun Ho Lee, Jin Young Seo, Na Young Ko, et al.Inhibitory activity of Chrysanthemi sibirici herbaextract on RBL-2H3 mast cells and compound 48/80-induced anaphylaxis [J].J Ethnopharmacol, 2004, 95(2-3) 425-430. |
| [18] | Coor E A, Seybold H, Merk H F, et al.Polysorbate 80 in medical products and nonimmunologic anaphylactoid reactions [J].Ann Allergy Asthma Immunol, 2005, 95(6): 593-599. |
| [19] | 张 嘉, 李贻奎, 李连达, 等.补体系统激活在吐温80导致类过敏反应中的作用 [J].毒理学杂志, 2009, 23(6): 457-459. |
| [20] | 李 佳, 金 晶, 关翠雯, 等.聚山梨酯80刺激肥大细胞RBL-2H3脱颗粒作用的评价 [J].药物评价研究, 2010, 33(5): 379-382. |
| [21] | 林 静, 李大主.细胞焦亡: 一种新的细胞死亡方式 [J].国际免疫学杂志, 2011, 34(3): 213-216. |
 2015, Vol. 38
2015, Vol. 38


