2. 军事医学科医学院毒物药物研究所, 抗毒药物与毒理学国家重点实验室(军事医学科学院), 国家北京药物安全评价研究中心, 北京 10085;
3. 解放军302医院全军中药研究所, 北京 100039;
4. 国家生物医学分析中心, 北京 10085;
5. 北京市海淀区卫生局卫生监督所, 北京 100037
2. State Key Laboratory of Toxicology and Medical Countermeasures (Academy of Military Medical Sciences), National Beijing Center for Drug Safety Evaluation and Research, Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China;
3. Department of Pharmacy, 302 Hospital of PLA, Beijing 100039, China;
4. National Center of Biomedical Analysis, Beijing 100850, China;
5. The Bureau for Health Inspection and Supervision of Haidian District, Beijing 100037, China
大黄素是一种蒽醌类衍生物,主要来源于蓼科植物掌叶大黄根茎,其化学名称为1,3,8-三羟基-6-甲基蒽醌(1,3,8-trihydroxy-6-methyl anthraquinone),是大黄的主要有效单体。长期以来,大黄素被传统中医认为具有泻下的作用,现认为还有抗菌消炎[1]、抗肿瘤[2]、免疫抑制、保肝[3]、抗肾脏纤维化[4]等药理作用。近年来,大黄提取成分的肾毒性引起众多关注。2001年,美国毒理学会研究报道大鼠经口暴露大黄素可诱导肾小管出现透明样小滴,严重者可见肾小管内色素沉着。Yan等[5]报道大黄蒽醌类衍生物可诱导SD大鼠肾小管上皮细胞的肿胀和变性。此后,大黄的肾毒性引起人们的关注,细胞毒性研究表明:人肾小管上皮细胞(HK-2)对大黄素敏感,大黄素可通过活化caspase 3介导的细胞凋亡诱导HK-2细胞损害[6]。本实验室的研究还表明大黄对HK-2细胞的损伤机制与有大黄素诱导细胞线粒体膜电位下降及细胞周期阻滞在S期有关。
现有的研究已对大黄素在临床的安全应用敲响了警钟,进一步研究寻找能早期监测大黄素诱导肾功能损害的生物标志物非常有意义。大黄素诱导的肾功能损害经常是伴随长期用药的慢性损害过程,传统的毒理学手段包括血液生化、组织病理及免疫组化等受限于灵敏度或特异性,无法很好地表征肾功能的早期损害,难以预测慢性肾损害的发展进程。近年来,代谢组学技术被越来越多地应用于药物毒理研究领域,在揭示药物的毒性机制、识别与靶器官损害,尤其是肝肾损害相关联的代谢生物标志物方面发挥着重要作用。技术方面的改进提高了以核磁共振技术(NMR)为基础的代谢组学方法的灵敏度及核磁谱的分辨率。近年来采用NMR为基础的代谢组学研究在揭示了早期肝毒性[7]、肾毒性事 件[8,9]的生物标志物方面发挥了重要作用。基于此本研究拟采用1H NMR技术来揭示大黄素肾毒性的机制,寻找服用大黄素诱导肾脏损害的早期生物标志物,为大黄素在临床的安全应用提供依据。
1 材料与方法 1.1 动物、试剂和仪器SD大鼠,体质量180~200 g,北京维通利华实验动物技术有限公司提供,SPF级。饲养于军事医学科学院国家北京药物安全评价研究中心屏障设施内,常规喂养,自由饮水;温度21~25 ℃,湿度30%~70%,饲养一周后使用。实验设施合格证号为SCXK-(军)2007-008。本中心是国际实验动物评估和认可管理委员会(AAALAC)认可单位,也完全遵守中华人民共和国的相关实验动物福利的管理规定。动物试验方案将提交本中心的动物福利委员会(IACUC)审查。经动物福利委员会批准后方可开始试验。
大黄素,质量分数≥98%,购自江苏淮安市久泰生物技术有限公司。D2O、CDCl3和CD3OD购自北京京巨化工科贸有限责任公司;2,2,3,3-三甲基甲硅烷基丙酸(TSP)购自加拿大莫克公司,乙腈为市售级优质纯;Varian UNITYINOVA 600型超导傅里叶变换NMR仪,购自美国瓦里安公司;7020型全自动生化分析仪购自日本日立公司。
1.2 方法 1.2.1 实验设计雄性大鼠20只,随机分为溶剂对照,大黄素170、500、1 500 mg/(kg∙d)3个剂量组,每组5只,ig给药,连续给药16 d,停药后用代谢笼低温下收集24 h尿液,接尿的容器事先加有100 μL 1 mmol/L的NaN3,收集的尿液经2 000 ×g低温离心后取上清−80 ℃冻存。尿液收集完毕,动物采用乙醚麻醉,心脏采血,制备血浆,随后每只动物解剖取左侧肾脏,分成两份,一份约250 mg,液氮速冻,−80 ℃保存;另一部分肾脏4%福尔马林固定后,做组织病理学切片,而高剂量组动物留取部分肾脏做透射电镜观察。
1.2.2 血浆生化指标检测采用7020自动生化分析仪测定以下血液生化指标:丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、TP(总蛋白)、血钙(CA)、肌酐(Crea)、尿素氮(BUN)、肌酸激酶(CK)、血清白蛋白(ALB)、总胆固醇(Tchol)和血糖(GLU)。英国RANDOX定值血清质控,所有的数据经SAS 6.0统计软件进行单因素设计资料的方差分析。
1.2.3 肾脏组织病理学检查给药结束24 h后,处死大鼠,取出肾脏,生理盐水冲洗表面的血污,依次经过10%中性福尔马林固定、组织修切、石蜡包埋、常规切片、HE染色、酒精梯度脱水、透明、封片,最后作光学显微镜观察。
1.2.4 肾脏组织的超微结构观察处死动物后取出肾脏,用PBS清洗2~3次后,添加3%的戊二醛、1%的锇酸固定液双重固定,乙醇、丙酮梯度脱水,EPON 812环氧树脂浸透包埋,透射电镜观察细胞超微结构变化。
1.2.5 大鼠血浆处理及NMR数据的采集与分析参照文献[10],具体为取血浆样品4 000 r/min离心10 min,取400 μL上清,添加200 μL的D2O,100 μL的10% TSP,混匀,转入5 mm核磁管中进行测试。在NMR仪上调用NOESY脉冲序列,首先弛豫时间编辑实验,观测小分子信号为主。然后扩散编辑实验,观测大分子信号,调用LEDbpp序列,将satfrq和tof设置在水峰的位置,FID信号经32 k傅里叶变换转为NMR谱图。在VNMR中调用宏指令将需要分析的一组数据集合变成数组的1D数据,以乳酸为化学位移参考峰的位置(δ1.34),调用VNMR中的程序将1H谱按默认值(从δ4.6到δ0.4,每段为δ0.04,同时去掉以溶剂峰为中心的部分)进行分段并积分。将积分数据归一化后以Excel文件贮存,用于主成分分析。
1.2.6 尿液处理及NMR数据采集分析参照文献[11],尿液于4 ℃、3 000×g离心10 min,取400 μL上清加入200 μL缓冲液(0.2 mol/L Na2HPO4/NaH2PO4,pH=7.4),放置10 min,4 ℃、13 000×g离心10 min。取上清300 μL,添加30 μL的10% TSP(1 mg/mL)/ D2O,混匀,转入5 mm核磁管中进行测试。在NMR仪上调用NOESY脉冲序列,satfrq和tof都设置在水峰的位置。FID信号经32 k傅里叶变换转为NMR谱图。在VNMR中调用宏指令将需要分析的一组数据集合变成数组的1 D数据,以TSP为化学位移参考峰的位置(δ0),调用VNMR中的程序将1H谱按默认值(从δ9.5到δ0.5,每段为δ0.04,同时去掉以溶剂峰为中心的部分)进行分段并积分。分析之前将水峰、脲素类活性氢所在的位移δ4.6~6.2去除。将积分数据归一化后以Excel文件贮存,用于主成分分析。
1.2.7 肾组织处理及NMR数据采集分析参照文献[12],从液氮中取出肾组织,约250 mg,加入50%的CH3CN和50%的H2O,在冰浴中制成匀浆,4 ℃、5 070×g离心15 min,上清和沉淀分别处理。
取离心后的上清,用氮气吹去CH3CN后,放入冷冻干燥机中,冷冻干燥5 h。取出干燥后的样品,加入500 μL的D2O和100 μL 10%的TSP。混匀后14 000×g离心15 min(除去溶液中肝组织的沉淀微粒),取上清液550 μL,转入5 mm核磁管中进行测试。在NMR仪上调用presat脉冲序列,将satfrq和tof设置在水峰的位置。FID信号经32 k傅里叶变换转为NMR谱图。在VNMR中调用宏指令将需要分析的一组数据集合变成数组的1D数据,以TSP为化学位移参考峰的位置(δ 0),调用VNMR中的程序将1H谱按默认值(从δ9.5到δ0.5,每段为δ0.04,同时去掉以溶剂峰为中心的部分)进行分段并积分。
取离心后的沉淀,用2 mL 75%的CHCl3和25%的CH3OH的溶液萃取,4 ℃、5 070×g离心15 min。取上清夜,用氮气吹去CH3CN后,放入冷冻干燥机中,冷冻干燥5 h。取出干燥后的样品,加入600 μL 75% CDCl3/25% CD3OD,放置10~15 min,14 000×g离心10 min。取上清夜,转入5 mm核磁管中进行测试。在NMR仪上调用presat脉冲序列,将satfrq和tof设置在水峰的位置。FID信号经32 k傅里叶变换转为NMR谱图。在VNMR中调用宏指令将需要分析的一组数据集合变成数组的1D数据,调用VNMR中的程序将1H谱(从δ6.5到δ0.5,每段为δ0.04,同时去掉以溶剂峰为中心的部分)进行分段并积分。分析之前把δ3.32~3.44和δ3.94~4.60去除。
将积分数据归一化后以Excel文件贮存,用于主成分分析。
1.2.8 数据统计及主成分分析
血液生化指标、体质量及脏器系数经SAS 6.0统计软件采用方差分析比较各组间的差异;主成分分析先将积分值进行中心化和比例换算处理,再用SIMCA-P 10.0(Umetrics AB,Umea,Sweden)软件进行PCA(Principal Component Analysis)分析或PLS-DA分析,求出主成分PC(Principal Component),利用PC对代谢产物进行分析。
2 结果 2.1 大黄素对大鼠体质量和血浆生化指标的影响1 500 mg/(kg∙d)大黄素连续给药16 d能够引起大鼠体质量下降,并呈现出剂量-效应关系,给药结束恢复10 d后体质量与对照组没有明显的差异,而肾脏脏器系数没有明显的变化,见表 1。
血浆生化指标分析表明,1 500 mg/(kg∙d)大黄素服用16 d可引起大鼠血肌酐下降,与对照组相比差异有显著性,这可能与大黄素能够促进肌酐排泻有关。其他指标未见明显的改变,见表 2。
| 表 1 大黄素对大鼠体质量和肾脏脏器系数的影响 (x±s,n=5) Table 1 Effectsof emodin on weight and kidney organ coefficient (x±s,n=5) |
| 表 2 大黄素对大鼠血浆生化指标的影响 (x±s,n=5) Table 2 Effectsof emodin on serum biochemical indicators in rats (x±s,n=5) |
光镜检查发现1 500 mg/kg组大鼠肾近曲小管出现空泡变性,透射电镜检查发现大黄素能够引起肾细胞胞浆中出现数量较多的空泡化改变,见图 1。
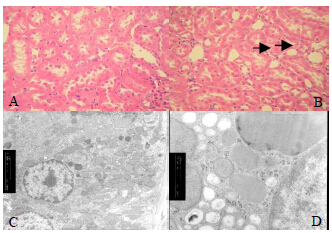 | A-对照组,示肾脏结构正常;B-大黄素1 500 mg/kg组,箭头示肾小管上皮细胞空泡变性;C-对照组,超微结构正常;D-大黄素1 500 mg/kg组,可见胞浆空泡化 A&C- Control rats,exhibited normal morphology. B&D- The high-dose emodin-treated (1 500 mg/kg/d) rat exhibited cytoplasmic vacuolar degeneration of renal tubular epithelial cells.图 1 大黄素致大鼠肾脏损伤组织病理学和透射电镜检查Fig.1 Photomicrographs and TEM photographs of kidneys |
血浆的1H NMR谱峰积分值的OSC结果见图 2,由图 2A可见,对照组与大黄素中剂量组有个别点交叉,但可与高、低剂量组完全区分开,结合散点负荷图(图 2B)和1H NMR谱图分析,高剂量组的肌氨酸(δ 3.62)、异丁酸盐(δ 1.22)和3-羟基丁氨酸(3-HB,δ 1.26)升高,乳酸(δ 1.34,δ 4.14)、丙氨酸(δ 1.48)、酪氨酸(δ 6.92,δ 7.22)、胆碱/磷酸卵磷酯(δ 3.3)、葡萄糖和氨基酸(δ 3.4~4.0)、极低密度脂蛋白/低密度脂蛋白(VLDL/LDL)、肌酐(δ 3.06)的下降与此分离有关。该结果与血浆生化指标检测结果一致,血浆中大分子物质包括多种血脂类成分(如VLDL/LDL)等的下降,以及各种饱和和不饱和游离脂肪酸均下降,可能与大黄素的降血脂作用有关,见图 3。
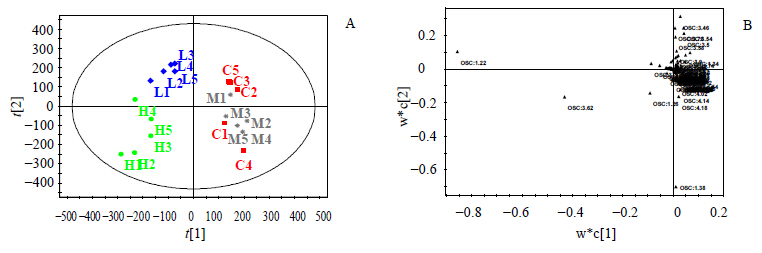 | C-对照组;H-大黄素1 500 mg/kg组;M-大黄素500 mg/kg组;L-大黄素170 mg/kg组 C- control group; H- emodin 1 500 mg/kg; M- emodin 500 mg/kg; L- emodin 170 mg/kg图 2 大黄素给药后大鼠血浆散点分布图(OSC)(A)和1H NMR谱的主成分分析值的散点分布图(B)Fig.2 PLS-DA scores plot of blood plasma samples from emodin treated rats (OSC) (A) and PLS-DA loadings plot of 1H-NMR spectra (B) |
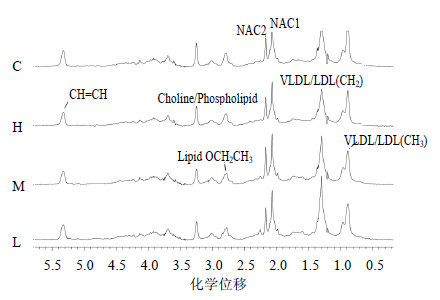 | C-对照组;H-大黄素1 500 mg/kg组;M-大黄素500 mg/kg组;L-大黄素170 mg/kg组 C- control group; H- emodin: 1 500 mg/kg; M- emodin: 500 mg/kg; L- emodin:170 mg/kg图 3 大黄素给药后大鼠血浆1H NMR谱(LED)Fig.3 1H-NMR spectra (LED) of blood plasma samples from rats treated with emodin |
尿液的1H NMR谱峰积分值的PLS-DA结果见图 4,由图 4A可知,对照组和大黄素高、中、低剂量组能够完全区分开,结合散点负荷图(图 4B)和1H NMR谱图分析,与对照组相比,肌酐(δ 3.06,δ 4.06)、葡萄糖氧化三甲胺(TMAO)(δ 3.26)、醋酸盐(δ 1.94)、乳酸(δ 1.34),N-乙酰-β-D-葡萄糖苷酶(NAG)(δ 2.14,δ 2.18)、葡萄糖和氨基酸(δ 3.74,δ 3.5~4.7)、丙氨酸(δ 1.48)、缬氨酸(δ 0.99)和亮氨酸/异亮氨酸(δ 0.9)明显升高,而柠檬酸盐(δ 2.54,δ 2.66)、马尿酸(δ 3.98,δ 7.82,δ 7.62)、2-酮戊二酸(δ 2.46,δ 3.02)、牛磺酸(δ 3.42)和甘氨酸(δ 3.58)水平下降贡献于给药组与对照组的分离。
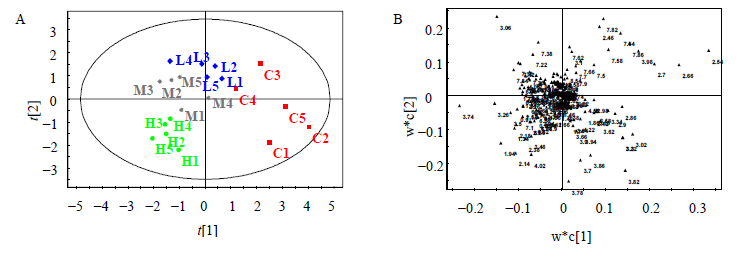 | C-对照组;H-大黄素1 500 mg/kg组;M-大黄素500 mg/kg组;L-大黄素170 mg/kg组 C- control group; H- emodin: 1 500 mg/kg; M- emodin: 500 mg/kg; L- emodin:170 mg/kg图 4 大黄素给药后大鼠尿液1H-NMR谱的主成分分析值的散点分布图(A)和散点负荷图(B)Fig.4 PLS-DA scores plot (A) and PLS-DA loadings plot (B) based on 1H NMR spectra of urine samples from rats administered with emodin |
肾组织水溶性提取物中醋酸盐(δ 1.94)、甘氨酸(δ 3.58)、血酮(3-HB)(δ 1.22)和肌酐/肌酸(δ3.06,3.94)明显增加,而乳酸(δ 1.34)和胆碱/磷酸卵磷脂(δ 3.22,3.26)下降。脂溶性萃取 物中出现的明显变化主要包括脂类对应的-COCH2CH2(δ 1.6),-HC=CHCH2(δ 2.0),-CH2OCOR(δ 4.28)和-CH2OPO2(δ 4.16)在大黄素处理组升高,而脂类对应的-CH3(δ 1.32)和-CH2(δ 1.28)下降。饱和与不饱和脂肪酸以及磷脂的成分比例发生较为明显的改变。提示大黄素所致肾脏损伤的可能原因,与能量代谢中脂类代谢改变有关,见图 5、6。
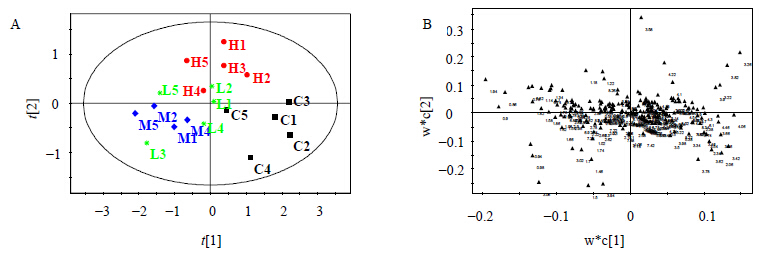 | C-对照组;H-大黄素1 500 mg/kg组;M-大黄素500 mg/kg组;L-大黄素170 mg/kg组 C- control group; H- emodin: 1 500 mg/kg; M- emodin: 500 mg/kg; L- emodin: 170 mg/kg图 5 大黄素给药后大鼠肾脏水溶性提取物1H-NMR谱的主成分分析值的散点分布图(A)和散点负荷图(B)Fig.5 PLS-DA scores plots (A) and PLS-DA loadings plots (B) based on 1H-NMR spectra of kidney tissue aqueous extracts of rats administered with emodin |
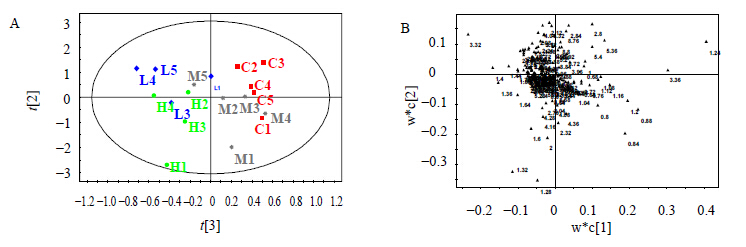 | C-对照组;H-大黄素1 500 mg/kg组;M-大黄素500 mg/kg组;L-大黄素170 mg/kg组 C- control group; H- emodin 1 500 mg/kg; M- emodin 500 mg/kg; L- emodin 170 mg/kg图 6 大黄素给药后大鼠肾脏脂溶性提取物1H-NMR谱的主成分分析值的散点分布图(A)和散点负荷图(B) Fig.6 PLS-DA scores plots (A) and PLS-DA loadings plots (B) based on 1H-NMR spectra of kidney tissue lipid soluble extracts |
实验结果表明,1 500 mg/(kg∙d)大黄素重复给药16 d可导致血肌酐水平明显下降,这可能与大黄素可促进肌酐的排出有关[13]。肾组织的光镜及电镜检查结果表明肾近曲小管是大黄素的敏感靶部位,损害特征为细胞内空泡状变性,反映细胞出现了代谢异常的改变。
血浆NMR分析表明糖和氨基酸水平下降,这可能与大黄素抑制大鼠摄食量的减少和体质量的下降有关[14],其中血糖和VLDL/LDL的下降可能也与大黄素的降脂效应有关。正常情况下,几乎所有的糖和低相对分子质量氨基酸可被肾近曲小管重吸收,本研究发现:大鼠1 500 mg/(kg∙d)大黄素反复给药16 d可导致糖尿和氨基酸尿,同时尿液中醋酸盐和TMAO水平升高,前者提示肾近曲小管出现急性损伤,导致重吸收能力下降,后者反映肾髓质的损伤[15],同样出现在其他药物诱导的肾损害 中[16,17];此外,尿液中柠檬酸升高被认为是反映肾小管酸中毒的NMR生物标志物;大黄素诱导代谢成分的改变与马兜铃酸和NaCrO4[18]诱导的肾毒性相似。
肾组织萃取物中醋酸盐、3-HB升高提示酮体可能成为肾近曲小管细胞的主要供能物质;磷脂酰胆碱是细胞膜的重要成分,游离不饱和脂肪酸的供应
不足可影响其合成。血浆中磷脂酰胆碱的下降通常意味着细胞膜和亚细胞器膜的功能受损。而饱和与不饱和脂肪酸比例的紊乱与镉诱导的肾毒性代谢轮廓类似[19]。据此分析大黄素诱导的肾毒性可能与脂肪代谢紊乱有关。本课题组在体外研究中发现,大黄素可诱导HK-2细胞线粒体膜电位下降,进一步诱导细胞的凋亡发生,这些机制最终可能也贡献于大鼠大黄素经口染毒导致的肾小管重吸收功能下降。据此推测大黄素可能通过导致脂类代谢异常,破坏细胞膜性结构的功能,继而导致肾小管上皮细胞受损诱导重吸收功能障碍。这一假说仍需要进一步研究来证实。血液中糖和VLDL/LDL下降、尿液中的氨基酸、葡萄糖、3-HB及TMAO升高可作为大黄素诱导早期肾毒性的潜在生物标志物。本研究结果证实代谢组学技术可以应用于大黄素的早期肾毒性的监测。
| [1] | Hazni H, Ahmad N, H itotsuyanagi Y, et al. Phytochemical constituents from Cassia alata with inhibition again stmethicillin-resistant Staphylococcus aureus (MRSA)[J]. Planta Med, 2008, 74(15): 1802-1805. |
| [2] | Wang X J, Yang J, Cang H, et al. Gene expression alteration during redoxd ependent enhancement of arsenic cytotoxicity by emod in in HeLa cells[J]. Cell Res, 2005, 15(7): 511-522. |
| [3] | 童洪飞, 林胜璋, 杨 潇, 等. 大黄素抗大鼠肝移植急性排斥反应的实验研究[J]. 中华中医药杂志, 2009, 24(1): 49-52. |
| [4] | Bhadauria M, Shrivastava S, Nirala S K, et al. Emodin reverses CCl4 induced hepatic cytochrome P450 (CYP) enzymatic and ultra-structural changes: The in vivo evidence[J]. Hepatol Res, 2009, 39(11): 290-300. |
| [5] | Yan M, Zhang L Y, Sun L X, et al. Nephrotoxicity study of total rhubarb anthraquinones on Sprague Dawley rats using DNA microarrays[J]. J. Ethnopharmacol, 2006, 107(2), 308-311. |
| [6] | Wang C F, Wu X D, Chen M, et al. Emodin induces apoptosis through caspase 3-dependent pathway in HK-2 cells[J]. Toxicology, 2007, 231(2-3): 120-128. |
| [7] | Schnackenberg L K, Sun J, Espandiari P, et al. Metabonomics evaluations of age-related changes in the urinary compositions of male Sprague–Dawley rats and effects of data normalization methods on statistical and quantitative analysis[J]. BMC Bioinformatics, 2007, (Suppl. 7): S3. |
| [8] | Kim K B, Um S Y, Chung M W, et al. Toxicometabolomics approach to urinary biomarkers for mercuric chloride (HgCl)-induced nephrotoxicity using proton nuclear magnetic resonance (1H NMR) in rats[J]. Toxicol Appl Pharmacol, 2010, 249(2): 114-126. |
| [9] | Zhang A, Sun H, Wang P, et al. Recent and potential developments of biofluid analyses in metabolomics[J]. J Prot, 2012, 75(4): 1079-1088. |
| [10] | Waters N J, Waterfield C J, Farrant R D, et al. Metabonomic deconvolution of embedded toxicity: application to thioacetamide hepato-and nephrotoxicity[J]. Chem Res Toxicol, 2005, 18(4): 639-654. |
| [11] | Robertson D G, Reily M D, Sigler R E, et al. Metabonomics: evaluation of nuclear magnetic resonance (NMR) and pattern recognition technology for rapid in vivo screening of liver and kidney toxicants[J]. Toxicol. Sci, 2000, 57(2): 326-337. |
| [12] | Atherton H J, Bailey N J, Zhang W, et al. A combined 1H-NMR spectroscopy–and mass spectrometry–based metabolomic study of the PPAR-α null mutant mouse defines profound systemic changes in metabolism linked to the metabolic syndrome[J]. Physiol Genomics, 2006, 27(2): 178-186. |
| [13] | 俞长兴, 肖 蓬, 苏志红, 等. 大黄临床应用研究进展[J]. 中国医院用药评价与分析, 2002, 2(6): 359-362. |
| [14] | Connor S C, Wu W, Sweatman B C. Effects of feeding and body weight loss on the 1H-NMR-based urine metabolic profiles of male Wistar Han rats: implications for biomarker discovery[J]. Biomarkers, 2004, 9(2): 156-179. |
| [15] | Wang Y, Bollard M E, Nicholson J K., et al. Exploration of the direct metabolic effects of mercury II chloride on the kidney of Sprague–Dawley rats using high-resolution magic angle spinning 1H NMR spectroscopy of intact tissue and pattern recognition[J]. J Pharm Biomed Anal, 2006, 40(2): 375-381. |
| [16] | Sieber M, Hoffmann D, Adler M, et al. Comparative analysis of novel noninvasive renal biomarkers and metabonomic changes in a rat model of gentamicin nephrotoxicity[J]. Toxicol Sci, 2009, 109(2): 336-349. |
| [17] | Park J C, Hong Y S, Kim Y J, et al. A metabonomic study on the biochemical effects of doxorubicin in rats using (1)H-NMR spectroscopy[J]. J Toxicol Environ Health A, 2009, 72(6): 374-384. |
| [18] | Zhang X Y, Wu H F, Liao P Q, et al. NMR-based metabonomic study on the subacute toxicity of aristolochic a cid in rats[J]. Food Chem Toxicol, 2006, 44(7): 1006-1014. |
| [19] | Griffin J L, Walker L A, Troke J, et al. The initial pathogenesis of cadium induced renal toxicity[J]. FEBS Letters, 2000, 478(1-2):147-150. |
 2015, Vol. 38
2015, Vol. 38


