2. 深圳海王药业有限公司, 广东 深圳 518057
2. Shenzhen Neptunus Pharmaceutical Co., Ltd., Shenzhen 518057, China
梅花参Thelenota ananas为棘皮动物门海参纲刺参科梅花参属的动物,具有补肾壮阳的功效,岩藻聚糖硫酸酯(fucoidan)是梅花参体壁的重要组成多糖,其主要由岩藻糖及硫酸酯基团组成[1]。大量研究表明[1, 2],岩藻聚糖硫酸酯具有抗凝血、降血脂、抗氧化、抗肿瘤、调节机体免疫等多种生物 活性。
多糖类化合物由于极性强,异构体复杂多变,理化性质相似,相对分子质量大,无紫外吸收等特点,其分析方法一直是一个难题,目前,多糖的含量测定方法主要有比色法、气相色谱法、高效液相色谱法-柱前衍生化紫外检测法或示差法。比色法只能测定总糖含量且影响因素多,误差大;气相色谱法、高效液相色谱法-柱前衍生化紫外检测法或示差法对岩藻聚糖硫酸酯进行分析测定,必须先经衍生化处理,步骤繁琐,引入误差大[3]。亲水作用色谱(HILIC)是采用极性固定相,以含高浓度极性有机溶剂和低浓度水溶液为流动相进行分离,因此HILIC适于对极性化合物的分离,近年来在糖类成分分析发展较快,蒸发光检测器(ELSD)作为一种通用型检测器最大的优势在于可以测定无紫外吸收的化合物,稳定性好,灵敏度高,无溶剂峰干扰等特点,弥补紫外检测器和示差折光检测器的不足[4]。因此,本研究尝试建立HILIC- ELSD法测定岩藻聚糖硫酸酯中岩藻糖的含量的方法,为岩藻聚糖硫酸酯新药的开发利用及质量控制提供依据。
1 仪器与试剂Agilent 1100高效液相色谱仪(美国安捷伦公司),Alltech 2000ES型蒸发光检测器(美国奥泰科技有限公司),Allchrom色谱数据处理工作站,梅特勒托利多分析天平(梅特勒托利多公司),KQ 300 DE型医用数控超声波清洗器(昆山市超声仪器有限公司),FDV—1200型冷冻干燥机(日本东京理化公司)。
岩藻糖对照品(美国Sigma公司,EC NO2194527,质量分数≥99.0%)。三氟乙酸、乙腈为色谱纯,实验用水为去离子水,岩藻聚糖硫酸酯样品为实验室自制(提取纯化自梅花参,批号20130821,平均重均分子量341 160,分布系数1.98)。
2 方法与结果 2.1 色谱条件色谱柱为Waters XBridgeTM Amide色谱柱(150 mm×4.6 mm,3.5 μm),流动相为乙腈-水-氨水(90∶10∶0.2),体积流量1 mL/min,柱温60 ℃,进样量10 μL。ELSD参数:漂移管温度80 ℃,雾化气(N2)体积流量2 L/min,撞击器关。岩藻糖对照品和岩藻聚糖硫酸酯样品的色谱图见图 1。
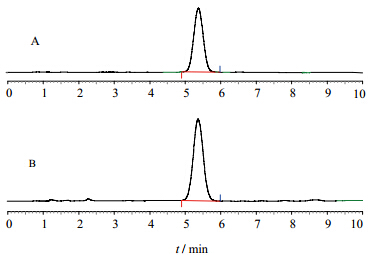 | 图 1 岩藻糖对照品(A)和岩藻聚糖硫酸酯样品(B)的HPLC-ELSD色谱图Fig.1 HPLC-ELSD chromatograms of fucose (A) and sample of fucoidan (B) |
精密称取岩藻糖对照品50.20 mg,置于50 mL量瓶中,用75%乙腈-水溶液溶解并稀释至刻度,摇匀,作为对照品储备液。分别精密量取储备液1、2、3、5、6、8、10 mL置于10 mL量瓶中,加75%乙腈-水溶液至刻度,摇匀,配制成浓度分别为0.100 4、0.200 8、0.301 2、0.502 0、0.602 4、0.803 2、1.004 mg/mL的对照品溶液,备用。
2.3 供试品溶液的制备取500 mg岩藻聚糖硫酸酯样品用50 mL水充分搅拌溶解,进行超声处理(超声功率300 W,时间为20 min,温度20 ℃),结束后,冷冻干燥,作为储备样品。
精密称取10.00 mg储备样品,置于安瓿瓶中,加入4 mol/mL TFA 4 mL,溶解并混合均匀,封口,于110 ℃恒温油浴中加热反应2 h,反应结束后,用甲醇旋蒸除去TFA,用75%乙腈-水溶液洗出,转移至5 mL量瓶中,并稀释至刻度,摇匀,溶液经0.45 μm微孔滤膜过滤后供HPLC检测。
2.4 方法学考察 2.4.1 检测限、定量限考察以3倍信噪比(S/N)确定岩藻糖的检测限为0.200 8 μg,以10倍信噪比(S/N)确定岩藻糖的定量限为0.502 μg。
2.4.2 线性关系考察取“2.2”项下岩藻糖对照品溶液分别进样10 μL,以峰面积的对数为纵坐标,质量浓度(μg/mL)的对数为横坐标作图,得到岩藻糖的线性回归方程为:Y=1.756 4 X+2.961 3(r=0.999 4),说明岩藻糖质量浓度在0.100 4~1.004 mg/mL线性关系良好。
2.4.3 精密度试验取“2.2”项下质量浓度为0.602 4 mg/mL的对照品溶液,按“2.1”项下的色谱条件进行测定,连续进样6次,记录色谱图,岩藻糖峰面积的RSD值为0.48%,表明仪器的精密度较好。
2.4.4 重复性试验取同一样品按照“2.3”项下方法平行制备6份溶液,进行HPLC-ELSD法分析,计算得岩藻糖的质量分数的RSD值为1.32%。
2.4.5 稳定性试验取同一份供试品溶液,分别放置0、2、4、6、8 h后进样进行稳定性考察。结果表明在8 h内岩藻糖的峰面积未发生明显变化,RSD值为2.01%,则供试品溶液在8 h稳定性良好。
2.4.6 加样回收率试验精密称定岩藻糖对照品18.75 mg,加入4 mol/mL TFA定容至25 mL,为储备液;准确称取供试储备品约10.00 mg,6份,置于安瓿瓶中,分别加入4 mL储备液,溶解并混合均匀,封口,于110 ℃反应2 h后,用甲醇旋蒸除去TFA,用75%乙腈-水溶液洗出,转移至10 mL量瓶中,并稀释至刻度,制备加样供试品液;按照“2.1”项下的色谱条件分别对加样供试品液进行分析,计算加样回收率,结果平均加样回收率为95.22%,RSD值为1.16%。
2.4.7 样品的测定按照“2.3项”下的样品处理溶液3份,按上述色谱条件分别进样10 μL,按随行标准曲线计算样品中岩藻糖的质量分数,结果分别为32.15%、31.95%、33.15%。
3 讨论 3.1 HPLC-ELSD法的选择本研究比较了半胱氨酸-硫酸法、高效液相色谱法-柱前衍生化紫外检测法、HPLC-ELSD法测定岩藻糖含量的对比实验。半胱氨酸-硫酸法、高效液相色谱法-柱前衍生化紫外检测法均参照文献[5, 6]。结果表明,半胱氨酸-硫酸法、高效液相色谱法-柱前衍生化紫外检测法衍生化过程繁琐,重复性差,本研究采用HPLC-ELSD法测定岩藻聚糖硫酸酯中岩藻糖含量,方法稳定、准确、重复性好。
3.2 色谱条件的优化根据文献报道[7, 8],流动相的组成及其挥发性是限制ELSD应用的主要因素,且柱温的改变,能极大的改善单糖峰形。因此,本实验主要考察了不同流动相:乙腈-水(75∶25)、乙腈-水(85∶15);乙腈-水-TFA(85∶15∶0.1)、乙腈-水-氨水(85∶15∶0.2)、乙腈-水-氨水(90∶10∶0.2),不同柱温(30、40、50、60 ℃)对实验结果的影响。结果表明,在碱性条件下,且增大乙腈的比例,样品的峰宽变窄,有利于样品中岩藻糖与其他杂质的分离。随着柱温的升高,色谱峰的保留时间变短,峰宽变窄。因此选择最佳流动相为乙腈-水-氨水(90∶10∶0.2),最佳柱温为60 ℃。
3.3 超声预处理促进酸水解多糖因含有大量羟基和一些其他极性基团,易产生分子内和分子间的氢键而形成晶体结构,使多糖分子具有一定的刚性,影响多糖的水解,同时酸水解也存在酸在糖聚合物中渗透慢,高温水解易造成糖组分破坏、酸解液颜色深等问题[9]。为了改进酸水解的效果,本研究采用超声预处理岩藻聚糖硫酸酯样品后再进行水解,且对水解条件进行了优化,结果表明,超声后的样品在4 mol/mL TFA的浓度下反应2 h后可水解完全。同时,超声酸水解比未超声酸水解方法测定的岩藻糖含量高10%左右,可能是超声波产生的能量能够破坏或减弱糖分子间和分子内的氢键,使其颗粒表面及内部结晶结构受到破坏,作用力减弱,从而能够更有效地催化水解 多糖。
经过与文献报道的常规试验方法的比较,并对其中主要影响因素深入考察后,本实验建立的超声酸水解预处理后,进行HILIC-ELSD法测定岩藻糖含量,简便快速,结果准确,重复性好。该测定方法的建立为岩藻聚糖硫酸酯在研究与工艺应用时的快速定量分析和质量评价研究提供了有力的参考。
| [1] | Yu L, Xue C G, Chang Y G, et al. Structure elucidation of fucoidan composed of a novel tetrafucose repeating unit from sea cucumber Thelenota ananas[J]. Food Chem, 2014(146): 113-119. |
| [2] | Kalimuthu S, Panchanathan M, Jayachandran V, et al. Brown seaweed fucoidan: biological activity and apoptosis, growth signaling mechansim in cancer[J]. Biol Macromol, 2013, (60): 366-374. |
| [3] | 刘 舒, 汪秋宽. 三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D]. 青岛: 中国海洋大学.2013. |
| [4] | Slimestad R, Vågen I M. Thermal stability of glucose and other sugar aldoses in normal phase high perfoumance liquid chromatography[J]. J Chromatogr A, 2006, (1118): 281-284. |
| [5] | YBZ00902003-2008褐藻多糖硫酸酯[S]. 2008. |
| [6] | 王泽文, 冷凯良, 孙伟红, 等. 柱前衍生高效液相色谱法分析海带岩藻聚糖的单糖及糖醛酸组成[J]. 分析科学学报, 2011, 27(1): 26-30. |
| [7] | 姚尚辰, 马仕洪. 蒸发光散射检测器及其在2005版中国药典抗生素品种中的应用[J]. 中国抗生素杂志, 2005, 30(12): 712-720. |
| [8] | Karlsson G, Winge S, Sandberg H. Separation of monosaccharides by hydrophilic interaction chromatography with evaporative light scattering detection[J]. J Chromatogr A, 2005, 2(1092): 246-249. |
| [9] | 李 娜, 肖凯军, 王兆梅. 超声和离子液预处理促进高结晶多糖水解的研究[D]. 广州: 华南理工大学.2012. |
 2014, Vol. 37
2014, Vol. 37


