和胃颗粒处方来源于长春中医药大学附属医院,由柴胡、木香和焦槟榔等多味药材组成,具有舒肝解郁、健胃止痛的功效,为了方便患者使用,将其制成颗粒剂。处方中的焦槟榔为君药,具有消食导滞的作用,其主要成分为槟榔碱。由于槟榔碱性质不稳定,可被碱水解,又易随水蒸气挥发,因此优选槟榔碱的最佳提取工艺对控制成药质量和减少槟榔碱损失具有指导意义。根据槟榔碱可溶于热水的性质,本实验选取以水为提取溶剂,煎煮法为提取方法,以出膏率和槟榔碱提取率为综合评价指标,通过正交试验优选和胃颗粒的提取工艺,以确保颗粒剂的质量和疗效,为其工业化生产提供理论依据。
同时,固体口服制剂的溶出度是有效保证体内生物利用度的重要指标[1]。因此,本研究对和胃颗粒进行溶出度考察,以保证产品质量的稳定,以此作为和胃颗粒的质量标准控制之一。
1 材料LC—15C高效液相色谱仪(日本岛津),电热恒温水浴锅(上海一恒科技有限公司),分析天平(上海精密科学仪器有限公司),数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂),ZRS-6G智能溶出试验仪(天津市天大天发科技有限公司)。氢溴酸槟榔碱对照品(供含量测定用,批号111684-200401)购于中国食品药品检定研究院;和胃颗粒,自制;乙腈为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法与结果2.1 槟榔碱的含量测定[2] 2.1.1 色谱条件
CAPCELL PAK SCX(250 mm×4.6 mm,5 μm)色谱柱,乙腈-磷酸溶液(2→1 000,浓氨试液调节pH值至3.8)(70∶30)为流动相,体积流量1.0 mL/min,检测波长215 nm,柱温25 ℃,进样量20 μL。理论板数按槟榔碱峰计算应不低于3 000,见图 1。
 | 图 1 对照品(A)、和胃颗粒供试品(B)及阴性对照(C)HPLC色谱图Fig.1 HPLC of reference substances (A), Hewei Granules (B), and negative reference substances (C) |
取氢溴酸槟榔碱对照品适量,精密称定,加流动相制成25 μg/mL的溶液,即得。
2.1.3 供试品溶液的制备取本品细粉约1.0 g,精密称定,置具塞锥形瓶中,加乙醚50 mL,再加碳酸盐缓冲液(取碳酸钠1.91 g和碳酸氢钠0.56 g,加水使溶解成100 mL,即得)3 mL,放置30 min,时时振摇,35℃加热回流1 h,分取乙醚液,加入盛有磷酸溶液(5→1000)1 mL的蒸发皿中,残渣加乙醚继续回流提取2次(30、20 mL),每次30 min,合并乙醚液置同一蒸发皿中,除去乙醚,残渣加50%乙腈溶液溶解,置25 mL量瓶中,加50%乙腈至刻度,摇匀,精密量取续滤液1 mL,置10 mL量瓶中,加50%乙腈至刻度,摇匀,即得。
2.1.4 阴性样品溶液的制备按处方比例称取除焦槟榔外其他药味,按一定条件进行提取,并依照“2.1.3”项下方法制备阴性样品溶液。
2.1.5 线性关系考察精密吸取质量浓度为15、20、25、30、35、40 μg/mL的氢溴酸槟榔碱对照品溶液各20 μL,注入液相色谱仪,以进样量(μg)为横坐标,峰面积积分值为纵坐标,得到回归方程: Y=3×106X-35 571,r=0.999 8(n=6),线性范围0.197 2~0.525 8 μg。
2.1.6 精密度考察精密吸取对照品溶液20 μL,注入液相色谱仪中,连续进样6次,测定槟榔碱峰面积RSD值为1.68%,表明仪器精密度良好。
2.2 浸泡时间及药材吸水率的单因素考察[3]取焦槟榔饮片100 g,加6倍量水浸泡,每隔30 min观察一次药材浸透的情况,直至全部浸透,滤出全部未被吸收的水液,称取药材湿质量,计算吸水率,结果见图 2。
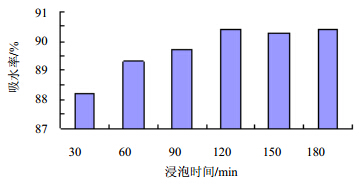 | 图 2 浸泡时间对药材吸水率的影响Fig.2 Effects of soaking time on water absorption of herbs |
吸水率=(药材湿质量−药材质量)/药材质量
试验结果表明,焦槟榔饮片全部浸透的时间为2 h,平均吸水率为90.4%(约焦槟榔饮片的1倍量)。由此确定,提取焦槟榔饮片的第一次加水量追加1倍,并在首次加热提取之前先浸泡2 h。
2.3 出膏率的测定[4]精密量取提取液100 mL,置干燥至恒重的蒸发皿中,水浴蒸干,于105 ℃的烘箱中干燥4 h,置干燥器中冷却30 min,精密称定质量,计算出膏率。
出膏率=干膏质量/药材质量
2.4 提取工艺优选取焦槟榔饮片200 g,共9份,以槟榔碱的提取率和出膏率为考察指标,计算综合评分=(出膏率/最大出膏率)×20+(槟榔碱提取率/最大槟榔碱提取率)×80,选取加水量、煎煮时间、煎煮次数为考察因素,按照L9(34) 正交表进行试验,因素水平见表 1,试验安排及结果见表 2,方差分析见表 3。
| 表 1 因素水平表 Table 1 Factors and levels |
| 表 2 正交试验结果 Table 2 Results of orthogonal test |
| 表 3 综合评分方差分析结果 Table 3 Variance analysis of comprehensive score |
由表可知,各因素对试验结果影响的重要性依次为C>A>B,即煎煮次数C是主要影响因素,加水量A是次要影响因素,煎煮时间B对试验结果影响极小。最佳提取条件为A2B1C2,即加水煎煮2次,第一次加水7倍量(其中1倍量是药材的吸水量),浸泡2 h,煎煮1 h,趁热滤过;第二次加水6倍量,煎煮1 h,趁热滤过,合并滤液。按最佳提取工艺进行3次验证试验,结果出膏率为28.57%,RSD为1.46%,槟榔碱提取率为96.64%,RSD为1.86%,证明该方法提取工艺合理。
2.5 溶出度测定 2.5.1 溶出介质和取样时间的选择取和胃颗粒样品6袋,分别以水和磷酸盐缓冲液(pH7.2)作为溶出介质,体积为900 mL,转速为100 r/min。照溶出度测定方法(《中国药典》2010年版二部附录XC第二法)[5],对和胃颗粒在水和磷酸盐缓冲液(pH7.2)的溶出行为进行考察。分别于5、10、20、30、45、60 min时,分别取溶液适量,以0.45 μm的滤膜滤过,作为供试品溶液;另精密称取对照品适量,加流动相溶解并制成1 mg/mL的溶液,作为对照品溶液。照2.1.1项下色谱条件,以外标法计算不同时间的溶出量和RSD值。以溶出时间为横坐标,溶出量为纵坐标,绘制溶出曲线,结果见图 3。
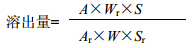
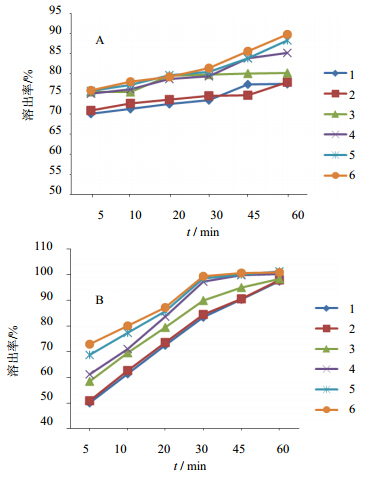 | 图 3 和胃颗粒在水(A)和pH 7.2磷酸盐缓冲液(B)中的溶出曲线Fig.3 Dissolution curves of Hewei Granule in water (A), and phosphate buffer (pH 7.2) (B) |
式中,A为供试品溶液的峰面积;Wr为对照品的取用量(mg);S为供试品溶出介质的体积(mL)及稀释倍数;Ar为对照品溶液的峰面积;W为供试品的标示规格(mg);Sr为对照品的溶解体积及稀释倍数。
结果,和胃颗粒以磷酸盐缓冲液(pH7.2)为介质30 min时,溶出量达到90%以上;而以水为介质时,60 min时溶出量达90%,故选择磷酸盐缓冲液(pH7.2)为和胃颗粒的溶出介质,取样时间为30 min较为理想。
2.5.2 样品溶出度测定依照上述溶出度的检定方法,测定3批样品中槟榔碱的溶出量,结果见表 4。
| 表 4 3批和胃颗粒溶出量 Table 4 Dissolution of three batches of Hewei Granules |
和胃颗粒中的有效成分为槟榔碱,能与水、乙醇及乙醚等溶剂混溶,其卤代盐可溶于水、乙醇[7]。根据其溶解度性质,综合考虑提取率和生产的可行性,选用溶剂为水和乙醇。二者比较,水的安全性及生产成本均优于乙醇,而且选择水作为提取溶剂更能体现汤剂用药的临床疗效,故选择水作为提取溶剂。提取方法的选择上,通过比较不同加热温度的槟榔碱含量,发现经过热水提取后的槟榔碱含量无显著性变化,可采用加热水法提取;同时,又由于生产线上的固液分离是热滤过法,使药效物质损失较少,具有较高的提取率及临床疗效,因而选择加热提取法,即煎煮法作为该提取工艺的提取方法。
此外,槟榔碱属于小分子量生物碱,具有较强的分子极性,在反相色谱柱上的保留时间较弱,通常需要在流动相中加入离子对试剂来提高其在色谱柱上的保留[7],因而本实验选择对生物碱分离具有较强专属性的强阳离子型交换色谱柱来进行含量测定,使槟榔碱达到更好的分离效果。
药物溶出度是颗粒剂质量控制的重要指标,能够切实地反映其内在质量。本实验采用高效液相色谱法测定和胃颗粒的溶出度,分别考察了不同溶出介质和不同取样时间和胃颗粒的溶出度,最终选取磷酸盐缓冲液(pH7.2)为溶出介质,取样时间为30 min。
| [1] | 胡昌勤, 潘瑞雪. 溶出度试验评价/预测固体口服制剂生物等效性的研究进展[J]. 中国新药杂志, 2014, 23(1): 44-51. |
| [2] | Schmidt W F, Pennington L J. Belladonna alkaloids and phenobarbital combination pharmaceuticals analysis II: High-performance liquid chromatographic determination of phenobarbital[J]. J Pharm Sci, 1982, 71(8): 954-955. |
| [3] | 杜明华. 中药提取最佳加水量的计算[J]. 健康必读杂志, 2010, 6(6): 135. |
| [4] | 中国药典[S]. 一部. 2010. |
| [5] | 中国药典[S]. 二部. 2010. |
| [6] | 张春江, 吕飞杰, 陶海腾. 槟榔活性成分及其功能作用的研究进展[J]. 中国食物与营养, 2008, (6): 50-53. |
| [7] | 杨 华, 易小兰, 谢金华, 等. HPLC同时测定四磨汤口服液中辛弗林、槟榔碱和去甲异波尔定的含量[J]. 中国实验方剂学杂志, 2013, 19(22): 79-81. |
 2014, Vol. 37
2014, Vol. 37


