2. 天津中医药大学 研究生院, 天津 300193
2. Graduate School of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
多药耐药(multidrug resistance,MDR)是影响肿瘤化疗疗效及预后的主要因素之一。铂类药物是肺癌联合化疗中的核心成分,其中顺铂是当前对肺癌患者单制剂化疗及联合化疗效率最高的药物之一,探讨顺铂的多药耐药对肺癌化疗具有相当大的指导意义。P糖蛋白(P-gP)是由两个多药耐药基因编码,其中多药耐药基因-1(MDR-1)与肿瘤细胞的MDR相关。本研究从国内外肺癌研究的关注热点和难点——化疗耐药入手,应用Western Blot 免疫印迹法及RT-PCR技术,研究探寻具有“扶正解毒祛瘀”作用的中药复方消岩汤对肺癌耐药模型的耐药逆转作用机制。探索消岩汤药物血清对耐顺铂人肺腺癌A549/DDP细胞MDR-1及其表达产物P-gP表达水平的影响,发现消岩汤逆转化疗耐药的作用靶点,寻找临床疗效可靠且副作用小的化疗耐药逆转剂,从而为攻克肺癌耐药奠定一定的研究基础。
1 材料与方法 1.1 药物消岩汤由黄芪10 g、西洋参10 g、姜黄10 g、郁金10 g、蕲蛇10 g、夏枯草10 g等8味中药组成,规格100 mL/瓶,由本院制剂室生产。水煎浓缩剂制备方法参照[1]。将消岩汤于旋转蒸发器上浓缩成相当于原生药材1.5 g/mL的药液,冷却装入灭菌药瓶,置4 ℃冰箱备用。
1.2 动物与分组SPF级健康BalB/C雄性裸鼠,60只,4~6周龄,体质量18~20 g,由中国人民解放军军事医学科学院实验动物中心提供,动物许可证号SCXK-(军)2014-0004。
1.3 主要试剂与仪器RPMI1640培养基(Hyclone公司),新生胎牛血清(Hyclone公司),Mini-PROTEAN 3 Elecreophoresis Cell(Bio-Rad),Mini Trans-Blot Module(Bio-Rad),PowerPac Basic Power Supply(Bio-Rad),Epgiadient s PCR仪(eppendorf公司),ABI7500 fast荧光定量PCR仪(Life Technologies公司),FluorChem FC2 Imaging System(Alpha Innotech),AlphaView系统软件(Alpha Innotech)等。
1.4 细胞系人肺腺癌细胞系A549由天津医科大学基础实验中心提供;耐顺铂(DDP)肺腺癌细胞系A549/DDP购自上海博谷生物科技有限公司。
1.5 A549裸鼠皮下移植瘤模型的建立体外复苏、培养A549细胞,在细胞的对数生长期收集细胞。1 000 r/min离心5 min,PBS溶液洗涤两次,离心弃上清,离心管外周以冰袋维持温度在4 ℃左右,以此保持瘤细胞的活性。用生理盐水稀释,调整细胞浓度到5×106 cell/mL。小鼠随机分为消岩汤高、低剂量组和对照组,每组20只。在各组中每只小鼠右前腋下皮下接种0.2 mL。待所有裸小鼠的皮下肿瘤的平均直径达到约5 mm时开始ig给药,每次给药间隔24 h。小鼠给药剂量分别为40、20 g/kg,对照组给予等容量生理盐水。10 d后眼眶取血法采血。
1.6 含药血清的制备末次给药1 h后,小鼠称质量,眼眶取血法采血,8 000 r/min离心15 min,取淡蓝色血清于2 mL EP管中,标识组别;14 000 r/min高速离心5 min,重复2次。分别提取上清,分装,56 ℃水浴灭活30 min,用0.22 μm微孔滤膜过滤除菌,−20 ℃ 保存。
1.7 细胞传代与培养参照笔者摸索的实验方法[1]。
1.8 对A549/DDP细胞耐药基因P-gP表达的影响组织样品加适量预冷的蛋白裂解液RIPA,匀浆,14 000 r/min离心15 min,上清转入新管。BCA法测定蛋白含量。用PBS调至等浓度,加6×SDS上样缓冲液,沸水浴5 min备用。取100 μg处理好的样品,按《分子克隆》方法进行SDS-PAGE电泳,积层胶6%,分离胶8%,胶厚0.75 mm。胶于转移液(含甲醇15%)中平衡10 min;从下至上分别放置滤纸、胶、PVDF膜(0.45 μm)、滤纸,夹子夹好放入倒好转移液的转移槽中,250 mA转膜90 min。将膜取出,放入含5%脱脂奶粉的PBST,室温封闭2 h。取出膜,对应一抗按照抗体说明书稀释,室温结合2 h;PBST洗3次,每次10 min;二抗1:10 000稀释,室温结合1 h;分别用PBST和PBS各洗3次,每次10 min。等比例混合显色基质A液和B液,均匀滴加膜上,静置1 min,放入暗箱成像。
1.9 对A549/DDP细胞耐药基因表达的影响提取样本总RNA,用All-in-One™ First-Strand cDNA Synthesis Kit(Gene Copoeia Cat. No. AORT-0050)进行反转录,实验操作按产品说明书进行,将RNA模板、试剂盒组分以及RNase-free Water溶解并置于冰上备用。用ABI7500 Fast荧光定量PCR仪,采用2-△△CT法进行数据的相对定量 分析。
1.10 统计学方法使用SPSS 11.0软件进行统计。计量资料比较采用单因素方差分析,数据以x±s表示。
2 结果 2.1 P-gP蛋白印迹分析A549/DDP细胞经不同浓度含药血清作用72 h后收集细胞提取总蛋白,Western Blot检测P-gP蛋白表达量的变化,结果表明,与对照组比较,随着消岩汤含药血清药物浓度的增加,P-gP蛋白表达逐渐减弱(P<0.05),说明消岩汤能够抑制多药耐药蛋白的表达,且随着药物浓度的增加,蛋白表达抑制的越明显,且与剂量呈负相关。电泳图见图 1,结果见表 1。
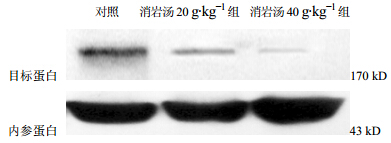 | 图 1 P-gP蛋白表达量Fig.1 Expression of P-gP protein |
| 表 1 消岩汤对A549/DDP细胞P-gP蛋白表达的影响(x±s,n=20) Table 1 Effect of Xiaoyan Decoction on P-gP expression in A549/DDP cells (x±s, n=20) |
基因MDR1在3组中的扩增曲线图及熔解曲线图说明扩增产物特异性好,实验结果有效。在A549/DDP细胞被各组不同的含药血清作用72 h后收集细胞提取总RNA,RT-PCR检测与MDR1的mRNA表达变化,实验重复3次。结果表明,与对照组比较,经不同浓度消岩汤含药血清作用后,A549/DDP细胞中的MDR1基因的mRNA水平均有所下降,且随着药物浓度的增加,基因表达抑制作用越明显(P<0.05)。说明不同浓度的消岩汤均可通过调节相关基因的转录而调节对应蛋白的表达,且与剂量呈负相关。
| 表 2 消岩汤对MDR1 mRNA表达的影响(x±s, n=20) Table 2 Effect of Xiaoyan Decoction on MDR1 mRNA expression (x±s, n=20) |
目前全世界的肺癌发病率与死亡率均高居恶性肿瘤首位。在肺癌的综合治疗中,化疗占有重要的地位,尽管新的化疗药物不断问世,化疗方案日趋完善,但肿瘤细胞的MDR严重限制化学药物的治疗效果。据统计,90%以上接受化疗的肿瘤患者,其死亡与耐药有关[2],因此对MDR的产生机制、检测方法、逆转方法的研究一直是肿瘤治疗领域的热点。
消岩汤是在“解毒祛瘀,扶正抗癌”中医肿瘤治则基础上依据现代药理研究开发出的院内制剂,具有多种抗肿瘤活性,是治疗非小细胞肺癌的良好辅助用药[3, 4]。其中黄芪、西洋参滋阴益气,扶正以驱邪,姜黄、郁金行气解郁、活血祛瘀,伍以蕲蛇搜剔络脉中之瘀毒,夏枯草、生牡蛎、白花蛇舌草相伍以清热解毒、软坚散结,全方祛邪而不伤正,全面调节机体的阴阳平衡。前期研究证实消岩汤可改善小鼠生活质量,拮抗恶病质,并能够抑制肿瘤生长;消岩汤含药血清对A549及A549/DDP均有生长抑制作用,且能增强顺铂对肺癌敏感细胞和耐药细胞的杀伤作用,具有耐药逆转作用,并且能够诱导肺癌耐药细胞的凋亡[1, 5]。P-gP是由多药耐药基因编码的一种能量依赖性药物排出性膜泵,它与化疗药结合后再与ATP结合,通过ATP供能将细胞内药物泵到细胞外使药物浓度不断下降,从而导致耐药性产生[6]。P-gP/MDRl的过表达是肿瘤产生MDR的主要机制,因此抑制P-gP的表达或者功能成为克服肿瘤MDR的最直接的方法。本研究证实消岩汤能够显著抑制P-gP及其mRNA表达,并且与剂量呈负相关。表明具有“解毒祛瘀,扶正抗癌”作用的中药复方消岩汤逆转肺癌耐药的可能机制为通过抑制细胞膜上P-gP及其基因的表达而阻止细胞对顺铂的输出,从而聚集细胞内的药物浓度达到有效逆转肺癌耐药的效果。
| [1] | 张 莹, 贾英杰, 杨 洁, 等. 消岩汤药物血清对A549/DDP多药耐药逆转作用的研究[J]. 天津中医药, 2010, 27(4): 335-336. |
| [2] | Longley D B, Jonhnston P G. Molecular mechanism of drug resistance[J]. J Pathol, 2005, 2059(2): 275-292. |
| [3] | 贾英杰, 史福敏, 贾彦焘, 等. 消岩汤剂治疗晚期非小细胞肺癌临床研究[J]. 天津中医药, 2004, 21(2): 108-110. |
| [4] | 贾英杰, 张 莹, 孙一予, 等.消岩汤不同时段参与化疗治疗非小细胞肺癌临床疗效观察[J], 天津中医药大学学报, 2006, 25(3): 164-165. |
| [5] | 张 莹, 贾英杰. 消岩汤药物血清对A549/DDP细胞凋亡的诱导作用[J]. 中医研究, 2011, 24(5): 19-21. |
| [6] | Wartenberg M, DOnmez F, Ling F C, et al. Tumor-induced angiogenesis studied in confrontation cultures of multicellular tumor spheroids and embryoid bodies grown from pluripotent embryonic stem cells[J]. FASEB J, 2001, 15(6): 995-1005. |
 2014, Vol. 37
2014, Vol. 37

