2. 遵义医学院附属医院药剂科, 贵州 遵义 563000;
3. 遵义医学院药学院, 贵州 遵义 563000
2. Pharmaceutical Preparation Section of Affiliated Hospital, Zunyi 563000, China;
3. School of Pharmacy, Zunyi Medical University, Zunyi 563000, China
杜仲味辛平,为杜仲科植物杜仲Eucommia ulmoides Oliver的干燥茎皮,是特产于我国西部、西南部及长江中上游地区如贵州、四川、广西、广东、云南、湖南、湖北、河南、甘肃、陕西、江西和浙江等省区的名贵滋补药材[1, 2]。早在2000年前,杜仲皮的神奇药效在我国第一部药物学专著《神农本草经》已有记载,主要用于治疗肾虚腰痛、筋骨无力、妊娠漏血、胎动不安、高血压症等。研究发现杜仲提取物具有降血压,调节血脂,增强细胞免疫功能及非特异免疫功能,抗衰老以及抗肿瘤等多种药理活性[3]。本研究前期发现杜仲提取物对大鼠脑缺血再灌注损伤具有保护作用[4, 5],本实验通过大鼠大脑中动脉线栓法制备局灶性脑缺血再灌注损伤模型,探讨杜仲提取物对脑缺血再灌注损伤保护作用机制。
1 材料 1.1 动物清洁级SD雄性大鼠,体质量220±20 g,购于重庆第三军医大学野战外科研究所动物室,许可证号SCXK(渝)2007-0005。
1.2 药品与试剂杜仲提取物(10∶1水提物,相当于生药10 g/mL,陕西瑞康生物工程有限公司产品,批号090510),临用前用蒸馏水配成所需浓度;β-肌动蛋白(β-actin)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)及诱导型一氧化氮合酶(iNOS)引物购于大连宝生物(TaKaRa)工程有限公司(产品编号GYD12124)。
2 方法 2.1 大鼠分组及给药大鼠60只,颗粒饲料适应性喂养1周,自由饮食,按简单随机方法分为假手术组,模型组,杜仲提取物低、中、高剂量(200、400、800 mg/kg,相当于生药2、4、8 g/kg)组,每组12只,各给药组给予相应剂量药物连续ig给药14 d,每日1次,假手术组和模型组给予等体积蒸馏水。饲养及实验过程均遵守实验动物管理与保护准则。
2.2 大鼠脑缺血再灌注模型的制备大鼠末次给药30 min后,采用Longa-Zea改良线栓法[6]略加改进制备模型。ip 10%水合氯醛0.35 mL/kg麻醉,仰卧位固定,颈部正中切口,钝性分离大鼠右侧颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉和颈外动脉近心端,临时夹闭颈内动脉,颈总动脉接近颈外动脉和颈内动脉分叉处用眼科剪作一斜行细切口,将栓线(北京沙东生物技术有限公司)从小口轻轻插入,经分叉处轻轻推入颈内动脉,进入距颈外动脉和颈内动脉分叉处约2 cm时,会有阻挡感,说明栓线已越过大脑中动脉(MCA)到达大脑前动脉的起始部。记录栓塞开始时间,结扎颈总动脉上端,缝合肌肉、皮肤,栓塞2 h后再轻回拉线头,使栓线头端退至颈外动脉切口处,实现再灌注。大鼠苏醒后出现同侧的Homer征(眼裂变小、眼球内陷)和对侧以前肢为重的偏瘫,提示模型成功。假手术组大鼠除不插入栓线外,其他操作与模型组手术相同。
2.3 神经功能损害评估大鼠脑缺血2 h,再灌24 h后,参照Longa-Zea[6] 5分制评分标准分别于脑缺血再灌注24 h后由同一观察者双盲法评估记录神经功能损害。0分:无神经功能损伤症状;1分:不能伸展对侧前爪;2分:行走时向偏瘫侧转圈;3分:向偏瘫侧倾倒;4分:不能自发行走,意识丧失。
2.4 脑梗死范围检测神经功能评分后以上述方法麻醉,断头处死大鼠,取脑,生理盐水洗净后滤纸吸干,去除嗅球、小脑和低位脑干,每组大鼠随机取8只进行脑梗死范围检测。将脑置于−20 ℃冰箱15 min,沿冠状面切成5 mm厚,浸入1%的2, 3, 5-氯化三苯基四氮唑(TTC)溶液中,往复式水浴恒温振荡器(江苏太仓市实验设备厂)120 r/min、37 ℃恒温避光水浴15 min,经染色后,脑组织非缺血区呈玫瑰红色,而梗死区呈白色,界限分明,用滤纸将各脑片水分滤去后,将脑片两面分别以数码相机拍照(拍摄角度、光源亮度、相机与脑片距离保持一致)[7]。采用Imagepro 6.0软件计算梗死面积占损伤侧大脑总面积的百分比。
2.5 实时荧光定量PCR(RT-PCR)检测大鼠海马组织中TNF-α、IL-1β及iNOS mRNA的表达每组取4只大鼠按试剂盒说明进行大鼠海马RNA的提取,紫外分光光度计测量260、280 nm处吸光度(A)值,其A260/A280值在1.8~2.0。采用TaKaRa公司的RT试剂盒,在Eppendof Mastercycler Gradient PCR仪逆转录获得cDNA。以β-actin为内参基因,通过iCycler iQ real-time PCR仪进行扩增。β-actin引物同义链:5’-TGA CAG GAT GCA GAA GGA GA-3’,反义链:5’-TAG AGC CAC CAA TCC ACA CA-3’,扩增产物长度为104 bp。iNOS引物同义链:5’-TCC TCA GGC TTG GGT CTT GTT AG-3’,反义链:5’-TTC AGG TCA CCT TGG TAG GAT TTG-3’。TNF-α引物同义链:5’-ATA CAC TGG CCC GAG GCA AC-3’,反义链:5’-CCA CAT CTC GGA TCA TGC TTT C-3’。IL-1β引物同义链:5’-CCC TGA ACT CAA CTG TGA AAT AGC A-3’,反义链:5’-CCC AAG TCA AGG GCT TGG AA-3’。以Ct值为统计参数依次计算下列数据:① Ct average=(Ct1+Ct2+Ct3)/3(重复管),② dCt=Ct average-中间值,③ 基因的表达=2^(−dCt),④ 以目的基因的表达/内参基因的表达进行iNOS、TNF-α及IL-1β的相对定量。
2.6 统计学处理所有数据均以x±s表示,采用SPSS19.0软件进行方差分析。
3 结果 3.1 脑缺血再灌注模型建立及神经功能检查大鼠脑缺血2 h后出现左下肢无力、伸直行走时向左侧转圈,严重时向左侧倾倒甚至不能行走,甚至出现意识障碍;提尾时表现为左侧前肢屈曲、内收,后肢伸直并向左侧旋转。再灌注24 h后发现,假手术组大鼠未见神经功能损害,评分为0,模型组大鼠神经功能评分明显增高(P<0.05)。杜仲提取物低、中、高剂量组给药可使脑缺血再灌注损伤大鼠的神经功能障碍趋于改善或明显改善(P<0.05),见图 1。
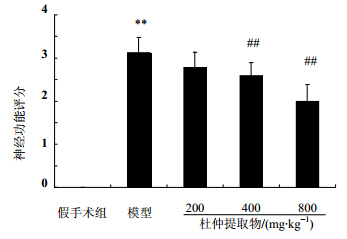 | 与假手术组比较: **P <0.01;与模型组比较:##P<0.01**P <0.01 vs sham group; ##P <0.01 vs model group图 1 杜仲提取物对脑缺血再灌注时大鼠神经功能评分的影响(x±s,n=12)Fig.1 Effect of Eucommiae Cortex P.E on nerve dysfunction score in focal brain ischemia- reperfusion injury of rats(x±s, n=12) |
图 2所示,经TTC染色后,假手术组脑组织染色呈玫瑰红色,无明显脑组织损伤;模型组脑组织则出现明显的梗死区(呈灰白色),不同剂量杜仲提取物给药组脑组织梗死区范围较模型组显著缩小,且以杜仲提取物800 mg/kg组最为明显,见表 1。
 | 图 2 杜仲提取物对脑缺血再灌注时脑梗死面积的影响 (x±s±s, n = 8) Fig.2 Effect of Eucommiae Cortex P. E on infarction rangein focal brain ischemia-reperfusion injury of rats(x±s±s, n = 8) |
| 表 1 杜仲提取物对大鼠脑缺血-再灌注后脑梗死面积的影响(x±s,n=8) Table 1 Effect of Eucommiae Cortex P.E on infarction range in focal brain ischemia- reperfusion injury of rats (x±s,n=8) |
与假手术组比较,模型组iNOS、TNF-α及IL-1βmRNA表达显著升高(P<0.05),杜仲提取物各剂量给药组TNF-α、IL-1β及iNOS mRNA表达均趋于下降或显著下降(P<0.05)(图 3)。
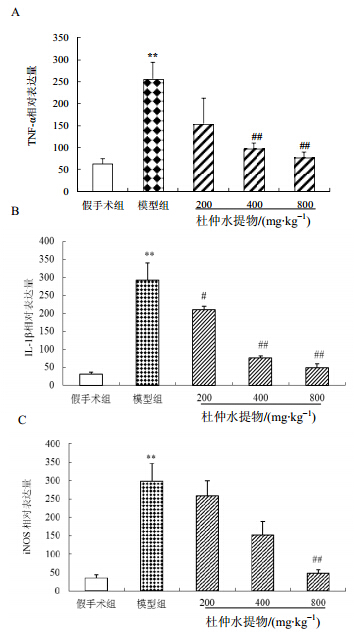 | 与假手术组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01*P < 0.05, **P < 0.01 vs Sham group; #P < 0.05, ##P < 0.01 vs model group图 3 杜仲提取物对大鼠脑缺血再灌注时海马TNF-α(A)、 IL-1β(B)及iNOS(C)mRNA表达的影响 (x±s±s, n = 4)Fig.3 Effect of Eucommiae Cortex P.E on expressions of TNF-α (A), IL-1β (B) , and iNOS (C) to focal brain ischemia- reperfusion injury of rats (x±s±s, n = 4) |
脑组织正常的功能活动依赖于充足的脑血流供应,当血流突然中断或减少时,即可引起脑功能障碍,缺血一定时间恢复血液供应后,其功能不仅不能恢复,反而出现脑功能障碍的进一步加重,如脑水肿、脑梗死,神经细胞变性坏死等,即脑缺血再灌注损伤(CIR)[8]。研究发现,脑缺血再灌注损伤是能量障碍、细胞酸中毒、兴奋性氨基酸毒性、自由基损伤、炎症细胞因子损害及凋亡基因激活等多种因素、多环节以及多种机制参与的恶性级联过程。炎症反应在脑缺血再灌注损伤中起着重要作用,脑内致炎细胞因子(如TNF-α、IL-1β等)水平显著升高导致炎症反应亢进,缺血区损伤加重[9, 10]。而炎细胞浸润、细胞因子高表达,致使iNOS表达及活化增加[11],灌注后24 h达峰值。持久催化生成大量一氧化氮(NO)——一种缺血性脑损伤不同时期具有神经保护及神经毒性双重作用的重要信使性气体物质,一种比活性氧更活跃的气体分子自由基。过量的NO与O2−反应生成强氧化剂过氧亚硝酸,通过干扰细胞正常代谢及促进自由基生成等途径产生脑细胞线粒体损伤等强大的神经毒性,进而介导迟发性神经元损伤[12]。本研究结果显示,大鼠脑组织缺血2 h,再灌注24 h后,大鼠海马组织中TNF-α、IL-1β及iNOS mRNA的表达显著上调,而不同剂量杜仲提取物预防性给药可显著降低脑缺血灌注损伤时大鼠海马TNF-α、IL-1β及iNOS mRNA的表达,尤其iNOS mRNA表达的下调与本研究前期实验结果一致(再灌注24 h后,大鼠脑组织及血清中iNOS活性及NO含量显著升高;而杜仲提取物能降低脑缺血再灌注损伤大鼠血清及脑组织iNOS活性及NO的含量)[4]。提示杜仲提取物对脑缺血再灌注损伤的保护作用可通过抑制脑缺血再灌注损伤中炎症因子TNF-α、IL-1β及iNOS mRNA的表达来实现,进一步佐证了其保护作用与NO途径的关系。至于其还可通过影响哪种或几种信号途径调控细胞因子的合成或释放,亟待进一步的研究。
| [1] | 杨峻山, 姜声虎. 杜仲研究的现状与展望[J]. 自然资源学报, 1997, 12(1): 60-66. |
| [2] | 丁艳霞, 郭洋静, 任莹璐, 等. 杜仲雄花中黄酮类化学成分及其抗氧化活性研究[J]. 中草药, 2014, 45(3): 323-327. |
| [3] | 王丽楠, 杨美华. 中药杜仲的研究进展[J]. 天然产物研究与开发2008, 20(B05): 146-155. |
| [4] | 邓 江, 张 洁, 罗 洁, 等. 杜仲提取物对脑缺血再灌注大鼠的保护作用[J]. 遵义医学院学报, 2011, 34(5): 484-486. |
| [5] | 邓 江, 张 洁, 罗 洁, 等. 杜仲提取物预处理对脑缺血再灌注损伤大鼠抗氧化能力及一氧化氮的影响[J]. 中国新药与临床杂志, 2012, 31(8): 472-476. |
| [6] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [7] | 张国玺, 石京山, 余丽梅, 等. 夏天无注射液对大鼠脑缺血再灌损伤及 ICAM- 1 mRNA表达的影响[J]. 遵义医学院学报, 2007, 30(1):14-17. |
| [8] | 刘启锋, 刘 明, 刘玉河, 等. 脑缺血再灌注损伤机制研究进展[J]. 中华神经外科疾病研究杂志, 2006, 5(6): 566-568. |
| [9] | Wang Q, Tang X N, Midofi A. The inflammatory response in stroke[J]. J Neuroimmunol, 2007, 184(1-2): 53-68. |
| [10] | Terao S, Yilmaz G, Stokes K Y, et al. Inflammatory and injury responses to ischemic stroke in obese mice[J]. Stroke, 2008, 39(3): 943. |
| [11] | M abuchi T, Kitagawa K, Ohtsuki T, et al. Contribution of microglia/macrophages to expansion of infarction and response of oligodendrocytes after focal cerebral ischemia in rats[J]. Stroke, 2000, 31(7): 1735-1743. |
| [12] | Ikeno S, Nagata N, Yoshida S, et al. Immature brain injury via pemxynitrite production induced by inducible nitric oxide synthase after hypoxia-ischemia in rats[J]. J Obstet Gynaecol Res, 2000, 26(3): 227-234. |
 2014, Vol. 37
2014, Vol. 37

