2. 天津中医药大学, 天津 300193;
3. 天津药物研究院, 天津 300193;
4. 天津市南开医院, 天津 300193
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
4. Tianjin Hospital of ITCWM, Tianjin 300193, China
绝经后骨质疏松症是一种与衰老有关的常见病,主要发生在绝经后妇女,由于雌激素缺乏导致骨量减少及骨组织结构变化,使骨吸收大于骨形成,骨代谢的平衡状态被打破。雌激素可通过与破骨细胞膜上的雌激素受体(ER)结合直接作用于破骨细胞,抑制其骨吸收功能[1]。目前临床上用于绝经后骨质疏松症治疗的药物主要是抗骨吸收药如雌激素、双磷酸盐类、钙等,效果虽好,但并不完善且副作用明显[2]。
骨代谢过程主要由成骨细胞和破骨细胞两类细胞来完成,分别调节骨形成与骨吸收,共同维持骨代谢的动态平衡状态。破骨细胞是骨吸收的执行细胞。生理状态下,骨吸收是骨代谢的起始环节;病理条件下,许多骨代谢性疾病(如骨质疏松、骨硬化症等),都是由于骨吸收亢进或不足引起的。
RAW264.7细胞是小鼠源性破骨细胞前体细胞,来自Abelson小鼠白血病病毒所致的肿瘤,被认为代表早期分化阶段的破骨前体细胞[3]。用核因子κ B受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)诱导RAW264.7细胞可获得抗酒石酸酸性磷酸酶(TRAP)染色阳性的多核细胞,这种方法所得的破骨样细胞(OCLs)不会受其他细胞污染,便于破骨样细胞形态和功能的研究。研究表明RAW264.7细胞是一种较好的破骨前体细胞模型[4]。17β-雌二醇(E2)可直接作用于体外培养的破骨细胞,抑制其骨吸收功能[5]。
“青娥丸”为古今补肾良方,方中杜仲为君,补骨脂为臣,在此基础上再加丹参而成为加减青娥方。现代药理研究显示补骨脂、杜仲和丹参都是植物性雌激素含量较高的中药[2]。植物雌激素不仅影响性激素的代谢及其生物活性,而且对细胞酶、蛋白质合成、生长因子、恶性细胞增生均有影响。但是目前对中药中的植物雌激素的研究较少,研究尚不够深入,且没有进一步说明其作用机制。
本文利用RAW264.7细胞株作为破骨前体细胞模型,用RANKL诱导其分化为破骨细胞,以E2作为阳性对照药探讨加减青娥方对RAW264.7向破骨细胞分化的影响,并进一步探讨其对ERα mRNA的表达的影响,以期探讨其作用机制,为寻找更加安全有效的抗骨质疏松药及临床研究提供依据。
1 材料与方法 1.1 材料本研究使用RAW264.7细胞株由协和医科大学细胞库提供。RANKL、抗酒石酸酸性磷酸酶(TRAP)染色试剂盒、ICI182780、E2、胰蛋白酶、青链霉素双抗、DMSO均购自Sigma公司。无酚红DMEM、胎牛血清购自Gibco公司,其他试剂均为国产分析纯。RNAprep Pure 培养细胞/细菌总RNA提取试剂盒、FastQuantcDNA第一链合成试剂盒、SuperRealPreMix Plus(SYBR Green)均购于Tiangen生物有限公司,PCR引物由生工生物工程(上海)股份有限公司合成。
本研究所用加减青娥方分别为生药的醇提和水提物,出药率及主要成分如下:补骨脂,20%出药率,主要成分为补骨脂酚、黄酮类;杜仲,12%出药率,主要成分为黄酮类、环烯醚萜、木脂素类;丹参,52.6%出药率,主要成分为丹参酮类、丹酚酸类化合物。加减青娥方的拟用生药剂量比为补骨脂-杜仲-丹参(1:2:2)。按上述比例分别称取一定量的提取物配成相当于100 mg/mL生药浓度储存液储存(补骨脂20 mg/mL,杜仲40 mg/mL,丹参40 mg/mL),然后按实际需要药物浓度稀释。所用药物由天津中医药大学中医药研究中心提供。
1.2 方法 1.2.1 RAW264.7细胞株的复苏与培养[6] RAW264.7细胞株按常规方法复苏,加适量无酚红DMEM加10%胎牛血清培养液,调节细胞密度为5×104个/mL接种于培养瓶中,于37 ℃、5% CO2恒温培养箱中培养,24 h后细胞贴壁生长,细胞呈圆形或椭圆形,核居中,72 h后细胞呈单层铺满瓶底呈融合生长,按常规方法进行细胞传代。
1.2.2 细胞培养及分组取生长良好的RAW264.7细胞消化后制成细胞悬液,按需要调整细胞密度,接种于不同培养板中。待细胞贴壁后按不同浓度分组给药,分组如下:正常对照组(N)、空白对照组(R,RANKL刺激组,刺激浓度为100 ng/mL)、阳性对照组(E2,RANKL+E2,E2浓度为10−6 mol/L)、RANKL+E2+雌激素受体抑制剂组(E2+ICI,ICI182780浓度为10−6 mol/L)、RANKL+不同浓度(0.1、1、10、100 μg/mL)青娥方组(Q0.1、Q1、Q10、Q100)、RANKL+不同浓度青娥方+雌激素受体抑制剂组(Q0.1+ICI、Q1+ICI、Q10+ICI、Q100+ICI),分别培养数天后,按需求分别处理细胞进行进一步检测。
1.2.3 抗酒石酸酸性磷酸酶(TRAP)染色取生长良好的RAW264.7细胞消化后制成细胞悬液,调整细胞密度为1×104个/mL接种于含盖玻片的24孔板,每孔加入质量浓度为100 ng/mL的重组鼠RANKL,诱导生成多核细胞,培养1 d,然后按上述分组分别加入不同浓度的青娥方提取液,再培养5 d,取出细胞爬片,用PBS缓冲液洗涤细胞,以耐酒石酸酸性磷酸酶(TRAP)试剂盒测定细胞TRAP活性。严格按试剂盒说明书操作程序进行操作,光学显微镜下观察,两人双盲法将多于3核细胞的TRAP-阳性细胞计数10个高倍视野,比较其细胞总数并照相。
1.2.4 加减青娥方对RANKL诱导的破骨细胞ERαmRNA表达的影响细胞总RNA的提取及反转录 取生长良好的RAW264.7细胞消化后制成细胞悬液,调整细胞密度为1×104个/mL接种于24孔板,每孔加入浓度为100 ng/mL的重组鼠RANKL,诱导生成多核细胞,培养1 d,然后按上述分组分别加入不同浓度的青娥方提取液,隔日换液,再培养7 d,洗涤裂解细胞,按细胞总RNA的提取试剂盒操作程序提取细胞总RNA,反转录获得cDNA,−20℃保存备用。
荧光定量PCR(RT-PCR) 根据天根生物有限公司提供的试剂盒说明书进行,目的基因ERα、ERβ及参比基因β-actin的引物见表 1。选择退火温度分别为60.4℃和56.1℃。将上述获得cDNA按试剂盒操作程序配成20μL反应体系,采用三步反应法在BIO-RAD IQ5系统上进行RT-PCR,结果采用2−△△Ct方法对数据进行统计,分析比较各组别间差异。
| 表 1 Real-time PCR所需引物 Table 1 Rael-time PCR primers |
采用SPSS 19.0软件分析系统进行方差分析,结果以x±s表示。结果采用单因素方差分析(ANOVA)方差齐性检验后,组间比较采用LSD法进行比较分析。
2 结果 2.1 RANKL诱导RAW264.7 TRAP染色及细胞形态学观察刚接种的RAW264.7细胞贴壁后呈圆形、椭圆形、少数呈梭形、多为单核、少数双核,第2天细胞呈集落式生长(图 1-a);RANKL诱导培养第3天开始出现多核细胞(≥3核)(图 1-b);诱导第7天,细胞体积增大、核增多、部分细胞浆内出现空泡,细胞伸出伪足连接成片(图 1-c)。取诱导7 d后细胞爬片,经TRAP染色后,正常细胞呈深蓝染色(图 1-d),阳性细胞呈紫红色、胞浆丰富,部分胞膜边缘不整、出现伪足伸展(图 1-e)。
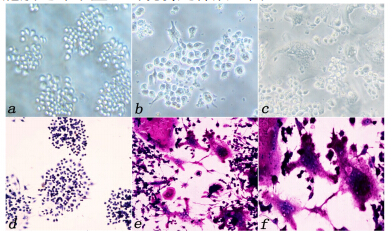 | 图 1 RANKL诱导RAW264.7 TRAP染色及细胞形态学观察Fig.1 RANKL- induced RAW264.7 cell with TRAP staining and morphological observation |
经TRAP染色后,RANKL诱导组和各用药组均可见数量、大小不等的呈紫红色的TRAP阳性细胞,即破骨细胞,正常组未见呈酒红色TRAP阳性细胞,各组计数结果及比较结果见图 2,RANKL诱导组TRAP染色阳性细胞数明显增多,用E2后,TRAP染色阳性细胞数明显减少(P<0.01),加入不同浓度青娥方后,TRAP染色阳性细胞数均明显减少(P<0.01),且与E2组比较无明显差异。当加入雌激素受体抑制剂ICI182780后,各组的TRAP染色阳性细胞数与相应用药组及雌激素组比较明显增加(P<0.01)。
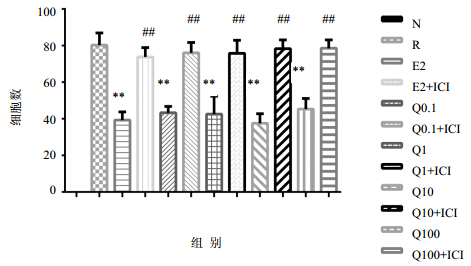 | 与空白组比较:**P<0.01;与相同浓度的加减青娥方用药组比较:##P<0.01 **P<0.01vs blank group; ##P<0.01vs Modified Qing’e Formula group with same concentration 图 2 加减青娥方对RANKL诱导的RAW264.7分化为破骨细胞计数的影响Fig.2 Effect of Qing’e Formula on caculation of osteoclasts induced by RANKL from RAW264.7 |
RT-PCR结果显示,正常培养的RAW264.7细胞有一定量的ERα mRNA的表达,用RANKL诱导刺激后ERαm RNA的表达减少(P<0.01),加入雌激素后ERα mRNA的表达明显升高,不同浓度的加减青娥方与雌激素作用相似,当加入雌激素受体抑制剂ICI182780后,各组的ERα mRNA表达均减少(P<0.01)。各组培养细胞均无ERβ mRNA的表达,见图 3。
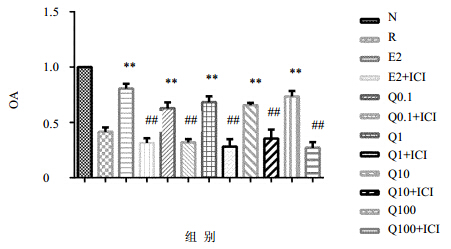 | 与空白组比较**P<0.01;与相同浓度的加减青娥方用药组比较##P<0.01 **P<0.01vs blank group; ##P<0.01 vs Modified Qing’e Formula group with same concentration 图 3 加减青娥方对RANKL诱导的RAW264.7细胞ERαmRNA的影响Fig.3 Effect of Qing E Formula on ERαmRNA expression of RAW264.7 cellinduced by RANKL |
骨代谢平衡是骨量稳定的重要前提,破骨细胞主导的骨吸收和成骨细胞主导的骨形成是维持骨代谢平衡的重要条件,对雌激素研究证实,雌激素直接参与骨代谢,与绝经后骨质疏松症有关[7, 8]。绝经后雌激素水平下降是绝经后骨质疏松症发病的主要原因,骨质疏松症治疗的目标是尽可能地抑制病理性骨吸收,增加骨形成。骨吸收的减少依赖于破骨细胞骨吸收的减少。因此,如何促进破骨细胞凋亡,在骨质疏松症的治疗中具有重要意义。雌激素通过骨细胞上ER介导骨代谢,绝经后骨质疏松患者雌激素水平降低导致ER数量和功能的下降[9]。
植物雌激素为杂环多酚类化合物,与E2结构相似,可结合ER,在不同情况下表现出类雌激素或抗雌激素作用,对多种疾病具有保护作用。因此,近年来防治绝经后骨质疏松症的中药研究开发成为医学领域的一个热点。大量研究已证实补肾中药对绝经后骨质疏松具有较好的防治效果[10]。
本课题组在前期研究显示,加减青娥方具有植物雌激素样作用,显著增加去卵巢骨质疏松大鼠胫骨近、远端的骨密度,而且明显降低血脂含量,但机制尚未阐明。本研究通过离体研究探讨该药治疗骨质疏松尤其是绝经期妇女骨质疏松症的作用机制,因此利用小鼠源性破骨细胞前体细胞RAW264.7细胞为模型,观察加减青娥方对RANKL诱导破骨细胞分化效应的影响,结果发现不同浓度加减青娥方均可以减少RANKL诱导的破骨细胞的数量,其作用与E2效果相似,当向细胞培养液中加入雌激素受体抑制剂ICI182780后,这种抑制作用消失,间接说明加减青娥方对RANKL诱导破骨细胞分化效应的影响可能通过雌激素受体起作用。为了证明这种机制的存在,观察了不同浓度加减青娥方及ICI干预的RAW264.7细胞ERα和ERβ mRNA的表达,结果发现各组细胞中均有ERα mRNA 的表达,而没有ERβ mRNA表达,与以往报道一致[11, 12]。说明ERα和ERβ在介导雌激素调节骨代谢的过程中扮演了不同的角色,对于理解雌激素受体的作用机制及开发新型的选择性雌激素受体调节剂具有重要的意义,本实验结果提示加减青娥方对RANKL诱导破骨细胞的影响可能通过ERα发挥作用,而对ERβ无明显影响,其具体作用机制有待进一步研究。
另外,本研究通过对各组细胞内ERα mRNA表达量的比较发现,E2可以提高RANKL诱导RAW264.7细胞中ERα mRNA的表达,不同浓度的加减青娥方与E2有相似的作用。当用雌激素受体抑制剂ICI182780与雌激素或者加减青娥方一起共孵育RAW264.7细胞时,RANKL诱导的RAW264.7 ERα mRNA的表达受到了抑制,进一步证实了不同浓度的加减青娥方均可增加ERα mRNA的表达,与以往研究结果相似[1]。然而,本实验只证明了加减青娥方对破骨细胞分化的影响及其机制,骨代谢是一个由成骨细胞的骨形成和破骨细胞的骨吸收构成的动态平衡的过程,药物如何通过影响骨代谢过程中成骨细胞的活性影响骨代谢过程,将在下一步实验中进行进一步研究。
综上所述,加减青娥方可抑制RANKL诱导的RAW264.7向破骨细胞分化及活性发挥雌激素样作用,这种作用是通过增加破骨细胞ERα mRNA的表达而实现的。这种机制的存在,为进一步研究加减青娥方防治骨质疏松症的研究提供新思路,为其开发利用提供新的理论依据。
| [1] | Rozkydal Z, Janicek P. Theeffectofalendronatein the treatment of postmenopausal osteoporosis [J]. Bratisl Lek Listy, 2003, 104(10):309-313. |
| [2] | 张晓晓, 刘 胜, 薛晓红. 具有雌激素类似作用的中药研究进展 [J]. 中西医结合学报, 2005, 3(2): 149-153. |
| [3] | Battaglino R, Kim D, Fu J, et al. c-mycisrequired for osteoclast differentiation [J]. J Bone Miner Res, 2002,17(5):763-773 |
| [4] | 肖新华, 廖二元, 董源媛, 等.小鼠单核细胞RAW264.7的细胞生物学特征 [J]. 南华大学学报:医学版, 2008, 36(3): 282-285. |
| [5] | Giuliani N, Pedrazzoni M, passeri G, et al. Bisphosphonates inhibit I-l6 product ion by human osteoblast likes cells [J]. Scand J Rheumatol,1998, 27: 38-41. |
| [6] | 巫松辉, 钟招明, 陈建庭. RANKL诱导破骨细胞前体细胞分化成熟 [J]. 中国老年学杂志, 2011, 31(6): 963-965. |
| [7] | Imai Y, Kondoh S, Kouzmenko A, et al. Minireview: osteoprotective action of estrogensis mediated by osteoclastic estrogen receptor-alpha [J]. Mol Endocrinol, 2010, 24(5): 877-885. |
| [8] | Nakamura T, Imai Y, Matsumoto T, et al. Estrogen prevents Bone loss via estrogen receptor alpha and induction of Fasligand in osteoclasts [J]. Cell, 2007, 130(5):811-823. |
| [9] | Lanyon L, Armstrong V, Ong D, et al. Is estrogen receptor alpha key to controlling bones' resistance to fracture? [J]. J Endocrinol, 2004,182(2):183-191. |
| [10] | 武密山, 李 恩, 赵素芝, 等.补肾方含药血清对大鼠成骨细胞ERαmRNA及其蛋白表达的影响 [J].中国药理学通报, 2008, 24(10):1396-1397. |
| [11] | Guo Z, Krucken J, Benten W P, et al. Estradiol-induced no genomic calcium signaling regulates geotropic signaling in macrophages [J]. J BiolChem, 2002, 277(9): 7044-7050. |
| [12] | Garcia P V, Robinson L J, Borysenko C W, et al. Negative regulation of RANKL-induced osteoclastic differentiation in RAW264.7 cells by estrogen and phytoestrogens [J]. J BiolChem, 2005, 280(14): 13720-13727. |
 2014, Vol. 37
2014, Vol. 37


