2. 哈励逊国际和平医院, 河北 衡水 053000
2. Harrison International Peace Hospital, Hengshui 053000, China
目前,雌性生殖毒性评价主要采用整体动物实验方法(包括Ⅰ段、Ⅱ段、Ⅲ段),但体内实验存在所需动物数量多、周期长、费用高等特点,而且难以揭示化学物质对卵泡生长、激素合成以及卵子成熟等生殖学关键问题。近年来,虽然有关腔前卵泡的体外培养已在小鼠、牛、羊、猪等动物中取得一些进展[1, 2, 3, 4],但是大鼠体外培养的影响因素在国内仍处于探讨阶段。由于大鼠是目前生殖毒性研究中的首选动物,因此建立大鼠腔前卵泡的体外培养体系对于化合物早期生殖毒性筛选和机制研究更有意义。本实验成功建立大鼠腔前卵泡的体外培养方法,为雌性生殖毒性的体外机制研究提供了更好的方法和手段。
1 材料 1.1 动物健康性成熟SPF级SD大鼠购自北京维通利华实验动物技术有限公司,生产单位许可证号:SCXK(京)2006-0009。动物饲养于室温20~26 ℃,湿度40%~70%的SPF级动物房内,光照条件:12 h明/12 h暗,自由摄食和饮水,适应性饲养一周后开始实验。按雌雄1∶1合笼,出生后(post natal day,PND)当天为PND0,选用PND15雌性仔鼠用于腔前卵泡分离及培养,同窝的其他PND23雌性仔鼠用于分离卵丘细胞-卵母细胞复合体(cumulus oocyte cell complexes,COCs)体外培养。
1.2 主要试剂Leibovitz’s L15(L15)培养基、α-MEM-glutamax培养基(a-minimal essential medium with glutamax)、胎牛血清(fetal calf serum,FCS)、石蜡油、维生素C均购自Gibco公司;孕马血清促性激素(pregnant mare serum gonadotropin,PMSG)、人促卵泡激素(human follicle stimulating hormone,hFSH)、人促黄体激素(human luteneinizing hormone,hLH)、胰岛素-转铁蛋白-硒混合(insulin-transferrin-selenium mix,ITS-mix)、重组人绒毛膜促性腺激素(recombinant human chorionicgonadotrophins,rHCG)、重组表皮生长因子(recombinant epidermal growth factor,rEGF)均购自Prospec公司;大鼠雌二醇(E2)和孕酮(P)检测试剂盒、台盼蓝购自R&B公司;HEPES、青霉素、链霉素、胶原酶、脱氧核糖核酸酶(DNase I)购自Sigma公司。
1.3 仪器实体显微镜(Olympus)、倒置荧光显微镜(Nikon)、CO2培养箱(三洋)、离心机(Anke)、超净工作台(天津市永康医药净化空调装饰工程公司)。
1.4 培养基的配制洗液:L15培养基、10%胎牛血清、100 IU/mL青霉素、0.1 mg/mL链霉素。
卵泡分离液:L15培养基、10%胎牛血清、2 mg/mL胶原酶、0.2 mg/mL DNase I、100 U/mL青霉素、100 U/mL链霉素。
腔前卵泡培养液(Ml培养基):α-MEM- glutamax培养基、5%热灭活胎牛血清、100 mU/mL FSH、100 mU/mL LH、ITS-mix(5 mg/mL胰岛素、5 mg/mL转铁蛋白和5 ng/mL硒)、50 μg/mL维生素C、10 mmol/L HEPES,调节pH值为7.2~7.3。
腔前卵泡成熟液(M2培养基)[6]:M1培养基、1.5 U/mL rHCG、5 ng/mL rEGF。
2 方法 2.1 腔前卵泡的分离与体外培养[7] 2.1.1 腔前卵泡的分离选用16只PND15体质量为30~40 g的雌性仔鼠,实施安乐死,用75%乙醇全身消毒,在无菌条件下摘取双侧卵巢。将卵巢放入37 ℃的洗液中清洗2次,剪去韧带、系膜等结缔组织,沿卵巢门切开,去掉髓质及黄体组织,迅速将卵巢置入预先在37 ℃恒温箱内平衡过夜的含有卵泡分离液的玻璃培养皿内。用眼科镊轻轻分离大的卵巢组织块,于37 ℃、5% CO2、饱和湿度培养箱中消化10 min后,用直径适中的玻璃管轻轻吹打悬液,然后用卵泡分离液清洗3次,低速离心去酶,在实体解剖显微镜下(40×)用分离针轻轻剥离皮质中的单个卵泡,尽量不要损伤到卵泡的卵泡膜细胞。本实验共获取306枚卵泡。
2.1.2 腔前卵泡的活力鉴定利用台盼蓝染色鉴定腔前卵泡的活力[8]。染色后,在倒置显微镜下,健康卵泡具有清晰、球状的卵母细胞,有完整的颗粒细胞层,外围有完整的基底膜,层次分明,无闭锁征兆,染色后仅有少量颗粒细胞着色,为淡紫色,卵母细胞透明,不着色;而不健康卵泡表现为基底膜破裂,颗粒细胞变暗,或卵母细胞逸出,染色后颗粒细胞及卵母细胞大部分着色,为紫色或黑色。经台盼蓝染色后选取卵泡基底膜完整、膜下颗粒细胞排列紧密、有2~3层颗粒细胞、卵母细胞形态规则并且靠近卵泡中央、直径为130~150 μm的健康卵泡用于体外培养。
2.1.3 腔前卵泡的体外培养将选取的健康卵泡收集起来,用Ml培养基冲洗1~2次,然后用吸管轻轻吹打,1 000 r/min离心2次去除残留的酶,弃上清迅速加入M1培养基重复清洗2次,用移液枪吸取单个卵泡随机分在预先加入60 μL/孔M1(37 ℃恒温培养箱内孵育30 min)的96孔板(恒温培养箱内平衡约12 h)内,每孔1枚,上覆50 μL/孔无菌石蜡油。
将96孔板倒置放在5% CO2、动态氧气[9](初始孵育时氧气压力为4%,以后每隔24 h氧气压力增加1%,直至最后的氧气压力为11%)、饱和湿度、37 ℃恒温培养箱内连续培养13 d。自放入培养箱开始计时,24 h后在倒置相差显微镜下评价分离的腔前卵泡,淘汰不符合标准的卵泡,共选取284枚状态良好卵泡进行培养,入围的卵泡占92.81%(284/306),平均直径为138.27 μm,卵母细胞平均直径为52.75 μm。隔日半定量换液。于培养第12天加入M2培养液,诱导排卵20 h后,观察卵泡的排卵情况。
2.1.4 培养质量的鉴定本实验从以下6个方面对所培养的腔前卵泡质量加以鉴定。①形态观察:每次换液后,利用倒置显微镜观察卵泡轮廓和卵母细胞形态、卵泡膜细胞生长状态和颗粒细胞增殖分化情况,是否有窦腔形成、卵丘颗粒细胞扩展、黏液化和COCs排出、有无出现黑色坏死区、卵母细胞逸出或者卵泡闭锁等;②直径:测定培养第2、4、6、8、10、12天卵泡和卵母细胞的直径;③卵泡存活率:于培养第12天观察卵泡存活情况,并计算卵泡存活率;④有腔卵泡形成率:观察第12天卵泡存活情况,计算有腔形成率;⑤卵母细胞成熟阶段分析:在倒置显微镜下观察卵母细胞成熟情况,并对生发泡期(germinal vesiele,GV)、生发泡破裂期(germinal vesiele breakdown,GVBD)和极体(a polar body,PB)进行区分;⑥激素测定:收集第2、4、6、8、10、12天更换的培养液置于−70 ℃冰箱内,用于测定E2,收集第10、12、13天的培养液用于测定P。E2和P的检测均采用酶联免疫法。
2.2 大鼠腔前卵泡的体内生长与体外成熟将来自同一窝的PND23雌性SD仔鼠ip 5 IU PMSG/只,进行超数排卵,48 h后安乐死,分离出大的有腔卵泡,观察其形态,并用显微镜微尺测量最大直径,用解剖针刺破大的有腔卵泡,将镜下可见的状态良好的COCs吸出并转移至6孔板(预先加入3 mL平衡过夜的M2培养基)中,在5% CO2、饱和湿度、37 ℃细胞培养箱内培养,20 h后观察COCs有无变化,并用吸管轻轻吹打去除卵丘颗粒细胞并暴露出卵母细胞,观察卵母细胞的成熟情况,区分GV、GVBD和PB。
2.3 统计学方法所用统计软件为SPSS 16.0。计量资料均以x±S表示,组间比较用独立样本t检验;定性资料采用文字描述。
3 结果 3.1 腔前卵泡的分离和体外培养 3.1.1 形态学变化体外培养的卵泡随着颗粒细胞的不断增殖分化,经历从只有2~3层颗粒细胞的无腔卵泡到有腔卵泡再到排卵前卵泡、COCs形成并排出、卵母细胞进一步分化成熟并排出第一极体的过程。
本实验体外培养的腔前卵泡大概在24 h之内能完成贴壁,在第2天即可见卵泡有生长迹象,部分卵泡的颗粒细胞会突破基底膜细胞生长,颗粒细胞增殖明显(图 1-2)。在第4~10天,卵泡处于最快生长期,大部分卵泡的颗粒细胞会突破基底膜并呈“摊鸡蛋”样生长,此时镜下可观察到颗粒细胞层较多的卵泡(图 1-3)。在第6天,初始培养时直径较大的卵泡部分可以观测到有液体充盈的腔隙形成(图 1-4),呈半月牙状。
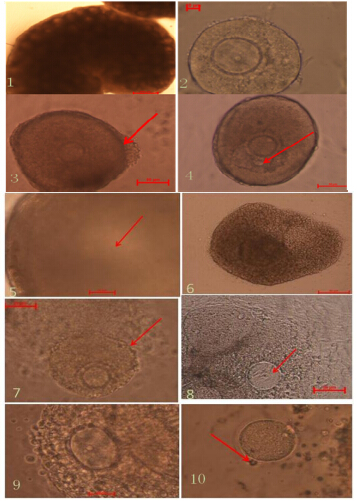 | 1-卵巢 2-贴壁卵泡 3-颗粒细胞突破基底膜生长 4-小腔卵泡 5-大腔卵泡 6-卵丘细胞黏液化 7-卵丘-卵母细胞复合体 8-生发泡期的卵母细胞 9-生发泡破裂期的卵母细胞 10-卵母细胞完成第二次减数分裂排出第一极体 1-ovary 2-follicle adhered to wall 3-granular cell 4-small antrum follicle 5-;arge antrum follicle 6-mucification of cumulus cell 7-cumulus oocyte cell complexes 8-oocyte in GV 9-oocyte in GVBD 10-PB release from maturated oocyte 图 1 不同阶段卵泡的形态学变化Fig. 1 Morphological characteristics in different stages of follicle development |
在第8天,镜下可观察到卵母细胞周围区域出现透明带,周围的颗粒细胞颜色加深并突出,培养板底部形成卵丘颗粒细胞层(包绕于卵母细胞膜层)。继续培养后,卵泡直径发生显著变化,且卵泡腔增大,COCs清晰可见,并突出于培养板底部,颜色变成深褐色。
在第12天,诱导排卵20 h后,可见卵丘细胞黏液化(图 1-6),COCs排出(图 1-7),脱离贴壁的卵泡悬浮于培养基中,周围的卵丘颗粒细胞排列疏松且直径变大,轻轻吹打便可脱离卵母细胞。镜下可见处于不同时期的卵母细胞,分别为不同时期的GV(图 1-8)、GVBD(图 1-9)和PB(图 1-10),表示腔前卵泡经历颗粒细胞的增殖分化发育至有腔卵泡,过渡到COCs的形成之后排出健康成熟的卵母细胞。
3.1.2 卵泡细胞和卵母细胞直径与第2天相比,卵泡细胞直径第6天开始出现显著性增长(P<0.01),卵泡细胞到第10天卵泡直径增长速度达到最快,直径平均值为386 μm;而卵母细胞直径第8天始出现显著性增长(P<0.05),第12天的直径为63.37 μm,见图 2、3。
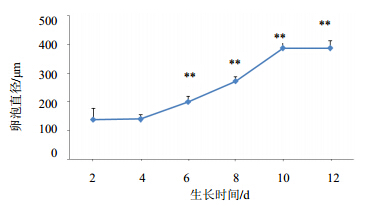 | 与第2天相比:**P<0.01**P<0.01 vs follicle diameter in 2nd 图 2 卵泡D2~D12直径增长曲线Fig. 2 Growth curve of follicle diameter for D2—D12 |
 | 与第2天相比:*P<0.05,**P<0.01*P<0.05,**P<0.01 vs oocyte diameter in 2nd 图 3 卵母细胞D2~D12直径增长曲线Fig. 3 Growth curve of oocyte diameter for D2—D12 |
本次实验培养的D12有腔卵泡形成率为25.82%,此时卵泡存活率为91.14%,诱导排卵后COCs排出率为38.38%;本实验室所进行的4次体外培养的卵泡D12成腔率、COCs排出率和存活率组间比较差异均无显著性,说明该模型稳定性较高。
3.1.4 激素分泌的变化见图 4、5,体外培养的卵泡在第4天即可检测到E2分泌,从第6天开始分泌量迅速增长,且随着培养时间的延长E2分泌量持续增长,于第10天达到分泌高峰期,持续到第
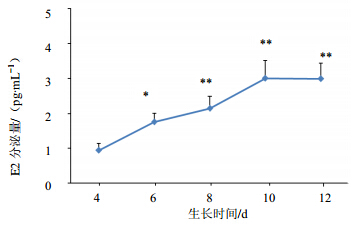 | 与第4天相比:*P<0.05,**P<0.01*P<0.05,**P<0.01 vs E2 in 4th 图 4 E2激素水平随生长时间的变化Fig. 4 Curve of E2 level change as growing time |
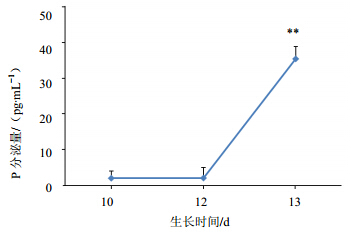 | 与第10天相比: **P<0.01**P<0.01 vs P level in 4th 图 5 P激素水平随生长时间的变化Fig. 5 Curve of P level change as growing time |
12天稍有下降趋势。从第10~12天测到有微量的P分泌,分泌量呈平稳趋势,在第13天诱导排卵以后,P分泌量激增,约为第10~12天的15~20倍。
3.2 大鼠腔前卵泡的体内生长及体外成熟本实验发现大部分卵泡通过重组激素体外排卵刺激20 h后,可以观察到卵丘细胞扩展并出现黏液化,暴露的卵母细胞可处于不同发育时期,分别是GV、GVBD、PB排出阶段,见图 6;体内、体外培养的卵泡和卵母细胞直径比较结果显示,体外生长的卵泡和卵母直径虽然比体内生长的略小,但是差异无显著性,说明大鼠腔前卵泡的体外培养方法建立成功,见图 7。
 | A-处于GV期的卵泡 B-处于GVBD期的卵泡 C-排出极体的成熟卵母细胞A-follicle in GV B-follicle in GVBD C-maturated oocyte releasing PB 图 6 大鼠体外成熟卵泡形态学的变化Fig. 6 Morphological characteristics of rat matured follicle in vitro |
 | 图 7 大鼠体内和体外生长卵泡及卵母细胞直径的比较Fig. 7 Comparison on diameters of follicle and oocyte in vivo and in vitro of rats |
目前分离卵泡的方法有酶消化和机械法两种。机械分离法可以避免酶处理对卵泡的损伤作用,获得相对质量好、基底膜完整的卵泡,但是数量较少、也会造成一定的机械损伤,因此比较适用于对卵泡需求数量少、卵泡质量要求高和卵泡直径大的实 验[14]。酶消化法对卵泡有无损伤尚无定论,研究报道不一致[10, 11, 12, 13],有报道认为此法虽能获取大量的腔前卵泡,但可能破坏卵泡的基膜,从而对卵泡发育有副作用。由于酶消化和机械分离法各有其自身的不足之处,因此Figueiredo[15]用酶消化-机械结合法成功建立了一套腔前卵泡的分离方法,但需要注意酶的浓度和作用时间。胶原酶与DNase I是分离卵巢常用的两种酶类。胶原酶可以破坏胶原中的肽链,消化卵巢间质中的胶原蛋白,使大量的卵泡释放出来,但容易损伤基底膜,造成卵泡结构的破坏;DNase I能够水解断裂DNA主链中的磷酸二酯键,其中DNase I是能够溶解受损细胞中DNA碎片的一种核酸酶。在分离液中添加DNase I能够消除死细胞对活细胞的不利影响[16]。
本实验选择这两种低浓度的酶与机械法相结合,酶作用时间调整为10 min,对腔前卵泡分离前后进行离心,更好地去除残留的酶,这样可以避免酶浓度过高、作用时间过长,甚至酶去除不净而损害卵巢的完整性,影响卵巢的活力。本实验所采用的酶-机械结合法可以明显缩短卵泡的分离时间,减少机械损伤,从而提高卵泡的质量。
氧气环境对于细胞的健康生长具有重要的影响,培养环境中的氧气量是否适宜直接决定细胞的状态[17]。在体外培养中,利用体内氧气压力以提高组织的功能已经成功应用于多个相关领域[18, 19]。研究证明[20],无血管组织模拟体内代谢的需要对卵泡发育、卵母细胞成熟、胚胎培养都是非常有益的。本实验选择的动态氧气为初始孵育时氧气压力设置为4%,即30.4 mmHg(1 mmHg=0.133 kPa),此时浓度更接近于腔前卵泡的体内生长。为了模拟从体外无血管到有血管氧气水平的过度,氧气压力每隔24 h增加1%,一直增加到与动脉氧气正常范围水平的11%(83.6 mmHg)。动态的氧气浓度不仅能更好地模拟自然的氧气环境,还能增加腔前卵泡的存活率、维持其完整的三维结构[21]、促进卵泡的发育,并能增加卵母细胞的减数分裂。
维生素C又称抗败血酸,是一种抗氧化剂,在清除自由基方面发挥重要的作用。在卵巢中,维生素C主要积聚在颗粒细胞、卵泡膜细胞和黄体细胞内,而且长期以来被认为与生育力有关[22]。在卵泡发育过程中,维生素C可以促进胶原蛋白的合成,维持卵泡基底膜的完整,参与类固醇激素的分 泌[23],降低卵泡细胞的凋亡[24],并且有利于颗粒细胞的体外生长。
本实验采用酶消化-机械结合法处理卵巢皮质,经台盼蓝染色进行卵泡活力测定,发现所分离的卵泡数量虽少,但入围的卵泡占92.81%(284/306),略高于本实验室普通二维培养的结果,大部分卵泡不会因为酶消化-机械结合法分离而出现闭锁凋亡现象,实验重复性好,稳定性较高;采用动态氧气法、向培养基中添加维生素C的方法进行培养,第12天有腔卵泡形成率为25.82%,此时卵泡存活率为90.14%;卵泡诱导排卵20 h后,可以观察到伴随卵丘细胞扩展和黏液化,此时COCs排出率为38.38%,高于大鼠体内卵泡发育至排卵前卵泡并且能正常排卵的数目。本实验室4次体外培养的卵泡第12天成腔率、COCs排出率和存活率组间比较差异均无显著性,说明该模型建立稳定性较高。
综上所述,本实验按照酶消化-机械结合法处理大鼠的卵巢,可回收大量高质量的腔前卵泡,采用动态氧气法、向培养基中添加维生素C的方法进行培养,培养过程当中重复性较好、稳定性较高,并且对卵泡的发育无明显影响。
本实验成功建立大鼠腔前卵泡的体外培养方法,该方法可以获得大量高质量的腔前卵泡,其体外发育与大鼠体内卵泡的发育相一致,从而实现了卵泡发育、激素生成以及卵子成熟3个方面共同监测卵泡发育到成熟这一动态过程的可能。
| [1] | Jin S Y, Lei L, Shikanov A, et al. A novel two-step strategy for in vitr oculture of early-stage ovarian follicles in the mouse [J]. Fertil Steril, 2010, 93(8): 2633-2639. |
| [2] | Walters K A, Binnie J P, Campbell B K, et al. The effects of IGF-1 on bovine follicle development and IGFBP-2 expression are dose and stage dependent [J]. Reproduction, 2006, 131(3): 515-523. |
| [3] | Martins F S, Celestino J J, Saraiva M V, et al. Growth and differentiation factor-9 stimulates activation of goat primordial follicles in vitro and their progression to secondary follicles [J]. Reprod Fertil Dev, 2008, 20(8): 916-924. |
| [4] | Tao Y, Zhou B, Xia G, et al. Exposure to L-ascorbic acid or alpha-tocopherol facilitates the development of porcine denuded oocytes frommet-aphase I to metaphase II and prevents cumulus cells from fragmentation [J]. Reprod Domest Anim, 2004, 39(1): 52-57. |
| [5] | 万旭英. 大、小鼠卵泡培养方法及其在雌性生殖毒性研究中的应用 [D]. 上海: 第二军医大学, 2008. |
| [6] | Lee S T, Choi M H, Lee E J, et al. Establishment of autologous embryonic stem cells derived from preantral follicle culture and oocyte parthenogenesis [J]. Fertil. Steril, 2008, 90(5): 1910-1920. |
| [7] | Wan X Y, Zhu J B, Zhu Y P, et al. A novel method for toxicology: in vitro culture system of a rat preantral follicle [J]. Toxicol Ind Health, 2011, 27(7): 637-645. |
| [8] | 李 海, 周 虚, 高志花, 等. 用台盼蓝和荧光染色法评价腔前卵泡的活力 [J]. 中国兽医学报, 2003, 23(5): 503-504. |
| [9] | Wycherley G, Downey D, Kane M T, et al. A novel follicle culture system markedly increases follicle volume, cell number and oestradiol secretion [J]. Reproduction, 2004, 127: 669-677. |
| [10] | Demeestere I, Delbaere A, Gervy C, et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice [J]. Hum Reprod, 2002, 17(8): 2152-2159. |
| [11] | De Mola L J R, Barnhart K, Kopf G S, et al. Comparison of two culture systems for the in-vitro growth and maturation of mouse preantral follicles [J]. Clin Exp Obstet Gynecol, 2004, 31(1): 15-19. |
| [12] | Leonel E C R, Bento-Silva V, Ambrozio K S. Methods for equine preantral follicles isolation: quantitative aspects [J]. Reprod Dom Anim doi, 2013: 1-3. |
| [13] | Carrell D T, Liu L, Huang I, et al. Comparison of maturation, meiotic competence, and chromosome aneuploidy of oocytes derived from two protocols for in vitro culture of mouse secondary follicles [J]. J Assist Reprod Genet, 2005, 22(9-10): 347-354. |
| [14] | Kim J H, Park K S, Song H B, et al. A simple isolating method of preantral follicles from mouse ovaries [J]. Fertil Steril, 2000, 27: 235-243. |
| [15] | Figueiredo J R. Development of a combined new mechamical and emzymatic method for the isolation of intact preantral follicle from fetal calf and adult bovine ovaries [J]. Theriogenology, 1993, (40): 789-799. |
| [16] | 丁 婷, 罗爱月, 杨书红, 等. 小鼠腔前卵泡不同分离方法的比较 [J]. 中国现代医学杂志, 2010, 20(5): 695-698. |
| [17] | Wycherley G, Downey D, Kane M T, et al. A novel follicle culture system markedly increases follicle volume, cell number and oestradiol secretion [J]. Reproduction, 2004, 127(6): 669-677. |
| [18] | Iwamoto M, Onishi A, Fuchimoto D, et al. Low oxygen tension during in vitro maturation of porcine follicular oocytes improves parthenogenetic activation and subsequent development to the blastocyst stage [J]. Theriogenology, 2005, 63(5): 1277-1289. |
| [19] | Gibbons J, Hewitt E, Gardner D K. Effects of oxygen tension on the establishment and lactate dehydrogenase. activity of murine embryonic stem cells [J]. Cloning Stem Cells Summer, 2006, 8(2): 117-122. |
| [20] | Matthew K H, Richard K, Elizabeth A. Dynamic oxygen enhances oocyte maturation in long-term follicle culture [J]. Tissue Eng, 2009, 15(3): 323-331. |
| [21] | Hu Y, Betzendahl I, Cortvrindt R, et al. Effects of low O2 and ageing on spindles and chromosomes in mouse oocytes from pre-antral follicle culture [J]. Hum Reprod, 2001, 16(4): 737-748. |
| [22] | Rossetto I B, Lima-Verde, Matos M H T, et al. Interaction between ascorbic acid and follicle-stimulating hormone maintains follicular viability after long-term in vitro culture of caprine preantral follicles [J]. Domest Anim Endocrin, 2009, 37: 112-123. |
| [23] | 彭夏雨, 汪立芹, 杨 梅, 等. 抗坏血酸、表皮生长因子和促卵泡素对绵羊卵巢皮质体外培养的影响 [J]. 生物工程学报, 2010, 26(6): 744-752. |
| [24] | Andrade E R, Hurk R, Lisboa L A, et al. Effects of ascorbic acid on in vitro culture of bovine preantral follicles [J]. Zygote, 2012, 20(4): 379-388. |
 2014, Vol. 37
2014, Vol. 37


