据统计,全球糖尿病患者高达3.82亿,这个数字到2035年预计将上升到5.92亿[1],在该人群中2型糖尿病约占90%[2]。2型糖尿病的特点是进展性胰岛素抵抗和β-细胞功能受损[3, 4]。长期高血糖以及特异性微血管并发症的进展,严重影响患者的生活质量和寿命[5, 6]。理想的血糖控制是防止这些并发症的发生,并减缓病情发展[7, 8, 9, 10]。目前,已有多种口服和注射制剂在临床上用来治疗2型糖尿病[11]。其中,口服抗高血糖药物主要包括双胍类、磺酰脲类、α-葡萄糖苷酶抑制剂、二肽基肽酶-4抑制剂、格列奈类和噻唑烷二酮类;注射用抗高血糖药物包括肠促胰岛素相关的制剂,如利拉鲁肽和艾塞那肽,以及各种胰岛素。以上大多数药物最初能有效地控制血糖,但单药治疗时不能长期维持正常血糖浓度,往往需要多个抗高血糖药物联合应用[12]。尽管有各种各样的治疗方案,仅有50%的2型糖尿病患者实现了糖化血红蛋白(HbA1c)低于7.0%[13]。此外,某些不良反应也限制了这些药物在临床上的使用,如胰岛素和胰岛素促泌剂可以导致低血糖和体质量增加,噻唑烷二酮与体质量增加和水肿相关,二甲双胍可以引起胃肠道反应和乳酸酸中毒风险。因此,2型糖尿病的临床治疗需求尚未被满足,仍然需要开发具有新机制的治疗药物。
钠-葡萄糖共转运蛋白2(sodium-dependent glucose transporter 2,SGLT2)是近年来发现的具有全新作用机制的一个糖尿病治疗靶点。SGLT2抑制剂通过抑制肾脏近端小管对葡萄糖的重吸收来增加尿中葡萄糖的排泄而达到控制血糖的目的,独立于葡萄糖依赖的胰岛素途径,低血糖发生风险降 低[14, 15, 16]。本文综述了SGLT2抑制剂的研究概况及临床研究进展。
1 SGLT2抑制剂的研究概况国内外第1个被研究充分的SGLT抑制剂是从天然苹果树的根皮中分离出来的根皮苷[17]。虽然根皮苷可以通过抑制肾脏SGLT增加尿糖的排出,降低血糖和改善胰岛素抵抗,但是由于其β-O-葡萄糖苷在小肠中容易被β-葡萄糖苷水解酶水解导致口服吸收不佳和严重的胃肠道副作用,根皮苷的临床研究被迫停止[18]。从2000年开始,研究人员根据根皮苷的分子骨架,对根皮苷的分子进行了优化,期望得到克服根皮苷缺点的SGLT2抑制剂作为降血糖药物。在早期的研究中人们根据根皮苷的结构进行衍生,发现了很多芳基O-糖苷类SGLT2抑制剂。这些候选药物均曾经进入过II期临床阶段,但是在完成II期临床实验后均终止了进一步的临床研究。分析认为它们在人体上的药效可能有问题,尽管这些候选药物的体外活性很强,而且有些对SGLT1/SGLT2的选择性也很好,但是它们的O-糖苷结构在人体内(肠道和血液中)极易被β-葡萄糖苷酶水解而失效,半衰期很短、血药浓度很低,因此要达到有临床意义的药效,其临床使用剂量必然会很高(>1 000 mg)。另外,在体内酶催化水解产生的苷元部分产生的不可预测的毒副作用也是一个重要的担忧。实际上,为了防止这些O-糖苷类化合物在肠道内被β-葡萄糖苷酶识别和水解,增加吸收,人们做了很多努力,譬如很多O-糖苷类SGLT2抑制剂均以成酯前药的形式出现,在葡萄糖部分的6-OH位置上增加一个MeOCO或者EtOCO,将6-OH转变成碳酸酯,这样就可以在口服时回避在肠道中被β-葡萄糖苷酶识别和水解而增加吸收。但是,这些前药在被吸收入血液中后很快被酯酶水解变成原形药物,进而被β-葡萄糖苷酶识别和水解,血药浓度仍然较低,苷元部分的安全性风险依然存在。
研究人员在芳基O-糖苷类抑制剂的基础上,为了克服体内根皮苷的酶水解作用,发现了芳基C-糖苷抑制剂,该类结构是目前研究的热点。其中,dapagliflozin于2012年在欧洲和2014年在美国被批准[19, 20],canagliflozin于2013年在美国被批准,ipraglifrozin于2014年在日本被批准,而这些或其他几个SGLT2抑制剂将很快在欧美和其他国家批准上市,详见表 1。
| 表 1 已经上市的SGLT2抑制剂的结构和研究状况 Table 1 Structures and research situation of SGLT2 inhibitors approved |
临床试验数据表明,上述6个已上市药物单药治疗16~24周均有降糖作用,并在减少体质量方面具有积极的效果。它们可以使2型糖尿病患者的HbA1c在基线水平上降低0.58%~1.03%,同时体质量减少2.2~3.4 kg(与排糖量有关,每天损失约200~300 kcal)。SGLT2抑制剂在白种人和亚洲人患者中未表现出种族差异[21, 22],该结果可能归因于SGLT2抑制剂独特的作用机制。此外,这种独特的作用机制使SGLT2抑制剂能在2型糖尿病发生发展的不同阶段有效地降低HbA1c,并可以与传统降糖药物包括胰岛素联合使用[23, 24]。
2.1 DapagliflozinDapagliflozin是全球第1个批准上市的SGLT2抑制剂。在一项24周安慰剂对照的III期临床试验中,dapagliflozin(2.5、5、10 mg,每日1次)单用或与二甲双胍[25]、格列美脲[26]、匹格列酮[27及胰岛素[28]联用,均能降低2型糖尿病患者的HbA1c和空腹血糖水平。长期随访试验也验证了dapagliflozin的积极疗效。Dapagliflozin加入二甲双胍治疗102周可以持续的降低HbA1c水平、空腹血糖和体质量,且没有增加2型糖尿病患者由于单独使用二甲双胍而引起的低血糖风险[29]。治疗102周,HbA1c水平从基线(8.06%)的平均变化值为安慰剂组+0.02%,而dapagliflozin 2.5、5和10 mg剂量组分别为−0.48%(P=0.000 8)、−0.58%(P<0.000 1)和−0.78%(P<0.000 1)。此外,所有经dapagliflozin治疗患者的空腹血糖和体质量从基线水平持续降低,而接受安慰剂的患者的这2项指标则相应的增加。二甲双胍治疗血糖控制不佳的患者,分别经dapagliflozin(≤10 mg/d)或格列吡嗪(≤20 mg/d)治疗52周,观察到患者的HbA1c水平从基线降低约0.52%,二者的降糖效果类似,表现出非劣效的关系;但在体质量的变化方面,dapagliflozin组从基线水平降低了3.2 kg,而格列吡嗪组则增加了1.4 kg[30]。对上述患者随访4年的数据表明,2个治疗组对HbA1c的控制效果均随着时间的推移而递减,但与格列吡嗪相比,dapagliflozin显示出更多持久的疗效(HbA1c基线变化值:−0.1% vs +0.2%,95%可信区间为−0.51~−0.09);dapagliflozin也具有持续和稳定的减肥作用(体质量基线变化值:−3.95 kg vs +1.12 kg,95%可信区间为−6.21~−3.93);并且dapagliflozin组可以降低患者的平均收缩压,而格列吡嗪组未见此改变[31]。
2.2 CanagliflozinCanagliflozin是第1个通过FDA审批的SGLT2抑制剂,于2013年上市[32]。在26周的单药治疗中,与安慰剂(+0.14%)比较,canagliflozin 100和300 mg治疗的患者HbA1c水平基线变化值分别为−0.77%和−1.03%(P<0.001)[33]。在治疗52周时,与西格列汀比较,canagliflozin 100和300 mg治疗具有非劣效性,其中canagliflozin 300 mg在降低HbA1c方面疗效更佳(−0.88 vs −0.73%)[34]。治疗26周时,与安慰剂组(−1.2%)比较,canagliflozin 100和300 mg组患者体质量基线平均变化值分别为−3.7%和−4.2%(P<0.001);组治疗52周时,与西格列汀(−1.3%)比较,canagliflozin 100和300 mg患者体质量基线平均变化值分别为−3.8%和−4.2%(P<0.001)。同时,在这2项研究中,canagliflozin 2个剂量均降低患者的空腹血糖和平均收缩压(P<0.001)。在一项52周的联合治疗研究中,与二甲双胍或磺酰脲类合用,canagliflozin也可改善2型糖尿病患者的血糖,降低体质量,并且耐受性良好[35]。治疗26周时,与安慰剂组比较(−0.13%),canagliflozin 100和300 mg组患者HbA1c水平基线变化值分别为−0.85%和−1.06%(P<0.001);治疗52周时,与安慰剂组比较(0.01%),canagliflozin治疗组患者HbA1c水平基线变化值分别为−0.74%和−0.96%(P<0.001)。患者使用canagliflozin 100 mg/d(−0.82%)和300 mg/d(−0.93%)联合二甲双胍治疗52周时,HbA1c的降低水平不劣于格列美脲治疗组(格列美脲的剂量范围从起始剂量1 mg到最高剂量6或8 mg;−0.81%)。Canagliflozin 300 mg/d在降低HbA1c方面优于格列美脲,且在减少体质量方面2个剂量的canagliflozin都优于格列美脲,其水平基线变化值分别为canagliflozin 100 mg/d组−3.7 kg,canagliflozin 300 mg/d组−4.0 kg,格列美脲组+0.7 kg[35]。患者52周的基线特征和体质量变化,与主要研究报道一致。在canagliflozin组,大约2/3的体质量减少来自脂肪质量,1/3来自瘦肉组织,使用格列美脲体质量的增加包括脂肪和瘦肉组织。通过计算机断层扫描成像分析,canagliflozin组的内脏脂肪组织比皮下脂肪组织略有减少。该研究的2年随访中,与安慰剂组比较,canagliflozin 100和300 mg组,及格列美脲的HbA1c水平基线变化值分别为−0.65%、−0.746%和−0.55%,而在体质量减少方面,3组的水平基线变化值分别为−4.1%、−4.2%、+0.9%,canagliflozin 2个剂量组均优于格列美脲组[36]。
2.3 Ipragliflozin在日本进行的一项为期24周的临床试验中,对于单独应用二甲双胍无法控制血糖的2型糖尿病患者,ipragliflozin(50 mg/d)可以使患者的HbA1c水平降低0.87%,而安慰剂组则增加0.38%(P<0.001),同时,患者的体质量也有所下降(ipragliflozin组−2.3 kg,安慰剂组−0.6 kg)[37]。在另一项长达52周的临床试验中,ipragliflozin(50~100 mg/d)对2型糖尿病患者的HbA1c(−0.51%)和体质量(−3.41 kg)均具有较好的疗效[38]。
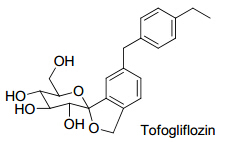
2.4 Tofogliflozin在日本进行的一项为期52周临床试验中,tofogliflozin作为单药治疗或与其他口服抗糖尿病的药物联用治疗2型糖尿病患者的结果显示,tofogliflozin可以改善血糖控制和减少体质量。治疗52周后,tofogliflozin(20、40 mg)单药治疗患者HbA1c水平的基线变化值均为−0.7%;体质量改变分别为−3.1 kg(20 mg)和−3.4 kg(40 mg)。联合治疗患者HbA1c水平的基线变化值为−0.8%(20 mg)和−0.9%(40 mg),体质量改变分别为−2.5 kg(20 mg)和−3.0 kg(40 mg)。此外,tofogliflozin可以降低收缩压和舒张压、改善胰岛素抵抗,以及增加血清脂联素和高密度脂蛋白水平[39]。
2.5 Empagliflozin对于2型糖尿病患者,empagliflozin治疗12周可以促进葡萄糖排泄,降低空腹血糖(empagliflozin 25 mg/d组−31.1 mg/dL,安慰剂组+0.8 mg/dL)、HbA1c水平(empagliflozin 25 mg/d组−0.63%,安慰剂组+0.09%)和体质量(empagliflozin 25 mg/d组−2.0 kg,安慰剂组−0.8 kg)[40]。在一项随机、双盲试验中,empagliflozin(10、25 mg)或安慰剂联合基础胰岛素治疗78周时,empagliflozin能够显著降低HbA1c水平(empagliflozin 10 mg组−0.48%,empagliflozin 25 mg组−0.64%,安慰剂组−0.02%)和体质量(empagliflozin 10 mg组−2.2 kg,empagliflozin 25 mg组−2.0 kg,安慰剂组+0.7 kg)。此外,empagliflozin 10 mg也可以显著降低收缩压(empagliflozin 4 mg组−4.1 mmHg(1 mmHg=0.133 kPa),empagliflozin 25 mg组−2.4 mmHg,安慰剂组+0.1 mmHg)[41]。在另一项随机、开放式的双盲研究中,empagliflozin(单药治疗剂量10 mg或25 mg,或与二甲双胍联用)和二甲双胍联用、西格列汀及其与二甲双胍联用,第90周时HbA1c水平基线变化值分别为−0.34%~−0.63%、−0.56%和−0.40%;体质量基线变化值分别为−2.2~−4.0 kg、−1.3 kg和−0.4 kg[42]。因此,长期empagliflozin治疗可以在2型糖尿病患者中提供持续的血糖和体质量控制。
2.6 Luseogliflozin在日本进行的一项为期52周的临床试验中,luseogliflozin作为单药治疗或与其他5种口服抗糖尿病药物联用治疗2型糖尿病患者的结果显示,luseogliflozin可以改善血糖控制和减少体质量。治疗52周后,luseogliflozin单药治疗或与格列美脲、二甲双胍、DPP4抑制剂、匹格列酮、格列奈类和α-葡萄糖苷酶抑制剂联用后患者HbA1c水平的基线变化值分别为−0.50%、−0.63%、−0.61%、−0.52%、−0.60%、−0.59%和−0.68%;同时,体质量变化值分别为−2.7、−2.2、−2.9、−2.0、−2.3、−2.9和−2.8 kg。此外,luseogliflozin也可以降低血压,并具有改善血脂(三酰甘油和高密度脂蛋白)的趋势[43, 44, 45]。
3 SGLT2抑制剂的安全性 3.1 尿路和生殖器感染SGLT2抑制剂的主要安全问题之一是由于其本身性质所引起的尿液中葡萄糖水平升高,并导致尿路和生殖器感染,电解质失衡,并增加尿频。如尿路感染和生殖器感染在临床试验报告中的发生率为2.8%(dapaglifrogin 5 mg)和7.2%(canagliflozin 100 mg)[26, 33]。在系统评估中,应用SGLT2抑制剂治疗的患者尿路感染现象比那些接受安慰剂治疗组更普遍(优势比为1.34,95%可信区间为1.03~1.74;I2=0%)[46]。此外,也有证据表明应用SGLT2抑制剂可以增加生殖道感染的发病率,与安慰剂比较(优势比为3.50,95%可信区间为2.46~4.99;I2=0%),与传统降糖药物比较(优势比为5.06,95%可信区间为3.44~7.45;I2=0%)。女性比男性更容易感染。
3.2 低血糖由于SGLT2抑制剂的作用机制不依赖胰岛素分泌,其不太可能引起低血糖风险,这也是一些其他降糖药物的所不具备的特点[47]。大多数治疗组的低血糖的发生率很低,除了已接受或联合磺酰脲类或胰岛素治疗的患者。
3.3 致癌风险在接受dapagliflozin治疗的5 478名患者中,有9例膀胱癌,而对照组3 136名患者中仅有1例[47, 48]。接受dapagliflozin治疗的2 223名患者中,有9例乳腺癌,而对照组1 053名患者中也仅有1例[48]。2011年,FDA顾问委员会投票反对批准dapagliflozin是因为担心其增加膀胱癌和乳腺癌的风险[48, 49],FDA要求增加额外的临床试验数据以确定这种疗法的风险收益比率。进一步数据分析也正在确定dapagliflozin治疗可能增加患癌症的风险。2014年1月,FDA批准dapaglifozin用于在有2型糖尿病成人中作为辅助饮食和运动改善血糖控 制[19]。对每年大约披露8 000人的9个临床试验结果进行汇集分析,在膀胱癌发病率方面并没有显示canagliflozin组(6 648名患者中5例)和对照组 (3 640名患者中4例)有任何差异[46]。同样,乳腺癌的发病率canagliflozin(2 827名患者中12例)和对照组(1 501名患者中6例)比较也并没有差异。然而,临床医生必须谨慎关注临床上长期使用SGLT2抑制剂引起癌症风险的发生率,因此,长期随访数据和累积数据对分析癌症发病率和SGLT2抑制剂之间的关系是必需的。
3.4 心血管事件对14项临床试验(n = 6 300)的荟萃分析表明,与对照组相比,dapagliflozin对心血管系统影响的优势比为0.73(95%可信区间为0.46~1.16;I2= 0%)[46]。在心血管疾病患者中进行dapagliflozin治疗的2个试验的汇集分析表明[50, 51],与安慰剂组比较,dapagliflozin复合心血管终点的风险率(心血管死亡、心肌梗死、卒中和住院治疗不稳定性心绞痛)为1.07(95%可信区间为0.64~1.72)[52]。一项基于10个临床试验共纳入10 474名患者的数据显示,与安慰剂和传统降糖药物对照组比较,canagliflozin与增加复合心血管终点的结果无关。在FDA的报告中,接受canagliflozin(6 876患者/年)治疗患者的非致死性卒中的发生率要高于对照组(3 470患者/年)(风险比为1.46,95%可信区间为0.83~2.58)。此外,在特定心血管试验的前30天观察到的心血管事件发生率存在不平衡[53],canagliflozin(13/2 886)和安慰剂(1/1 441)导致HR为6.50(95%可信区间为0.85~49.66),可能归因于canagliflozin治疗后的体质损耗。这种不平衡在试验进行30 d后并不明显。心血管事件和死亡的数据是不确定的。不平衡数值在接受canagliflozin所引起的非致命性卒中事件的患者数需要澄清和进一步确认。临床上使用的几个SGLT2抑制剂,包括canagliflozin的心血管事件随访试验正在进行中。
3.5 其他与其他降糖药物相比,SGLT2抑制剂诱导的低血压风险更高(优势比为2.68,95%可信区间为1.14~6.29)[46]。在中度肾损伤患者中,与安慰剂相比,dapagliflozin和canagliflozin由于渗透性利尿和体积引起的肾脏相关的不良事件发病率增加。关于肝脏相关的不良事件,接受dapagliflozin或canagliflozin的患者和对照组相比有轻微失衡,这可能与研究药物无关。
4 展望现有的临床试验表明,SGLT2抑制剂在控制血糖水平和降低体质量方面具有积极疗效。由尿液排泄的热量造成的能量消耗可起到减肥或者平衡体质量的效应。随访试验也显示了这几种SGLT2抑制剂的长期有效性和作用的持久性,如dapagliflozin,在改变HbA1c水平和降低体质量方面上优于磺酰脲类药物[31]。此外,SGLT2抑制剂也具有改善代谢和心血管危险因素(血压、血脂、脂联素和肝脏功能障碍引起的脂肪肝)的潜力。
SGLT2抑制剂可能通过改善β-细胞功能以及胰岛素抵抗在糖尿病的进展中起到预防作用。虽然这种作用首先是在动物模型中发现[54, 55, 56, 57],但在临床研究中已经有一些关于SGLT2抑制剂改善β-细胞功能的报道[33, 34]。这种预防作用可能是由于“糖毒性”的衰减而引起的间接影响,因为SGLT2抑制剂的作用机制不依赖胰岛素分泌,无论β-细胞处于何种状态,SGLT2抑制剂均可表现出良好的血糖控制作用和长期耐受性。与其他直接影响胰岛素分泌的抗糖尿病药物相比,SGLT2抑制剂新颖的作用机制意味着该类药物可以联合其他口服抗糖尿病药物以及胰岛素在治疗2型糖尿病中发挥相加或协同效应。事实上,联合的治疗方案已经在临床上显示出良好的疗效,在降低HbA1c水平和体质量的作用不劣于使用单药治疗。
SGLT2抑制剂作为单药治疗或与不导致低血糖的药物联合使用,不会增加低血糖的风险。当然,与可导致低血糖风险的药物如磺脲类药物和胰岛素联用时,仍然存在低血糖的风险,但该风险可被控制。葡萄糖通过尿液排出也可引起2型糖尿病患者生殖器真菌感染,SGLT2抑制剂可能不适合有这类病史的患者。大多数患者通常不发生感染,或者是轻度感染,如果早期识别是可以控制的。尿路感染也是如此,试验发现SGLT2抑制剂使葡萄糖从尿液排出时,小幅增加尿路感染的发病率。没有导致低血压的证据,虽然SGLT2抑制剂导致渗透性利尿,但没有导致脱水的证据,当然在体液减少的患者不宜使用这类药物。此外,SGLT2抑制剂需要足够的肾小球滤过使葡萄糖进入近端肾小管,然后抑制其重吸收。肾小球滤过功能下降,疗效可能会下降;因此,对于肾小球滤过率很低的患者,SGLT2抑制剂治疗是不适用的。另外,晚期2型糖尿病患者通常合并慢性肾脏病,所以在选择SGLT2抑制剂治疗时需要认真考虑[58, 59, 60]。SGLT2作为糖尿病治疗的一个新靶点,其抑制剂在临床应用的时间较短,尽管其疗效得到广泛证实,但其安全性和耐受性(如致癌性、对肾功能和血脂的作用)仍需更多的循证医学数据支持。
综上所述,鉴于SGLT2抑制剂的作用途径与传统降糖药物具有本质的不同,可避免传统药物的毒副作用,并可与传统药物联合使用,帮助早期、中期和晚期(肾功能尚可)2型糖尿病患者实现更理想的血糖控制,其药物效益远高于安全风险。因此,该类药物具有良好的临床应用前景,该类药物的上市可为临床医生提供了一个全新的用药选择。
| [1] | International Diabetes Federation.IDF Diabetes Atlas[S].6th edn.2013. |
| [2] | Danaei G, Finucane M M, Lu Y, et al.National, regional, and global trends in fasting plasma glucose and diabetesprevalence since 1980: systematic analysis of healthexamination surveys and epidemiological studies with370 country-years and 2.7 million participants[J].Lancet, 2011; 378: 31-40. |
| [3] | Prentki M, Nolan C J.Islet cell failure in type 2 diabetes[J].J Clin Invest, 2006, 116: 1802-1812. |
| [4] | O'Rahilly S.Human obesity and insulin resistance:lessons from experiments of nature[J].Biochem SocTrans, 2007, 35: 33-36. |
| [5] | Pirola L, Balcerczyk A, Okabe J, et al.Epigeneticphenomena linked to diabetic complications[J].Nat RevEndocrinol, 2010, 6: 665-675. |
| [6] | L'Abbate A.Large and micro coronary vascularinvolvement in diabetes[J].Pharmacol Rep, 2005, 57(Suppl.): 3-9. |
| [7] | UKPDS 34.Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34).UK Prospective Diabetes Study (UKPDS) Group[J].Lancet, 1998, 352:854-865. |
| [8] | UKPDS 33.Intensive blood-glucose control withsulphonylureas or insulin compared with conventionaltreatment and risk of complications in patients with type 2diabetes (UKPDS 33).UK Prospective Diabetes Study(UKPDS) Group[J].Lancet, 1998, 352: 837-853. |
| [9] | Ohkubo Y, Kishikawa H, Araki E, et al.Intensive insulintherapy prevents the progression of diabeticmicrovascular complications in Japanese patients withnon-insulin-dependent diabetes mellitus: a randomizedprospective 6-year study[J].Diabetes Res Clin Pract, 1995, 28: 103-117. |
| [10] | Holman R R, Paul S K, Bethel M A, et al.10-yearfollow-up of intensive glucose control in type 2 diabetes[J].N Engl J Med, 2008, 359: 1577-1589. |
| [11] | American Diabetes Association.Standards of medicalcare in diabetes-2014[J].Diabetes Care, 2014, 37 (Suppl1): S14-S80. |
| [12] | Kahn S E, Haffner S M, Heise M A, et al.Glycemicdurability of rosiglitazone, metformin or glyburidemonotherapy[J].N Engl J Med, 2007, 356: 1387-1388. |
| [13] | Ong K L, Cheung B M, Wong L Y, et al.Prevalence, treatment, and control of diagnosed diabetes in the U.S.National Health and Nutrition Examination Survey 1999–2004[J].Ann Epidemiol, 2008, 18: 222-229. |
| [14] | Rahmoune H, Thompson P W, Ward J M, et al.Glucosetransporters in human renal proximal tubular cellsisolated from the urine of patients with non-insulindependentdiabetes[J].Diabetes, 2005, 54: 3427-3434. |
| [15] | Bakris G L, Fonseca V A, Sharma K, et al.Renalsodiumglucose transport: role in diabetes mellitus andpotential clinical implications[J].Kidney Int, 2009, 75:1272-1277. |
| [16] | 王小彦, 王玉丽, 徐为人.近几年治疗糖尿病热点靶点的研究进展[J].药物评价研究, 2012, 35(1): 42-45. |
| [17] | Calado J, Santer R, Rueff J.Effect of kidney disease onglucose handling (including genetic defects)[J].KidneyInt Suppl, 2011, 79: S7-S13. |
| [18] | Ehrenkranz J R, Lewis N G, Kahn C R, et al.Phlorizin: areview[J].Diabetes Metab Res Rev, 2005, 21: 31-38. |
| [19] | Rossetti L, Smith D, Shulman G I, et al.Correction ofhyperglycemia with phlorizin normalizes tissuesensitivity to insulin in diabetic rats[J].J Clin Invest, 1987, 79: 1510-1515. |
| [20] | 王玉丽, 王小彦, 赵桂龙, 等.钠-葡萄糖协同转运蛋白2 抑制剂类抗糖尿病新药的研发概况[J].现代药物与临床, 2012, 27(2): 138-142. |
| [21] | Zambrowicz B, Freiman J, Brown P M, et al.LX4211, adual SGLT1/SGLT2 inhibitor, improved glycemic controlin patients with type 2 diabetes in a randomized, placebocontrolled trial[J].Clin Pharmacol Ther, 2012, 92: 158-169. |
| [22] | Fukushima M, Suzuki H, Seino Y.Insulin secretioncapacity in the development from normal glucosetolerance to type 2 diabetes[J].Diabetes Res Clin Pract, 2004, 66(Suppl 1): S37-S43. |
| [23] | Inagaki N, Kondo K, Yoshinari T, et al.Efficacy andsafety of canagliflozin in Japanese patients with type 2diabetes: a randomized, double-blind, placebo-controlled, 12-week study[J].Diabetes Obes Metab, 2013, 15:1136-1145. |
| [24] | Zhang L, Feng Y, List J, et al.Dapagliflozin treatment inpatients with different stages of type 2 diabetes mellitus:effects on glycaemic control and body weight[J].Diabetes Obes Metab, 2010, 12: 510-516. |
| [25] | Cefalu W T, Leiter L A, Yoon K H, et al.Canagliflozindemonstrates durable glycemic improvements over 104weeks versus glimepiride in subjects with type 2 diabetesmellitus on metformin[J].Diabetes, 2013; 62(Suppl 1A):LB18. |
| [26] | Bailey C J, Gross J L, Pieters A, et al.Effect ofdapagliflozin in patients with type 2 diabetes who haveinadequate glycaemic control with metformin: arandomised, doubleblind, placebo-controlled trial[J].Lancet, 2010, 375: 2223-2233. |
| [27] | Strojek K, Yoon K H, Hruba V, et al.Effect ofdapagliflozin in patients with type 2 diabetes who haveinadequate glycaemic control with glimepiride: arandomized, 24-week, double-blind, placebo-controlledtrial[J].Diabetes Obes Metab, 2011, 13: 928-938. |
| [28] | Rosenstock J, Vico M, Wei L, et al.Effects ofdapagliflozin, an SGLT2 inhibitor, on HbA1c, bodyweight, and hypoglycemia risk in patients with type 2diabetes inadequately controlled on pioglitazonemonotherapy[J].Diabetes Care, 2012, 35: 1473-1478. |
| [29] | Wilding J P H, Woo V, Soler N G, et al.Long-termefficacy of dapagliflozin in patients with type 2 diabetesmellitus receiving high doses of insulin[J].Ann InternMed, 2012, 156: 405-415. |
| [30] | Bailey C J, Gross J L, Hennicken D, et al.Dapagliflozin add-on to metformin in type 2 diabetes inadequately controlled with metformin: a randomized, double-blind, placebocontrolled 102-week trial[J].BMC Med, 2013, 11: 43. |
| [31] | Nauck M A, Del Prato S, Meier J J, et al.Dapagliflozin versus glipizide as add-on therapy in patients with type 2 diabetes who have inadequate glycemic control with metformin: a randomized, 52-week, double-blind, active-controlled noninferiority trial[J].Diabetes Care, 2011, 34: 2015-2022. |
| [32] | Clar C, Gill J A, Court R, et al.Systematic review ofSGLT2 receptor inhibitors in dual or triple therapy in type2 diabetes[J].BMJ Open, 2012, 2: 1-12. |
| [33] | Dietrich E, Powell J, Taylor J R.Canagliflozin: a noveltreatment option for type 2 diabetes[J].Drug Des DevelTher, 2013, 22: 1399-1408. |
| [34] | Stenlöf K, Cefalu W T, Kim K A, et al.Efficacy andsafety of canagliflozin monotherapy in subjects with type2 diabetes mellitus inadequately controlled with diet andexercise[J].Diabetes Obes Metab, 2013, 15: 372-382. |
| [35] | Lavalle-Gonzólez F J, Januszewicz A, Davidson J, et al.Efficacy and safety of canagliflozin compared withplacebo and sitagliptin in patients with type 2 diabetes onbackground metformin monotherapy: a randomised trial[J].Diabetologia, 2013, 56: 2582-2592. |
| [36] | Cefalu W T, Leiter LA, Yoon K H, et al.Efficacy andsafety of canagliflozin versus glimepiride in patients withtype 2 diabetes inadequately controlled with metformin(CANTATA-SU): 52 week results from a randomised, doubleblind, phase 3 non-inferiority trial[J].Lancet, 2013, 382: 941-950. |
| [37] | Ferrannini E, Berk A, Hantel S, et al.Long-term safetyand efficacy of empagliflozin, sitagliptin, and metformin:an active-controlled, parallel-group, randomized, 78-weekopen-label extension study in patients with type 2diabetes[J].Diabetes Care, 2013, 36: 4015-4021. |
| [38] | Goto K, Kashiwagi A, Kazuta K, et al.Ipragliflozinreduces A1C and body weight in type 2 diabetes patientswho have inadequate glycemic control on metforminalone: ILLUMINATE study[J].Diabetes, 2012, 61:A269. |
| [39] | Haneda M, Seino Y, Sasaki T, et al.Luseogliflozin, aSGLT2 inhibitor, as add-on therapy to 5 types of oralantidiabetic drugs improves glycaemic control andreduces body weight in Japanese patients with type 2diabetes mellitus[J].Diabetologia, 2013, 56(Suppl 1):S384. |
| [40] | Prato S D.Durability of dapagliflozin vs.glipizide asadd-on therapies in T2DM inadequately controlled onmetformin: 4-year data[J].Diabetes, 2013, 62(Suppl 1A):LB17. |
| [41] | Ferrannini E, Seman L J, Seewaldt-Becker E, et al.Thepotent and highly selective sodium-glucose co-transporter(SGLT-2) inhibitor BI10773 is safe and efficacious asmonotherapy in patients with type 2 diabetes mellitus[J].Diabetologia, 2010, 53: S351. |
| [42] | Rosenstock J, Jelaska A, Wang F, et al.Empagliflozin asaddon to basal insulin for 78 weeks improves glycemiccontrol with weight loss in insulin-treated type 2 diabetes[J].Diabetes, 2013, 62: A285. |
| [43] | Kawano H, Kashiwagi A, Kazuta K, et al.Long-termsafety, tolerability and efficacy of ipragliflozin inJapanese patients with type 2 diabetes mellitus: IGNITE[J].Diabetes, 2012, 61(Suppl 1): A610. |
| [44] | Seino Y, Sasaki T, Fukatsu A, et al.Luseogliflozin, aSGLT2 inhibitor, improves glycaemic control and reducesbody weight as monotherapy up to 52 weeks in Japanesepatients with type 2 diabetes mellitus[J].Diabetologia, 2013, 56(Suppl 1): S384. |
| [45] | Inagaki N, Seino Y, Sasaki T, et al.Luseogliflozin, aselective SGLT2 inhibitor, added on to glimepiride for 52weeks improves glycaemic control with no majorhypoglycaemia in Japanese type 2 diabetes patients[J].Diabetologia, 2013, 56(Suppl 1): S82. |
| [46] | Tanizawa Y, Araki E, Tobe K, et al.Efficacy and safety oftofogliflozin administered for 52 weeks as monotherapyor combined with other oral hypoglycaemic agents inJapanese patients with type 2 diabetes[J].Diabetologia, 2013, 56(Suppl 1): S82-S83. |
| [47] | Vasilakou D, Karagiannis T, Athanasiadou E, et al.Sodiumglucose cotransporter 2 inhibitors for type 2diabetes: a systematic review and meta-analysis[J].AnnIntern Med, 2013, 159: 262-274. |
| [48] | Riser Taylor S, Harris K B.The clinical efficacy andsafety of sodium glucose cotransporter-2 inhibitors inadults with type 2 diabetes mellitus[J].Pharmacotherapy, 2013, 33: 984-999. |
| [49] | Food and Drug Administration.FDA Briefing DocumentNDA 202293.Dapagliflozin 5 and 10 mg[EB/OL].(2011)[2014-7-15].http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/Endocrinologicand MetabolicDrugsAdvisoryCommittee/UCM262994.pdf. |
| [50] | Burki T K.FDA rejects novel diabetes drug over safetyfears[J].Lancet, 2012, 379: 507. |
| [51] | Cefalu W T, Leiter L A, Debruin T W, et al.Dapagliflozintreatment for type 2 diabetes mellitus patients with comorbid cardiovascular disease and hypertension[J].Diabetes, 2012, 61(Suppl 1): A271. |
| [52] | Leiter L A, Cefalu W T, Debruin T W, et al.Efficacy andsafety of dapagliflozin for type 2 diabetes mellituspatients with a history of cardiovascular disease[J].Diabetes, 2012, 61(Suppl 1): A287. |
| [53] | European Medicines Agency.Assessment Report: Forxiga(Dapagliflozin)[EB/OL].(2012)[2014-7-15].http//:www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002322/WC500136024.pdf. |
| [54] | Matthews D R, Fulcher G, Perkovic V, et al.Efficacy andsafety of canagliflozin (CANA), an inhibitor of sodiumglucose co-transporter 2 (SGLT2), added-on to insulintherapy +/- oral agents in type 2 diabetes[J].Diabetologia, 2012, 55(Suppl 1): S314-S315. |
| [55] | Han S, Hagan D L, Taylor J R, et al.Dapagliflozin, aselective SGLT2 inhibitor, improves glucose homeostasisin normal and diabetic rats[J].Diabetes, 2008, 57:1723-1729. |
| [56] | Luippold G, Klein T, Mark M, et al.Empagliflozin, anovel potent and selective SGLT-2 inhibitor, improvesglycaemic control alone and in combination with insulinin streptozotocin-induced diabetic rats, a model of type 1diabetes mellitus[J].Diabetes Obes Metab, 2012, 14:601-607. |
| [57] | Suzuki M, Honda K, Fukazawa M, et al.Tofogliflozin, apotent and highly specific sodium/glucose cotransporter 2inhibitor, improves glycemic control in diabetic rats andmice[J].J Pharmacol Exp TherJ, 2012, 341: 692-701. |
| [58] | Liang Y, Arakawa K, Ueta K, et al.Effect of canagliflozinon renal threshold for glucose, glycemia, and body weightin normal and diabetic animal models[J].PLoS ONE, 2012, 7: e30555. |
| [59] | Nicolle L E, Capuano G, Ways K, et al.Effect ofcanagliflozin, a sodium-glucose cotransporter 2(SGLT2)inhibitors, on bacteria and urinary tract infection insubjects with type 2 diabetes enrolled in a 12-week, phase2 study[J].Curr Med Res Opin, 2012, 28: 1167-1171. |
| [60] | Kim Y, Babu A R.Clinical potential of sodium-glucosecotransporter 2 inhibitors in the management of type 2diabetes[J].Diabetes Metab Syndr Obes, 2012, 5:313-327. |
 2014, Vol. 37
2014, Vol. 37