2. 沈阳军区总医院, 辽宁 沈阳 110016;
3. 沈阳药科大学中药学院, 辽宁 沈阳 110016;
4. 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. General Hospital of Shenyang Military Region, Shenyang 110016, China;
3. College of Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China;
4. Key Laboratory of Structure-based Drug Design and Discovery of Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
复方川芎滴丸以川芎、当归组方,方中川芎性温,味辛,富含苯肽类、酚酸类、生物碱类。功能活血行气、祛风止痛,主治血瘀气滞所致月经不调、痛经经闭、肝郁气滞而致血行不畅的胸胁疼痛、头痛、风寒湿痹、跌打肿痛等疾病[1],为君药。当归性温,味甘、辛,富含黄酮类、酚酸类、内酯类、苯酞类、多糖类[2~3],功能补血活血、调经止痛、润肠通便,主治血虚萎黄、眩晕心悸、月经不调、经闭痛经、虚寒腹痛、风湿痹痛、跌扑损伤、痈疽疮疡、肠燥便秘[4],为臣药。二药作为复方川芎滴丸的药用成分,能够活血行气、祛风止痛、镇静解痉,用于预防和治疗冠脉循环功能不全,脑动脉硬化。为了更好地控制该制剂的质量,本实验利用高效液相色谱(HPLC)法建立了该制剂的质量标准,对制剂中当归、川芎进行薄层色谱定性鉴别,并对制剂中主要成分阿魏酸进行了定量研究。
1 仪器与试药LC3000型高效液相色谱仪(创新通恒,二元梯度泵,UV检测器,CXTH—3000工作站),色谱柱为YMC-Pack ODS-A(AA20S11-2546WT,250 mm×4.6 mm,10 μm),RPL—D2000柱温箱(大连日普利科技仪器有限公司),UV—1700岛津紫外可见分光光度计,BT125D电子天平(十万分之一,赛多利斯科学仪器(北京)有限公司),HH—S2恒温水浴锅(郑州长城科工贸有限公司)。阿魏酸对照品(中国食品药品检定研究院,供含量测定用,批号110773-201012);川芎对照药材(中国食品药品检定研究院,批号120918- 200406)、当归对照药材(中国食品药品检定研究院,批号120927-201014);复方川芎滴丸(舒脑心滴丸)(中国人民解放军第88医院,山东泰安,批号130426、130522、130531);甲醇(天津市康科德科技有限公司,色谱纯);醋酸(天津市百世化工有限公司,分析纯);磷酸(沈阳沈一精细化学品有限公司,分析纯);乙腈(天津市康科德科技有限公司,色谱纯);水为超纯水。
2 方法与结果 2.1 当归、川芎的薄层色谱鉴别取本品5粒,研细,加石油醚5 mL超声溶解,滤过,滤液蒸干,残渣加无水乙醇1 mL溶解,作为供试品溶液。另取当归、川芎对照药材各2 g,置具塞烧瓶中,加乙醚25 mL,超声提取20 min,滤过,滤液置水浴上蒸干,残渣加无水乙醇1 mL溶解,作为对照药材溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,分别吸取上述3种溶液各5 μL,分别点于同一以0.5%羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以正己烷-醋酸乙酯(9∶1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同的蓝色荧光斑点;再喷以改良碘化铋钾试液,供试品色谱中,在与对照药材色谱相应位置上,显相同的橙黄色斑点,见图 1。
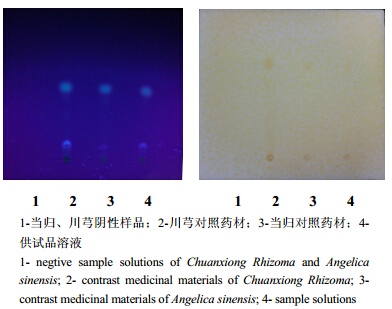 | 图 1 复方川芎滴丸中当归、川芎的薄层色谱鉴别Fig. 1 TLC of Angelica sinensis and Chuanxiong Rhizoma |
1)测定波长的考察 精密称取阿魏酸对照品适量,甲醇溶解,制成1 μg/mL溶液,以甲醇为空白,在紫外可见分光光度计在200~700 nm波长下进行扫描。结果,阿魏酸在321 nm处有较强吸收,参照《中国药典》2010年版一部药材和饮片川芎中阿魏酸的HPLC检测波长为321 nm[5],故选择321 nm为检测波长进行测定。
2)流动相的选择 本实验阿魏酸样品采用4个不同系统的流动相:乙腈-0.1%磷酸(22∶78)[6]、乙腈-1%冰醋酸(30∶70)[5]、甲醇-0.1%磷酸(40∶60)[7]、甲醇-1%冰醋酸(30∶70)进行测定,同时考察各系统不同组成比例的流动相,结果流动相为甲醇-1%醋酸(30∶70)时阿魏酸出峰时间适中,约16 min,分离度好。柱温30 ℃,体积流量1.0 mL/min,理论塔板数按阿魏酸峰计不低于3 000。
3)提取方法的选择 取同一批样品(130522)共4份,各0.170 1 g,分别精密称定,放入50 mL圆底烧瓶中,精密加入70%甲醇50 mL,称质量,其中两份加热回流30 min,另两份超声处理30 min,放冷,用70%甲醇补足减失的质量,摇匀,滤过,即得。在流动相甲醇-1%醋酸(30∶70)色谱条件下测定样品中阿魏酸峰面积,得到超声提取样品中阿魏酸平均质量分数为7.146 5 mg/g,加热回流提取为7.755 5 mg/g。结果显示,回流提取测得样品的阿魏酸质量分数高于超声处理的样品,故将加热回流提取方法定为提取方式。
4)提取时间的选择 取同一批样品(130522),共6份,各0.172 1 g,精密称定,置于圆底烧瓶中,精密加入70%甲醇50 mL,称定质量,分别加热回流15(2份)、30(2份)、45 min(2份),放冷,用70%甲醇补足减失的质量,摇匀,滤过,即得。在流动相甲醇-1%醋酸(30∶70)色谱条件下测定样品中阿魏酸,得到加热回流提取15 min样品中阿魏酸平均质量分数为7.208 9 mg/g,30 min为7.755 5 mg/g,45 min为6.877 1 mg/g。结果显示,提取时间为30 min,均比其他两个时间段阿魏酸质量分数高,故将提取时间定为30 min。
5)提取溶剂的选择 取同一批样品(130522)共6份,各0.170 3 g,精密称定,置于圆底烧瓶中,精密加入50%(2份)、70%(2份)、100%(2份)甲醇各50 mL,称定质量,加热回流30 min,放冷,分别用50%、70%、100%甲醇补足减失的质量,摇匀,滤过,即得。在流动相甲醇-1%醋酸(30∶70)色谱条件下测定阿魏酸,得到50%甲醇提取样品中阿魏酸平均质量分数为7.070 5 mg/g,70%甲醇为7.755 5 mg/g,100%甲醇为6.999 4 mg/g。结果显示,提取溶剂为70%甲醇时,测得的样品中阿魏酸质量分数较高,故选择70%甲醇为提取溶剂。
6)提取溶剂量的选择 取同一批样品(130522)共6份,各0.170 9 g,精密称定,至于圆底烧瓶中,分别加入70%甲醇30(2份)、50(2份)、70 mL(2份),称定质量,加热回流30 min,放冷,用70%甲醇补足减失的质量,摇匀,滤过,即得。在流动相为甲醇-1%醋酸(30∶70)色谱条件下测定样品中阿魏酸峰面积,得到30 mL甲醇提取样品中阿魏酸平均质量分数为5.626 2 mg/g,50 mL为6.164 3 mg/g,70 mL为5.866 8 mg/g。结果显示,提取溶剂用量为30、50、70 mL时阿魏酸质量分数相差不大,50 mL时样品浓度较为适中,故将提取溶剂用量定为50 mL。
7)提取次数的选择 取同一批样品(130522),共6份,各0.170 7 g,精密称定,置于圆底烧瓶中,精密加入70%甲醇50 mL,称定质量,分别加热回流提取1(2份)、2(2份)、3次(2份),放冷,用70%甲醇补足减失的质量,摇匀,滤过,即得。在流动相甲醇-1%醋酸(30∶70)色谱条件下测定样品中阿魏酸峰面积,得到提取1次样品平均质量分数为5.633 9 mg/g,2次为5.521 4 mg/g,3次为5.522 2 mg/g。结果显示,提取次数为1次时,与2次、3次相差不大,故将提取次数定为1次。
2.2.2 对照品溶液的制备精密取阿魏酸对照品2.000 0 mg,加入70%甲醇定容至100 mL,制成0.020 0 mg/mL的对照品溶液,即得。
2.2.3 供试品溶液的制备取3批样品各0.170 4 g,精密称定,至于圆底烧瓶中,精密加入70%甲醇50 mL,称定质量,加热回流30 min,放冷,用70%甲醇补足减失质量,摇匀,滤过,即得。
2.2.4 阴性对照液制备取缺少当归和川芎的处方药,按制备工艺制得样品,再按“2.3”项下供试品溶液的制备方法,制得阴性样品溶液。
2.2.5 方法学考察1)专属性试验 精密吸取对照品溶液、供试品溶液和阴性对照溶液进样20 μL,结果显示供试品中各待测成分色谱峰的分离度均大于1.5,其他杂质峰及空白溶液对待测成分均无干扰,见图 2。
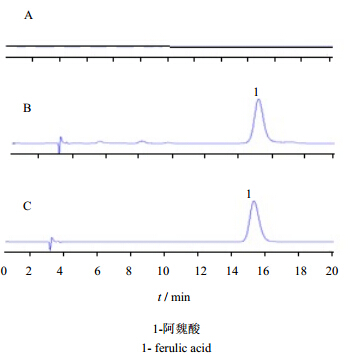 | 图 2 阴性对照品(A)、供试品溶液(B)、对照品品溶液(C)HPLC图谱Fig. 2 HPLC of negative sample (A), Compound Chuanxiong Rhizoma Pills sample (B), and reference substances (C) |
2)不同色谱柱的考察 选用3种不同的色谱柱,即YMC-Pack ODS-A(AA20S11-2546WT,250 mm×4.6 mm,10 μm)、TC-C18(250 mm×4.6 mm,5 μm)、HC-C18(250 mm×4.6 mm,5 μm),按甲醇-1%醋酸(30∶70)色谱条件分析,记录样品中阿魏酸色谱图,结果显示,各色谱柱均分离效果良好,且理论塔板数均大于3 000。
3)线性关系的考察 精密取阿魏酸对照品2.000 0 mg于10 mL量瓶中,加70%甲醇溶解定容至刻度,制成0.200 0 mg/mL对照品溶液,再精密量取适量对照品溶液配成0.001、0.002、0.005、0.010、0.020、0.050、0.100 mg/mL的阿魏酸对照品溶液,分别进样20 μL,按甲醇-1%醋酸色谱条件分析,测定各自峰面积,以对照品质量浓度为横坐标,峰面积值为纵坐标,绘制标准曲线。计算回归方程为Y=8.7×107X+39 031,r=0.999 5。结果表明阿魏酸在0.001~0.1 mg/mL与峰面积呈线性关系。
4)精密度试验 精密吸取同一供试品溶液(130522)20 μL,按甲醇-1%醋酸(30∶70)色谱条件,连续进样6次,记录色谱条件测定的峰面积,计算峰面积值的RSD值为1.50%。
5)重复性试验 精密称取同一批样品(130522)6份,按“2.3”项下方法制备供试品溶液,分别测定各样品中阿魏酸的质量分数。计算样品中阿魏酸平均质量分数的RSD值为1.85%。
6)稳定性试验 取同一批样品(130522)2份,按“2.3”项下方法制备供试品溶液,按甲醇-1%醋酸(30∶70)色谱条件分析,分别在0、2、4、6、8、10、12 h,测定样品中阿魏酸峰面积,计算样品中阿魏酸峰面积值的RSD值为1.95%(n=7),表明阿魏酸在12 h内稳定。
7)加样回收率试验 精密称取同一批样品(130522)0.085 0 g(共6份),分别加入0.200 0 mg/mL阿魏酸对照品溶液各2.43 mL,称定质量,再按照“2.3”供试品溶液制备方法,制成回收率供试品溶液,按甲醇-1%醋酸(30∶70)色谱条件分析,计算回收率,结果平均回收率为102.06%,RSD值为2.25%(n=6)。
2.2.6 样品测定取3批样品,按照“2.3”项下方法制备供试品溶液,按甲醇-1%醋酸(30∶70)色谱条件,采用外标法计算,测定3批样品中阿魏酸的量。结果见表 1。
| 表 1 复方川芎滴丸中阿魏酸的测定结果 (n= 2) Table 1 Determination of ferulic acid in Compound Chuanxiong Rhizoma Pills (n = 2) |
在原部队制剂标准中,当归、川芎的薄层验证中样品取样量为2粒,对照药材取样量为1 g时,浓度太小影响荧光斑点的呈点性,故将取样量改为5粒,对照药材取样量为2 g,斑点呈点清晰。修订后的当归、川芎薄层鉴别方法专属性及重复性良好,故将标准草案中的当归、川芎薄层鉴别方法进行了修订。同时以阿魏酸为对照品,改进了阿魏酸的含量测定方法,首次运用了HPLC法对复方川芎滴丸的阿魏酸进行了定量。
在波长选择中,进行了紫外扫描,确定了阿魏酸在321 nm处有最大吸收,同时参考相关文献,确定本实验中阿魏酸的检测波长为321 nm。根据指标性成分的理化性质和色谱行为,比较了不同流动相、提取方式、提取时间、提取溶剂、提取溶剂用量和提取次数对样品中阿魏酸的影响,以当归和川芎中的阿魏酸为指标,优选了最佳提取制备工艺。结果显示,制备工艺方法简单可靠,具有科学性和可行性。
有关HPLC法测定阿魏酸的方法已有报道[8, 9, 10],但尚未有复方川芎滴丸中阿魏酸定量研究的文献报道。本实验在原有利用薄层色谱法测定阿魏酸的基础上,首次采用HPLC法测定了复方川芎滴丸不同批次样品中阿魏酸的量,结果显示阿魏酸的测定更准确,建立了一种快速测定复方川芎滴丸中阿魏酸的方法,通过线性关系考察,证明线性关系良好、重复性、重现性、稳定性、回收率均符合要求,为制订其质量标准提供了参考,修订后的质量标准,提高了药品的质量控制水平。
| [1] | 柳永青.当归的化学成分与生物活性[J].航空航天医药, 2009, 20(11): 127-128. |
| [2] | 宋秋月, 付迎波, 刘 江, 等.当归的化学成分研究[J].中草药, 2011, 42(10): 1900-1904. |
| [3] | 舒 冰, 周重建, 马迎辉, 等.中药川芎中有效成分的药理作用研究进展[J].中国药理学通报, 2006, 22(9):1043-1047. |
| [4] | 李秋怡, 干国平, 刘焱文.川芎的化学成分及药理研究进展[J].时珍国医国药, 2006, 17(7): 1298-1299. |
| [5] | 中国药典[M].一部.2010. |
| [6] | 王中华.当归中阿魏酸含量测定及质量标准的研究[J].河北中医, 2012, 34(7): 1058-1063. |
| [7] | 丛竹凤.穹芷滴丸的研究[D].济南: 山东中医药大学, 2002. |
| [8] | 莫亚雄, 杜利云.高效液相色谱法测定柏子养心片中阿魏酸的含量[J].云南中医中药杂志, 2011, 32(1):58-59. |
| [9] | 周永其, 胡道德, 刘 亮, 等.灵杞黄斑颗粒中阿魏酸含量测定[J].医药导报, 2012, 31(2): 224-226. |
| [10] | 陈 卉, 陈燕忠, 谢清春, 等.舒胸脉冲控释滴丸中阿魏酸和羟基红花黄色素A的测定[J].中国实验方剂学杂志, 2013, 19(10): 92-94. |
 2014, Vol. 37
2014, Vol. 37


