注射用盐酸头孢替安在国家评价性抽验中检出的不合格项为溶液的澄清度,根据文献报道[1, 2, 3, 4],头孢类抗生素如头孢曲松钠注射用粉针剂,在贮存过程中存在溶液澄清度超标的突出现象,主要与所用胶塞有关,即胶塞与药物之间的相容性存在问题。为了有助于注射用盐酸头孢替安药物溶液澄清度的改善,提高药品质量,从胶塞成分迁移与药物澄清度的关系、影响胶塞成分迁移的因素等方面进行探讨;并对解决部分产品澄清度不合格的问题提出建议及措施。
1 溶液澄清度不合格样品的检验 1.1 抽样与企业留样的比较溶液澄清度不合格的产品为0.25 g规格的盐酸头孢替安,但厂家留样的澄清度检查5支供试品溶液均不深于1号浊度标准比色液,符合规定。
1.2 样品溶液过滤的比较将澄清度不合格的供试品溶液分别用输液器滤器、0.45 μm微孔滤膜过滤,输液器滤器过滤后溶 液的澄清度无改善(输液器滤器对20 μm的粒子滤除率应达80%),说明临床使用时这部分杂质均被输入患者体内,存在安全隐患。0.45 μm微孔滤膜过滤后溶液澄清,表明这部分物质不溶于水,推测为胶塞中极性小的物质扩散并吸附到药品中。
2 浊度值的测定药典附录澄清度检查法为目视法,判别标准较为主观,检验结果易随人员的变化而变化。为准确定量评价各厂家产品的澄清度,取4个厂家4种规格53批次样品,分别用注射用水配制成含头孢替安0.1 g/mL的供试品溶液,采用2100AN Turbidimeter浊度分析仪对4个厂家4种规格53批样品的浊度进行测定。
质量标准规定,澄清度检查限度为不得浓于1号浊度标准液,53批次产品浊度均值1.323 9 NTU,超过1号浊度标准液的值(1.020)。53批次产品中,超出1号浊度标准液浊度值(1.020)的有18批次产品,占总抽验批次的34%,且为0.25 g与0.5 g的小规格产品。厂家一11批次超过1号浊度标准液,占该厂抽验总批次的27.5%。;其中厂家二的8批次产品中,7批次超过1号浊度标准液。见图 1、表 1。
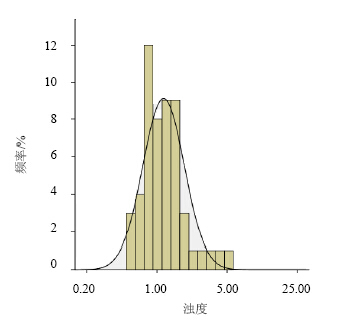 | 图 1 Statistical chart of turbidity value |
| 表 1 浊度值分级统计表 Table 1 Grading results of turbidity value |
53批样品所用包装材料均为钠钙玻璃模制注射剂瓶及药用覆膜丁基橡胶塞,但胶塞的生产企业各不相同,药用丁基胶塞的挥发性成分主要包括饱和烷烃类、环硅氧烷类、抗氧剂如BHT、卤化和未卤化的石蜡、烷基苯等。为考察胶塞中成分迁移量,选择胶塞中抗氧剂BHT作为胶塞中挥发性成分的指征性成分,进行定量测定。
3.1 仪器与试药仪器:岛津LC—20AT高效液相色谱仪。试剂:乙腈为色谱纯,水为纯化水,其余试剂均为分析纯。对照品:BHT,批号01017HG-1,购自中国食品药品检定研究院,质量分数99.5%。样品:4个厂家53批次国家评价性抽验注射用盐酸头孢替安,分为0.25、0.5、1.0、2.0 g 4种规格。
3.2 方法 3.2.1 色谱条件色谱柱为Shim-pack VP ODS柱(150 mm×4.6 mm,5 μm),检测波长203 nm,体积流量1.0 mL/min,进样量20 μL,流动相为乙腈-水(60∶40)。色谱图见图 2。
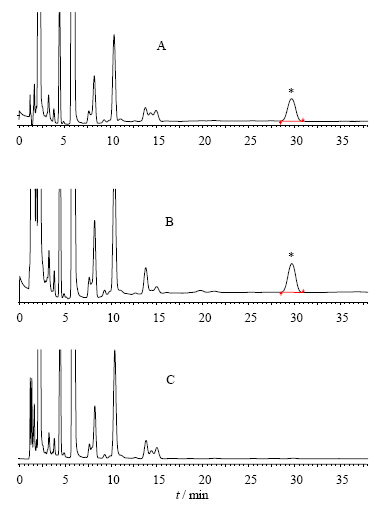 |
图 2 BHT对照品(A)、样品(B)、空白对照(C)高效
液相色谱图 Fig. 2HPLC of BHT standard (A), sample (B), and blank (C) *- 2, 6-二叔丁基对甲酚
*- 2, 6-butylated hydroxytoluene |
精密称取BHT 11.61 mg置于100 mL量瓶中,加丙酮稀释至刻度,摇匀,精密量取1 mL置100 mL量瓶中,稀释至刻度,即得。
3.2.3 供试品溶液的制备每瓶中精密加入5 mL丙酮,充分振摇,应尽量避免与胶塞接触,滤过,即得。
3.3 试验结果对53批产品进行了BHT定量测定,BHT检验结果统计见图 3;按规格统计BHT与浊度检验结果见表 2;不同胶塞生产企业BHT及浊度值比较见 图 4。
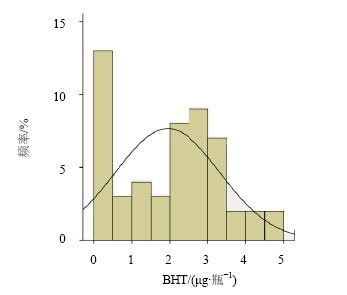 | 图 3 BHT检验结果统计图 Fig. 3Statistical chart of BHT value |
| 表 2 按规格统计BHT与浊度检验结果 Table 2BHT and turbidity average value according to specifications |
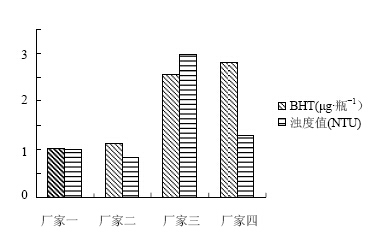 | 图 4 采用不同厂家胶塞药品的BHT含量及浊度值比较图Fig. 4Comparison on BHT and turbidity value of drug with rubber closures from different manufacturers |
(1)利用SPSS统计软件多元线性逐步相关分析表明,浊度值主要受BHT含量和贮存时间的影响(P<0.01),回归方程为:Y(浊度)=0.295+1.47X6(BHT含量)+0.122X3(贮存时间)。说明以BHT为指征性成分来探讨影响澄清度因素可行。
(2)不同胶塞生产企业生产的胶塞BHT迁移量不同,胶塞的质量存在差异,与头孢替安的相容性 存在差异。
(3)按规格分组,浊度值各组间结果均有显著性差异,1 g规格组与2 g规格组有显著性差异,其余各组间差异均有极显著性(P<0.01)。主要因澄清度检验过程中,需加水制成含头孢替安0.1 g/mL的溶液,胶塞迁移性成分以BHT为例,若每瓶注射剂BHT量相同,0.25 g规格产品的BHT浓度是0.5 g规格的2倍,澄清度更易超标。可知,头孢替安规格越小,胶塞对其澄清度影响越大。
4 胶塞相容性试验参照国家食品药品监督管理局国食药监办(2008)765号文《关于进一步加强使用卤化丁基胶塞的头孢类注射剂监督管理的通知》中快速评价头孢曲松钠与药用(卤化)丁基胶塞相容性方法。进行了各厂家产品的胶塞相容性试验。
4.1 方法与结果取每批供试品5支,倒置于烘箱中,于60 ℃恒温放置5 d,取出后放冷,分别加水制成含头孢替安0.1 g/mL的溶液,检查供试溶液的澄清度。结果见表 3。
| 表 3 各厂家产品胶塞相容性试验结果 Table 3Rubber closures compatibility of drugs from different manufacturers |
厂家一0.25 g规格与厂家二0.25、0.5 g规格产品未能通过胶塞相容性试验;各厂家1.0、2.0 g规格产品均通过胶塞相容性试验。不同品牌胶塞的质量存在差异,与头孢替安的相容性存在差异;温度升高及倒置加速了胶塞中成分的迁移,导致供试品水溶液的浊度升高;0.25 g规格的供试品胶塞相容性较差,在检验过程中,为配制成相同浓度的样品,规格较大的样品需要加入较多体积的水溶解稀释样品,对样品中吸附的源于胶塞的成分也是一种稀释,即从检验结果来看,规格大的产品溶液较澄清。
4.2 胶塞相容性试验结论不同品牌胶塞的质量是影响澄清度的主要因素,温度为澄清度的第二影响因素,药品倒置存放亦为影响因素之一;头孢替安规格越小,胶塞对其澄清度影响越大。可以解释同样批号的产品,厂家留样室温度控制25 ℃,且保持正置,而国评抽样在流通领域的保存温度及放置状态均不确定,导致检验结果不一致。
5 建议为解决小规格产品澄清度不合格的问题,应采取针对性措施从而降低胶塞成分迁移,提高药品质量。建议改进胶塞生产工艺以通过与药物的相容性试验;改进包装设计,如采用小口径的玻璃瓶,配内径小的胶塞,减少胶塞与药品接触表面积;改变样品说明书贮藏条件为:密封,在凉暗(避光并不超过20 ℃)干燥处贮存,以降低胶塞中成分的释放,并有利于药物主成分的稳定;通过试验考察注射剂包装瓶内抽真空工艺与胶塞成分迁移量的关系,合理使用该生产工艺。
| [1] | 赵 霞.药用丁基胶塞与头孢曲松钠的相容性研究[D].北京: 中国协和医科大学, 2006. |
| [2] | 赵 霞, 胡昌勤, 金少鸿.药用丁基胶塞中易挥发性成分的成分分析[J].药物分析杂志, 2006, 26(3):315-318. |
| [3] | 赵 霞, 胡昌勤, 金少鸿.对考察药用丁基胶塞与药物相容性的思考与建议[J].中国药事, 2007, 21(10):810-812. |
| [4] | 张 宇.药用丁基胶塞与药物相容性研究现状和展望[J].天津药学, 2010, 22(1): 72-74. |
 2014, Vol. 37
2014, Vol. 37

