2. 浙江大学药物信息学研究所, 浙江 杭州 310058
2. Institute of Pharmaceutical Informatics, Zhejiang University, Hangzhou 310058, China
新药研发的本质是新药发现的转化研究。自从20世纪60年代确定新药临床试验的I/II/III/IV期划分以来,新药研发的技术模式和研究路径基本固化,已经走过近半个世纪历程[1]。这一全球通行的新药 研发模式是一条相互制约的转化研究链,具有周期长、费用高、成功率低等特点。研发能否成功,不仅与医学和药学科技问题有关,还与监管科学向科学监管的转换有关。从新药研发三大因素角度思考上述转化研究:(1)从实验研究过渡到临床研究,主要是动物与人类间的种属差异严重影响到药物安全性和有效性评价的准确性(与医疗应用有关的安全性和有效性如何科学监管);(2)新药产业化研发和产业应用可持续性是影响成药性的重要因素(产业化应用如何科学监管);(3)医药新产品研发及审批过程的科学性和公正性影响成药性以及向患者提供安全有效新药的科学性(研发过程如何科学监管);(4)药品流通和临床应用的科学性(市场和临床用药如何科学监管)。为应对新药研发成功率较低的挑战,美国FDA自2004年以来,连续发布了多个白皮书(图 1)系统地回顾、分析并改进已实行近半个世纪的药品监管策略[2, 3, 4, 5]。
 | 图 1 美国FDA发布的系列白皮书Fig. 1Series of white papers issued by FDA |
监管科学(Regulatory Science)是近年发展形成的前沿学科,受到了美国FDA为首的各国药品监管部门的高度关注。为引起科学界和管理界的重视,美国FDA现任局长Hamburg MA女士于2011年为《Science》杂志撰写社论,系统阐述了推进监管科学的重要性(图 2)[6]。本文简要论述监管科 学的发展、监管科学面临的挑战和机遇、监管科学与科学监管的关系等,并对发展我国监管科学提出建议,供读者、研究者和管理者参考。
 | 图 2 美国FDA局长Hamburg为《Science》撰写的社论 Fig. 2Editorial of regulatory science wrote by Hamburg forScience |
监管科学是一门开发用于评估所监管产品的安全性、有效性、质量及性能的新工具、新标准或新方法的科学。监管科学是一门高度交叉又应用性很强的学科,研究范围和应用领域极其广泛。它涉及利用科学工具、信息收集和分析系统,研究数据、人群、健康系统和社会等领域的科学问题,并贯穿医药产品研发的全过程。监管科学研究中所开发的新工具、新方法和开发过程中所产生的知识,均会推动健康科学相关研究方向的发展。美国FDA在其发布的推进监管科学规划(Advancing Regulatory Science Initiative,ARSI)中,计划通过构建关键路径模式(the Critical Path model),转变医疗产品的开发、评估、制造和应用等过程的监管理念。美国FDA认识到监管科学是科学监管的基础,认为关键路径模式的成败在于能否扩大其应用范围,涵盖医疗产品的开发、评估、制造和应用的全过程。总之,监管科学的进步将使医药产品评估和批准程序更高效,有利于更快将新产品应用于患者、有利于增强产品使用过程的全程监控和产品性能持续提高,最终使患者受益。根据这一认识,美国FDA与NIH等科研机构建立了紧密的合作,开展监管科学研究,以加快医药新产品、新技术和新标准的临床转化。
2 全球医药产品监管科学:过去、现在和未来
医药产品是一类特殊商品,它直接影响到人民的健康。根据《药品管理法》的规定,为确保人民的用药安全和有效,药品在上市前需经过一系列严格的试验和审批。如何一方面加快医药科研成果的产业化过程,缩短药品研究与临床之间的“转化”距离;另一方面又保证医药产品的质量和安全有效,这就迫切需要监管科学的技术支撑。近年来,美国FDA、欧洲药品管理局(EMA)和日本药品及医疗器械管理局(PMDA)等发达国家的药品监管部门高度重视监管科学在生物医药产品转化中的作用。
美国FDA在2010年8月公布的ARS战略规划中明确提出,要从8个主要领域来发展监管科学,对医药产品开发和评价中用到的科学技术进行彻底的现代化改革。这8大领域分别是:(1)毒理学的现代化;(2)推动临床评价和个体化医疗的创新;(3)创造新的方法以改进产品的生产工艺并提高产品质量;(4)确保食品药品监管机构已经为创新技术的评估做好充分准备;(5)借助信息科学利用好各种数据;(6)推行以预防为主的食品安全体系;(7)加快制定医疗对策以抵御各种威胁;(8)进一步发展社会和行为科学以帮助消费者在选择产品时做出知情决策[7]。美国FDA在这份规划中指出,科学的进步正使医药产品的开发和使用方式发生根本性变化,这给监管带来了越来越多的挑战。美国FDA认为,“监管科学可让FDA提前准备好必需的工具和方法,以便可靠地评估那些在新的科学进步下诞生产品的安全性和有效性”。美国FDA表示将与合作方共同开发针对创新产品的新型评价工具和方法[8],并于2013年进一步发布了“推进医药产品监管科学的战略和实施计划”(Strategy and Implementation Plan for Advancing Regulatory Science for Medicinal Products)白皮书(图 3)[9]。
 | 图 3 推进医药产品监管科学的战略和实施计划白皮书 Fig. 3Strategy and implementation plan for advancing regulatory science for medical products |
为推动监管科学的发展,美国FDA自2011年起主办了一系列学术会议[10],并于2011年发起了年度性国际会议——监管科学全球峰会(The Global Summit on Regulatory Science,GSRS)。峰会历年的研讨主题见表 1。在2011年8月召开的首次GSRS峰会上,美国FDA国立毒理学研究中心宣布与阿肯色州合作创建一家监管科学联合研究中心,并于2012年在中国杭州举办的第二届GSRS峰会上将笔者创建的天津市滨海食品药品监管科学研究中心正式列为全球合作机构之一。
| 表 1 历届监管科学全球峰会主题 Table 1 Themes of previous regulatory science global summit |
GSRS峰会试图为全球医药创新产品的监管政策制定者、前沿科学家、转化医学以及生物尖端科技创业者提供一个协同创新平台。每届GSRS会议都邀请多位来自世界主要国家的监管科学家和行政管理部门的专家担任全球监管科学委员会(Global Regulatory Science Board, GRSB)委员。如第二届GSRS会议认为,生物医药界新兴的研究热点问题是如何促进医药创新成果的转化和临床应用,监管科学是推动医药产品创新的重要学科和前瞻科技领域[11, 12]。
3 监管科学的发展和应用面临挑战和机遇
当前世界各国普遍面临诸多公共卫生挑战。美国FDA在其ARS规划中指出,监管科学有助于应对这些挑战,因而也存在以下重大发展机遇[13]。
3.1 加速新药的开发进程
过去半个世纪以来,尽管科技发展迅猛,但医药产品的评估方法改善不大。不少产品因为缺乏高效的评估方法而被延迟批准时间,造成资金和时间的极大浪费。监管科学的进步无疑将提高新药的研发进程。这一领域,监管科学面临的挑战和机遇有:(1)研发更安全的止痛药。为加快新疗法的开发进程,需要研发更好的疼痛模型、测量工具和临床试验设计方法。(2)肺结核疫苗、药物和诊断。(3)更便利的仿制药。仿制药占美国处方药市场份额超过70%,已经成为许多人可承受且不可或缺的治疗方法。如果能克服生物等效性评价方面的困难,更多的仿制药有望入市。(4)制药现代化和产品质量。FDA倡导的“质量源于设计”(QbD)理念,就是将监管科学运用于医药产品制造过程的监管。监管科学的进步将不仅能确保更好的医疗产品质量,同时也能降低开发和制造成本,实现医疗产品的现代制造。
3.2 改善婴幼儿和儿童健康
监管科学有望桥接药物治疗对儿童的影响与面向儿童新疗法开发之间的知识鸿沟。相关的监管科学研究包括:确保儿童用药的安全性;保障食品供应安全,防治食源性疾病;防止儿童和青少年使用烟草;控制肥胖;开展食品及药品中各类毒素的风险评估研究等。
3.3 预防新型传染性疾病及恐怖主义
传染性疾病和恐怖主义袭击已经成为公共安全的新挑战。现有疫苗、诊断和治疗方法的研发方法并不能及时地满足由新型传染性疾病或恐怖主义袭击产生的需求。因此,当市场激励机制缺乏或者不可预测时需要开展监管科学研究,创建新产品的有效监管路径。(1)评估疫苗或治疗方法有效性的新方法:动物模型试验是当前有效性检测的主要方法,但是很多疾病缺乏好的动物模型,技术难点不少,而且受限于动物数量。因此,开发和验证新的有效性评价方法需要监管科学。(2)灵活、快速的产品开发和制造方法:遗传测序可在不使用病原菌的情况下更加快速、安全的生产疫苗、诊断试剂或治疗药物。评估这类有多种应用的技术和产品需要监管科学的进步。(3)微生物污染物的快速检测方法。(4)改善生产稳定性的方法。对于很多药物和疫苗而言,监管科学可以用于延长产品保质期或者避免冷藏,以适应某些紧急状况下的特殊需求。(5)小样本情况下的产品效能统计评估方法。(6)基于细胞或计算的安全性和有效性检验替代方法。(7)基于纳米技术的疾病现场即时诊断方法。(8)新型药物制剂和给药方式。(9)产品疗效的实时评价方法。
3.4 利用信息学加强监管
医药产品监管部门大多拥有海量的临床数据,但利用手段严重滞后。因此,有必要采用健康数据进行安全性实时监测,开展数据挖掘和科学计算等监管科学研究。这不仅有助于提高监管部门对医药产品的审评质量和效率,也为监管部门迈向个体化医疗奠定坚实基础。
3.5 确保食品安全
开发更快速、有效的检测方法,用于检测食品中微生物病原菌,是监管科学的重要关注点。食品药品监管部门必须进行监管科学研究,加强对食源性疾病的认识,据此设计和开发更有效的干预措施,降低风险。相关研究包括:(1)开发采样、检测和分析的有效工具和策略;(2)食品中沙门菌快速检测方法;(3)防范微生物危害;(4)食源性疾病的应对方法;(5)毒素控制方法;(7)食源性病原菌的抗生素耐药性检测方法。
3.6 医疗产品安全性评价方法的现代化
基于动物实验的传统安全性评价方法亟待革新。这一领域的监管科学尤为侧重安全性评价新方法的研发,特别是基于生物标记物的评价技术。例如,将细胞、基因芯片、蛋白质组学和代谢组学数据与动物实验、临床研究整合,开展安全性评价新方法研究。体外实验以及计算机辅助建模方法的研究也很重要。细胞株、遗传工程改造的生物组织模型等方法的开发不仅有助于理解毒物的致毒机制,也有助于研发更高效的毒性评价技术。此外,纳米等新兴技术也对评价方法提出了新需求,需要开展相应的监管科学研究,以便更好地评估、理解和预测这些新型物质的潜在毒性[14, 15, 16, 17]。
美国FDA打算在关键路径计划(Critical Path Initiative)的基础上,通过实施新的监管科学计划(Regulatory Science Initiative, RSI)进一步推进监管科学的发展。RSI计划包括4部分:(1)领导力、协调和战略计划:支持科学和创新;(2)支持FDA使命导向的应用研究;(3)支持建设科技上卓越、组织专业化的学习型组织;(4)招募和留住杰出的科学家。为此,美国FDA在2011财年建立了专门的监管科学办公室来引导监管科学战略发展,并支持了4项监管科学领域的探索性研究。此外,美国FDA监管科学的创新行动还在加快重要医疗器械开发和审批等中得到了应用[11]。
4 监管科学与科学监管的关系
从监管科学到科学监管是一个转换过程,前者解决监管的科学问题,属于基础研究,后者解决监管的执行问题,属于执法应用。换句话说,监管科学是门基础性前沿科学,而科学监管是依法行政。在国内网络上仅有“科学监管”(Scientific Regulation)这一关键词,而未发现有“监管科学”(Regulatory Science)这一关键词。也就是说,我国尚未建立这一前沿学科。不论是监管科学,还是科学监管,都存在为什么要“监管”,为谁“监管”、怎样“监管”的问题。我们应依法行政(科学监管),树立科学监管观念,按照科学发展观的要求指导监管,树立和实践科学监管理念。
如图 4所示,从立法到执法的正转换与逆转换关系可见,在监管科学层面的政策科学研究是一种基础研究。通过药品法律法规、药典、药品审评办法、技术指南、各类GXP的起草、制定、发布和执法部门应用相关文件对医疗产品的全过程施行科学监管是一种正转换过程。而相反,在执法监管过程中执法者及科研工作者发现或提出问题,要求对法规文件进行增补、修改或更新,再归纳出科学问题返回到“政策层面”的监管科学研究中,这一过程是从科学监管到监管科学的逆转换。
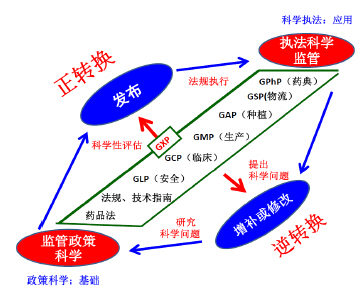 | 图 4 从立法到执法的正转换与逆转换 Fig. 4Positive transformation and inverse transformation from legislation and law enforcement |
一种新的医药产品从发现到开发,即从非临床的活性和安全性研究证实其具有可开发性,再通过临床研究证明新药在医疗上具有疗效和安全性;进而过渡到上市审批和监管,证明其具有成药性所必须的有效性、安全性和质量可控性;最后通过上市后产业化评价和广泛临床再评价,证实产品具有可持续性。这一正转换过程,需要研发先进方法、技术、工具及政策,最后以监管科学研究结果为依据,形成科学监管所需要的法律法规。与其相反,在依法监管中发现监管过程存在的问题,需要应用新方法、新技术、新工具,提出完善监管法律法规的科学问题(图 5)。
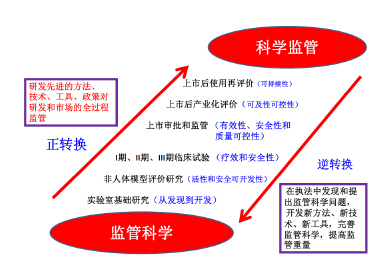 | 图 5 新医药产品研发全过程中“监管科学”与“科学监管” 的转换关系 Fig. 5PConversion between regulatory science and scientific regulation in whole research and development process of new pharmaceutical products |
因此,怎样“监管”?除树立和实践科学监管理念,不断开拓监管思路,建立科学监管的长效机制,提高科学监管效能,使之制度化、规范化、科学化,还必须以监管科学研究结果为依据。由于我 国监管科学发展滞后,说到和做到制度化、规范化、科学化监管,还有许多工作值得政府管理部门予以重视。
5 发展我国监管科学的建议
5.1 必须认识监管科学是科学监管的基础
医药产品竞争的关键是产品品质竞争,监管科学发挥的作用毋庸置疑。成功开发一个药物进入市场是一个漫长的过程。与发达国家专家交流经验、分享知识,可以推进我国医药新产品研究发展,促进药物研究健康、快速发展,进一步确保临床安全性。随着我国经济发展从解决温饱向提高生活质量、从解决缺医少药向保障良医良药过渡,对健康产品,包括药品、医疗器械、生物制品、食品及保健品的重视也在加强。健康产品与其他商品的最大不同在于其有效性、安全性及质量可靠性能直接影响人体健康甚至生命。因此,医药健康产品的研发、上市、生产及退市都受到政府严格监管,而监管科学才是行政管理部门执行科学监管的基础。
为了推动药品监管科学起步,提高监管科学水平,国家食品药品监督管理总局科技与标准司于2013年9月25日在京召开一次药品监管科学研究理想会议,与会科学家和管理人员以监管科学研究的重点方向、提高产品质量有关的关键科学技术问题,特别在化学药品安全监管科学研究立项问题展开了讨论。笔者在会上介绍监管科学国际发展动态和几次监管科学全球峰会的情况。
天津滨海食品药品监督管理局十分重视这一新兴学科的发展,由滨海新区食品药品监管局与天津药物研究院合作建立国内第一个监管科学研究中心。天津滨海食品药品监管科学研究中心(Tianjin Binhai Center for Food and Drug Regulatory Science)综合利用现代科学、技术、方法、标准,针对评估食品药品的安全性、有效性、质量可控性要求共同筹建。该研究中心是目前国内首家针对食品药品监管科学、监管技术创新等方面的研究机构,将针对食品、药物监管问题开展技术攻关与国际交流,其中包括药品监管科技的新技术、新方法的跟踪与新技术转化研究;食品安全性评价的新技术、新方法的跟踪与新技术转化研究;食品、药品相关的公众安全事件的技术立项与技术支撑研究等。受滨海新区食品药品监管局委托,该研究中心还将进行食品、药物监管科学的评价技术规范化研究。在新药审评技术服务方面,该研究中心将对新区药企新药技术审评、报批等相关技术提供咨询服务。同时将对新区药企的药物品种、新技术提供新药评价技术服务,包括创新药物、制剂的安全性评价研究、有效性评价研究、体内过程评价研究和样品检测服务以及针对上市品种的安全性深入评价、有效性深入评价等。该中心现为美国FDA倡导的全球监管科学研究合作单位之一,必将作为“窗口”促进全国乃至亚太地区食品药品科学监管能力水平的飞跃。
5.2 我国食品药品监督管理总局(CFDA)应该制定和实施监管科学计划
根据美国FDA推进全球监管科学发展的态势,我国应尽早启动监管科学计划(Regulatory Science Initiative),努力推进我国监管科学的创立和发展,抢占医药创新科技制高点。在领导、组织、协调和战略方面制定计划,组织监管科学研究立项,支持监管科学研究向应用研究转换,为科学监管提供科学依据。在现阶段,国内对监管科学十分生疏,开展监管科学的科普活动也很有必要。不发展监管科学很难达到科学监管和科学执法的目的。
参照美国FDA在2010年公布的战略计划,结合我国国情,现阶段有必要选择几个方向开展监管科学研究,并为创新技术用于食品药品科学监管做好充分准备。笔者认为两个问题值得重视:(1)加强毒理学的现代方法、早期评价科学研究和新药审评科学研究;(2)推动临床评价科学发展,提高新药临床试验水平。研究个体化医疗技术,创新发展药物临床安全性和有效性评价方法。
在创新医药产品审评办法研究方面上,支持监管科学领域如下探索研究:(1)转变产品研发过程和新医疗产品中,应用科研成果从试验向临床患者的转化,研究现代毒理学方法、有效性创新评价、个性化医药的生物标记物、干细胞计划和最新的药物审查标准;(2)在监管的医疗产品中应用新兴技术,如纳米技术规范和生物技术新产品的技术规范(如生物相似药的评价);(3)发展信息科学服务于医疗健康结果分析,如医疗设备登记系统和用于科学计算的数据分析;(4)为满足公共安全需要,提高国内重大疾病和孤儿药物创新研发的关注程度,研究高端给药系统的评审方法。
5.3 重视科学研究成果转化,提高科学监管的效力
转化医学不仅注重于技术创新,更强调如何把新理念和新技术转化为提高临床诊治水平的实用技术和解决方案。由于各国医药监管体系存在临床应用审批中既严格又十分僵化等问题,监管政策明显滞后于医药科技创新步伐,故政府监管政策壁垒是转化医学发展的主要瓶颈,也是阻碍医药创新成果转化为临床应用的主要因素之一[18]。
2013年美国FDA发表了关于医药创新产品监管政策的白皮书,提出大力发展监管科学,促进医药创新成果的转化和临床应用,进而推动医药产品创新研究[9]。由于任何医药创新产品的临床应用均受到监管政策的调控,制订科学合理的监管法规是保障转化医学成功的关键,这就急需围绕转化医学研究建立相应的监管科学[18]。因此,有必要分析我国有碍创新生物医药发展的现状和问题,改善新药以及临床应用新技术的现行临床前和临床评价过程,调整僵化的评价规则,从监管科学的角度,应用先进的现代科学、技术、工具和方法,加快医药新产品、新技术和新标准的临床转化和产业转化。但是,由于我国目前尚未开展监管科学研究,对转化医学研究与科学监管关系的重要性认识不足,更谈不上监管科学用于指导我国转化医学或转化研究中心的转化研究。也就是说,国家监管法规的制订严重滞后于转化医学的实际需求,阻碍医药技术创新和成果转化。据此笔者认为,我国必须加快监管科学的学科建设,推动转化医学研究与监管科学协同发展,促进医药创新成果临床应用。
| [1] | Hafkenschiel J H.Government regulations and the use ofdrugs[J].Calif Med, 1967, 107(2):159-163. |
| [2] | FDA.Challenge and opportunity on the critical path tonew medical products[M].Washington: FDA, 2004. |
| [3] | FDA.Critical path opportunities List[M].Washington:FDA, 2006. |
| [4] | FDA.Critical path opportunities report[M].Washington:FDA, 2006. |
| [5] | FDA.Critical path opportunities for generic drugs[M].Washington: FDA, 2007. |
| [6] | Hamburg M A.Advancing regulatory science[J].Science, 2011, 331(6020): 987. |
| [7] | FDA.Regulatory science plan would create new office inFDA[M].Washington: FDA, 2010. |
| [8] | FDA.CDRH's innovation pathway:a quicker route forbreakthrough devices?[M].Washington: FDA, 2011. |
| [9] | FDA.Strategy and implementation plan for advancingregulatory science for medical products[M].Washington:FDA, 2013. |
| [10] | FDA.Computer modeling for medical devices[M].Washington: FDA, 2011. |
| [11] | Margaret A.Miller M A, Weida Tong W D, et al.2012Global summit on regulatory science (GSRS-2012)—Modernizing Toxicology[J].Toxicological Sciences.2013, 131(1): 9-12. |
| [12] | Slikker W, Miller M A, Lou Valdez M, et al.Advancingglobal health through regulatory science research:Summary of the global summit on regulatory scienceresearch and innovation[J].Regul Toxicol Pharmacol, 2012, 62:471-473. |
| [13] | FDA.Advancing regulatory science for public health[EB/OL].(2010-10-06)[2014-09-03]. |
| [14] | FDA.Advancing regulatory science at FDA 2011[EB/OL].(2011-08)[2014-09-03]. |
| [15] | FDA.Advancing regulatory science.moving regulatoryscience into the 21st century[EB/OL].(2010-10-06)[2014-09-03]. |
| [16] | FDA.Strategic plan for regulatory science[EB/OL].(2010-10-06)[2014-09-03]. |
| [17] | FDA.CDRH's innovation pathway: a quicker route forbreakthrough devices?[M].Washington: FDA, 2011. |
| [18] | 范骁辉, 王书芳, 程翼宇.转化医学与监管科学的协同研究[A].戴尅戎.转化医学理念、策略与实践[M].西安: 第四军医大学出版社, 2012. |
 2014, Vol. 37
2014, Vol. 37

