膜性肾小球肾炎临床上以大量蛋白尿或肾病综合征为主要表现,病理上以肾小球毛细血管基底膜均匀一致增厚,有弥漫性上皮下免疫复合物沉积为特点,不伴有明显细胞增生。本病发病率较高,占原发性肾小球疾病的9.9%~13.5%[1]。除其中部分能自发缓解,其余患者表现为病程长,病情易于反复,对免疫抑制剂、糖皮质激素及细胞毒性药物反应差,可发展为终末期肾衰[2, 3]。固肾1号由黄芪、丹参等药物组成,具有补脾肾、活血瘀、利湿浊等功效,临床用于治疗气虚血瘀所致的水肿,症见浮肿、腰痛、乏力,慢性肾炎见上述证候者。本文考察固肾1号对膜性肾小球肾炎的治疗作用。
1 材料与仪器 1.1 药品与试剂固肾1号:棕色粉末,批号120207,每克粉末相当于3.16 g生药,由天津药物研究院中药现代研究室提供。肾炎康复片:天津同仁堂集团股份有限公司生产,批号B89134。醋酸地塞米松片:天津力生制药股份有限公司,批号1201001。弗氏完全佐剂:博美科生产,批号61185028。阳离子化牛血清白蛋白(C-BSA)制备:参照文献[4]方法制备,沉淀法测得等电点为8.4,−20 ℃保存备用。
1.2 动物Wistar种大鼠:SPF级,北京维通利华实验动物科技有限公司提供,许可证编号SCXK(京)2011-0011。大耳白种家兔:SPF级,北京维通利华实验动物科技有限公司提供,许可证编号SCXK(京)2012-0001。
1.3 仪器TU—1810型紫外可见分光光度计,北京普析通用仪器有限责任公司。Vitalab Selectra2型全自动生化仪,荷兰威图公司。显微镜Olympus公司。
2 方法 2.1 对家兔C-BSA肾炎的影响选用雄性大耳白种家兔70只,体质量2~2.5 kg,测定24 h尿蛋白定量,淘汰尿蛋白偏高的家兔后,选用9只家兔作为正常组,其余均耳iv C-BSA 10 mg/只进行造模,每天1次,连续5周,第6周剂量加倍,造模结束后,检测24 h尿蛋白定量和血清生化指标。选用24 h尿蛋白定量大于100 mg的家兔,随机分为模型组,固肾1号1.10、2.19、4.38 g生药/kg剂量组,醋酸地塞米松0.05 mg/kg剂量组,肾炎康复片0.672 g药粉/kg剂量组,每组9只,加上正常组,共7组,开始ig给药,每天1次,连续5周,给药量为3 mL/kg,正常及模型组给予等容量0.5% CMC-Na。每周测定24 h尿蛋白定量;实验结束取血测定血清尿素氮(BUN)、肌酐(Cr)、血清总蛋白(Tp)、白蛋白(Alb)、总胆固醇(TC)、三酰甘油(TG);取肾脏称质量,以1 kg体质量的肾质量计算肾脏脏器系数;用10%福尔马林固定,石蜡包埋,HE染色,光镜检查肾脏病变,并用IDA2000图象分析系统随机测量肾小球等效直径、周长、面积,计数肾小球内细胞数。
2.2 对大鼠主动型Heymann肾炎的影响选用Wistar种大鼠116只,雌雄兼用,体质量170~200 g,除雌雄各5只大鼠做正常组外,其余大鼠均ip同种免疫复合物进行造模,两周1次,每次2 mL,直至出现蛋白尿,表明造模成功。将造模成功的大鼠按24 h尿蛋白定量,随机分为模型组,固肾1号2.12、4.23、8.46 g生药/kg剂量组,醋酸地塞米松0.067 5 mg/kg剂量组,肾炎康复片1.296 g药粉/kg剂量组,每组12只,加上对照组,共7组。ig给药,每天1次,连续6周,给药量为10 mL/kg,对照及模型组给予等容量0.5% CMC-Na。每周测定24 h尿蛋白定量,实验结束取血测定血清BUN、Cr、TP、Alb、TC、TG;取肾脏称量,以100 g体质量的肾质量计算肾脏脏器系数;肾脏用10%福尔马林固定,石蜡包埋,HE染色,光镜检查其病变,并用IDA2000图象分析系统随机测量肾小球等效直径、周长、面积,计数肾小球内细胞数。
3 统计实验数据以x±s表示,结果采用Excel 2010进行t检验统计。
4 结果 4.1 对家兔C-BSA肾炎的影响 4.1.1 24 h尿蛋白定量与对照组比较,给药后5周,模型组家兔24 h尿蛋白定量明显升高,表明模型成功。与模型组比较,固肾1号4.38 g/kg剂量组给药2~5周、2.19 g/kg剂量组给药3~4周,明显降低24 h尿蛋白定量,工具药醋酸地塞米松0.05 mg/kg剂量组给药2~5周及阳性药肾炎康复片给药2~4周亦有明显作用。见表 1。
| 表 1 固肾1号对家兔C-BSA肾炎24 h尿蛋白定量的影响 (x±s,n=9) Table 1 Effectof Gushen 1 on 24 h urine protein in C-BSA nephritis of rabbits (x±s,n=9) |
给药前,与对照组比较,各剂量组的BUN、Cr、CHO、TG明显升高,ALB明显下降,显示已形成慢性肾炎模型。给药5周,与模型组比较,固肾1号1.10、2.19、4.38 g生药/kg剂量组均明显升高血清ALB,2.19、4.38 g生药/kg剂量组明显降低血清Cr,显示对肾功能有明显改善作用。醋酸地塞米松0.05 mg/kg剂量组有明显作用,肾炎康复片无明显改善作用。见表 2。
| 表 2 固肾1号对家兔C-BSA肾炎血清生化的影响 (x±s,n=9) Table 2 Effectof Gushen 1 on blood biochemistry in in C-BSA nephritis of rabbits (x±s,n=9) |
与对照组比较,模型组的肾脏系数明显增大,显示肾脏病变明显;与模型组比较,固肾1号1.10、2.19、4.38 g生药/kg剂量组明显减小肾脏系数,显示对肾脏病变有明显改善作用。肾炎康复片有明显作用。见表 3。
| 表 3 固肾1号对家兔C-BSA肾炎肾脏系数的影响 (x±s) Table 3 Effectof Gushen 1 on kidney indexes in in C-BSA nephritis of rabbits (x±s) |
与对照组比较,模型组肾小球等效直径明显增大、细胞数明显增多,显示肾小球病变明显。与模型组比较,固肾1号4.38、2.19 g生药/kg剂量组明显减小肾小球等效直径,减少细胞数;1.10 g生药/kg剂量组明显减小肾小球等效直径,显示对肾小球病变有明显改善作用,醋酸地塞米松与肾炎康复片也有明显改善作用。见表 4。
| 表 4 固肾1号对家兔C-BSA肾炎肾脏病理的影响 (x±s) Table 4 Effect of Gushen 1 on kidney pathology in in C-BSA nephritis of rabbits (x±s) |
对照组各肾组织形态未见显著性改变。模型组各肾病变明显,肾小球体积普遍增大、肾小球内细胞数增多,部分肾小球毛细血管扩张,基底膜增厚,肾小球囊扩大,肾小管扩张,肾小管均见轻重不等的蛋白管型,肾间质弥漫炎细胞浸润。肾炎康复片、地塞米松组与模型组比较,肾病变减轻,肾小球体积有所缩小,细胞数亦减少,偶见肾小管扩张或管型,肾间质灶性炎细胞浸润。固肾1号2.19、4.38 g生药/kg剂量组肾病变减轻明显,肾小球体积缩小,细胞数减少,基底膜增厚不明显,肾小管及间质无明显病变。见图 1。
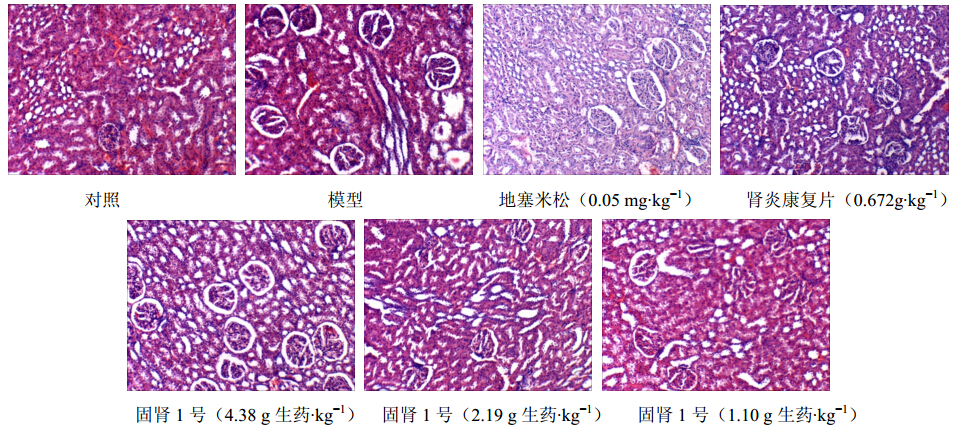 | 图 1 固肾1号对家兔C-BSA肾炎肾脏病理的影响Fig. 1 Effect of Gushen 1 on kidney pathology in C-BSA nephritis of rabbits |
与对照组比较,给药6周,模型组大鼠24 h尿蛋白定量明显升高,表明造模成功;与模型组比较,固肾1号4.23、8.46 g/kg剂量组给药4~6周、2.115 g/kg剂量组给药6周,明显降低24 h尿蛋白定量,工具药醋酸地塞米松0.067 5 mg/kg剂量组给药4~6周亦有明显作用,阳性药肾炎康复片仅有降低的趋势。
4.2.2 血清生化指标给药前,与对照组比较,各剂量组的BUN、TC、TG明显升高,显示已造成慢性肾炎模型,各剂量组与模型组比较,各项生化指标均无明显差异。给药6周后,与模型组比较,固肾1号4.23、8.46 g/kg剂量组明显升高TP,降低BUN,显示对肾功能有明显改善作用。醋酸地塞米松0.067 5 mg/kg剂量组也有明显作用,肾炎康复片仅降低BUN,对TP无明显升高作用。见表 6。
| 表 5 固肾1号对大鼠Heymann肾炎24 h尿蛋白定量的影响 (x±s,n=12) Table 5 Effect of Gushen 1 on 24 h urine protein in Heymann nephritis of rats (x±s,n=12) |
| 表 6 固肾1号对大鼠Heymann肾炎血清生化的影响 (x±s, n=12) Table 6 Effect of Gushen 1 on blood biochemistry in Heymann nephritis of rats (x±s, n=12) |
与对照组比较,模型组的肾脏系数明显增大,肾脏病变明显。与模型组比较,固肾1号4.23、8.46 g生药/kg剂量组明显减小肾脏系数,显示对肾脏病变有改善作用。醋酸地塞米松与肾炎康复片均有明显作用。见表 7。
| 表 7 固肾1号对大鼠Heymann肾炎肾脏系数的影响 (x±s) Table 7 Effect of Gushen 1 on kidney indexes in Heymann nephritis of rats (x±s) |
与对照组比较,模型组肾小球周长、面积明显增大、细胞数明显增多,显示肾小球病变明显。与模型组比较,固肾1号8.46 g生药/kg剂量组明显减小肾小球周长、面积,减少细胞数,固肾1号4.23 g生药/kg剂量组明显减小肾小球面积,显示对肾小球病变有明显改善作用,肾炎康复片只明显减少细胞数,对肾小球周长、面积均无明显作用,醋酸地塞米松无明显作用。见表 8。
| 表 8 固肾1号对大鼠Heymann肾炎肾脏病理的影响 (x±s) Table 8 Effect of Gushen 1 on kidney pathology in Heymann nephritis of rats (x±s) |
对照组各肾组织形态未见显著变化。模型组各肾病变明显,肾小球体积普遍增大、肾小球内细胞数增多,部分肾小球毛细血管扩张,基底膜增厚,肾小管均见轻重不等的蛋白管型,肾间质有炎细胞浸润。肾炎康复片、地塞米松组与模型组比较,肾病变有减轻的趋势,部分肾小球体积缩小,细胞数减少,以肾炎康复片组较明显,但各组均能见到肾小管管型,部分肾小球毛细血管扩张以及基底膜增厚。固肾1号8.46 g生药/kg剂量组与模型组比较,肾病变减轻明显,肾小球体积缩小,细胞数减少,固肾1号4.23 g生药/kg剂量组与模型组比较,肾病变有不同程度减轻,肾小球体积缩小,细胞数有减少的趋势,2.12 g生药/kg剂量组与模型组比较有减轻趋势,病理形态大致与模型组相似。见图 2。
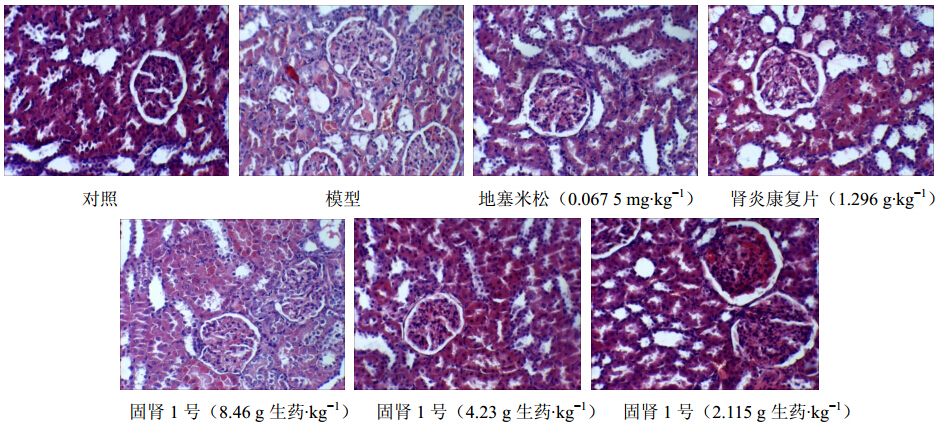 | 图 2 固肾1号对大鼠Heymann肾炎肾脏病理的影响Fig. 2 Effect of Gushen 1 on kidney pathology in Heymann nephritis of rats |
膜性肾病的发病机制主要是循环免疫复合物和原位免疫复合物(IC)在肾小球基底膜的沉积[5]。阳离子化牛血清白蛋白致家兔肾炎模型和Heymann肾炎模型是两种比较公认的膜性肾炎实验模型。
在阳离子化牛血清白蛋白致家兔肾炎的模型中,由于肾小球基底膜阴离子电荷的存在,用带正电荷的C-BSA与肾小球基底膜上负电荷结合,而机体产生的抗体与结合在肾小球基底膜上的抗原结 合[6],抗原的电荷属性对IC在肾小球上皮细胞下的沉积起到了决定性的作用[7]。将BSA阳离子化,使其等电点升高,不但改变了抗原的性质,而且改变了抗原抗体的反应,使抗体具有低亲和性和较低的沉淀能力,从而形成低分子的免疫复合物,更易沉积在肾小球基底膜。并且,给予大量的抗原(C-BSA),能加快IC的沉积速度[5]。
Heymann肾炎模型分为主动型和被动型两种,主动型Heymann肾炎是利用近端肾小管刷状缘成分免疫大鼠,而被动Heymann肾炎是直接给大鼠注射抗刷状缘抗体[8],由于肾小球上皮细胞被膜小凹处存在与肾小管刷状缘间共同的抗原,肾小管刷状缘抗体与肾小球上皮足突细胞表面的Megalin/gp 330及受体相关蛋白(RAP)结合,继而激活补体,形成膜攻击复合物损伤上皮,导致免疫复合物在肾小球上皮下的沉积[9]。而尿蛋白的形成与基底膜的电荷屏障无关,主要是足突细胞电荷密度改变导致尿蛋白产生[10]。
本实验中两种模型的肾小球均出现基底膜增厚,肾小球体积增大,病变明显,表明造模成功。固肾1号能显著改善肾功能,减轻肾小球病变,表明对膜性肾炎有良好的防治作用,其作用机制有待以后进一步研究。
| [1] | 丁小强, 刘春凤. 特发性膜性肾病研究进展 [J]. 中国实用内科杂志, 2011, 31(2): 108-109. |
| [2] | 赵 洁, 杨 洁, 孙脊峰. 特发性膜性肾病-KDIGO临床实践指南解读 [J]. 临床肾脏病杂志, 2013, 13(3): 103-106. |
| [3] | 朱 立, 赵玉庸, 陈志强. 中医药治疗膜性肾病的实验研究进展 [J]. 中国中西医结合肾病杂志, 2003, 4(1): 61. |
| [4] | 章友康, 杜学海. 用阳离子化牛血清白蛋白制作原位免疫复合物型肾炎模型 [J]. 中华肾病杂志, 1985, 1(1): 7-9. |
| [5] | Koyama A, Inage H, Kobayashi M, et al. Effect of chemical cationization of antigen on glomerular localization of immune complexes in active models of serum sickness nephritis in rabbits [J]. Immunology, 1986, 58: 529-534. |
| [6] | Border W A, Ward H J, Kamil E S, et al. Induuction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen [J]. J Clin Invest, 1982, 69(2): 451-461. |
| [7] | Couser W G, Salant D J. In situ immune complex formation and glomerular injury [J]. Kidney Int, 1980, 17(1): 1-13. |
| [8] | 陈玔炜, 唐德燊, 刘华锋. Heymann肾炎发病机制的研究现状 [J]. 广东医学院学报, 2008, 26(2): 205-208. |
| [9] | 王迎伟, 张建民. Heymann肾炎发病机制的实验研究 [J]. 中国免疫学杂志, 1993, 9(6): 368-369. |
| [10] | Shimoi A, Hatakeyama H, Miyoshi S, et al. Unchanged distribution density of anionic sites on the glomerular wall in rats with active Heymann Nephritis [J]. J Toxicol Pathol, 2013, 26: 11-17. |
 2014, Vol. 37
2014, Vol. 37

