众所周知,人类80%以上脑卒中是由血栓栓塞所致,且多数为大脑中动脉栓塞[1]。为探索脑梗死的发病机制以及安全有效的防治药物,建立可靠、重复性高的脑缺血实验动物模型是研究的前提和重要手段。本实验参考国外文献[2],经过研究改进后,通过经颈外动脉向颈内动脉注入自体血栓和凝血酶栓塞大鼠大脑中动脉的方法,建立了一种稳定、实用的局灶性脑梗死模型并用其评价重组葡激酶(rSak)对该模型的改善作用,为研究开发脑梗死药物提供依据。
1 材料 1.1 药品试剂rSak,商品名施爱克,比活250 000 AU/5 mg/支,批号20120601,通化玉金药业股份有限公司生产;牛凝血酶,500 U/支,中国医学科学院血研所科技公司提供;红四氮唑(TTC),批号20100601,天津市光复精细化工研究所提供。
1.2 动物实验使用SPF级SD大鼠,北京维通利华实验动物技术有限公司提供,动物合格证号SCXK(京)2012-0001。
1.3 仪器病理图像采集与分析系统v4.0软件,北京航空航天大学图象中心产品。MP—150多导生物信号采集系统,美国BIOPAC Systems Inc产品。日本UT—03小鼠胆管插管,内径0.18 mm,外径0.3 mm。
1.4 模型制备方法雄性SD大鼠,体质量280~320 g,动物禁食一夜,自由饮水。实验当天大鼠经12%水合氯醛(360 mg/kg)麻醉,仰卧位固定。参考Zhang等[2]的报道,模型制备方法如下:切开颅骨顶部皮肤暴露颅骨,于右脑前囟后方1.0 mm、外侧5.5 mm处用微电动钻钻开约2 mm直径孔,用一大小约0.5 cm×0.5 cm的薄膜贴于颅骨上。将大鼠俯卧位固定于立体定位仪上,探针置于打孔处距硬脑膜表面上方0.5 mm监测血流基础值。然后取下大鼠仰卧位固定,分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。5~0丝线结扎远端ECA,动脉夹暂时夹闭CCA、ICA。将充满牛α-凝血酶(2.5 U/μL)的日本小鼠胆管插管(内径0.3 mm)接到100 μL 注射器上,从ECA插入ICA内距MCA起始处2~3 mm。管内吸入10 μL动脉血保持10 min形成血凝块,然后将伴有50 U α-凝血酶的血凝块注入ICA形成大脑中动脉血栓。在注射后10 min去除CCA动脉夹,局部滴加青霉素防止感染,逐层缝合。俯卧位固定于立体定位仪上,监测注射凝血酶后、给药后120 min时血流量值。注射凝血酶后30 min血流量较基础值下降30%即为造型成功[3]。
实验设为3组,每组12只,即假手术组(仅分离动脉)、模型组(注入10 μL自体血栓和50 U凝血酶)、给药组。给药组在模型形成后用其进行rSak处理实验,剂量为150 kU/kg。采用微量输液泵恒速尾静脉输注的给药方式给药,连续输注时间为10 min,给药体积为1 mL/kg,生理盐水稀释至2 mL。
1.5 脑血流量监测用MP—150多导生物信号采集系统监测并用Acqknowledge v.3.5.7软件测量注射凝血酶前后、给药后120 min时血流量值。
1.6 神经功能评分于给药后24 h采用盲法对动物进行行为障碍评分,用于评价神经功能损害程度,总分为16分,分数越高,表明动物神经功能损害程度越严重。评分标准见表 1。
| 表 1 MCAO大鼠神经功能损害程度评分标准 Table 1 Assessment criteria of neurologic damage of MCAOrats |
6只大鼠术后24 h断头用生理盐水冲洗后,取全脑,迅速冰冻,沿冠状面切成2 mm厚的切片,放入2% TTC染液中,避光37 ℃温孵5 min进行染色后,采用COOLPIX955数码相机(日本尼康公司产品)成像系统将数字影像存储于计算机中,用病理图像采集与分析系统v4.0软件测量梗死区面积,计算脑梗死率。
1.8 脑组织病理学检查6只大鼠全脑用生理盐水冲洗后,置4%甲醛固定。取梗死侧大脑以冠状位切取组织,进行石蜡包埋,制作石蜡切片,切片厚度5 μm,常规HE染色,显微镜进行病理观查。
1.9 统计学处理 数据均表示为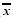 ±s,采用SPSS15.0进行统计学处理,多组间采用单因素方差分析。
±s,采用SPSS15.0进行统计学处理,多组间采用单因素方差分析。
各组数据用基础值为100%进行标化,以排除误差观察药物对脑梗死治疗的真实有效性。假手术组在整个实验过程中流量较为稳定,模型组注入凝血酶造成脑梗死后,脑血流量下降并随时间延长进一步降低,120 min时较假手术组同期最大下降33.7%(P<0.05)。静脉给予rSak 150 kU/kg后流量有增加趋势,与模型组同期比较,120 min增加28.5%(P<0.05)。结果见表 2。
表 2 各组脑梗死大鼠脑血流量及rSak的作用(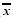 ±s ,n=12)
Table 2 Cerebral blood flow of cerebral infarction rats in each group and effect of rSak( ±s ,n=12)
Table 2 Cerebral blood flow of cerebral infarction rats in each group and effect of rSak(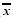 ±s ,n=12) ±s ,n=12) |
模型组大鼠出现明显神经功能受损症状,静脉给予rSak 150 kU/kg能改善受损的神经功能,与模型组同期比较,24 h时降低23.4%(P<0.05)。见表 3。
表 3 各组脑梗死大鼠神经功能损害程度及rSak的作用(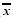 ±s ,n=12)
Table 3 Neurological damage degree of cerebral infarction rats in each group and effect of rSak( ±s ,n=12)
Table 3 Neurological damage degree of cerebral infarction rats in each group and effect of rSak( ±s ,n=12) ±s ,n=12) |
模型组出现了明显的脑梗死,静脉给予rSak 150 kU/kg能缩小脑梗死范围,与模型组同期比较,24 h时降低41.7%(P<0.05)。结果见表 4、图 1。
| 表 4 各组大鼠脑梗死范围及rSak的作用 Table 4 Area of cerebral infarction rats in each group and effect of rSak |
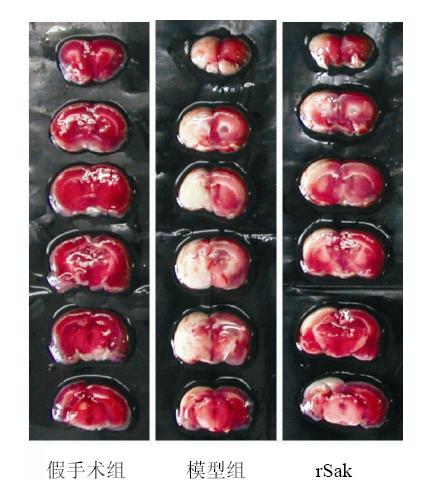 | 图 1 各组脑梗死大鼠脑梗死范围及rSak的作用Fig. 1 Area of cerebral infarction rats in each group and effect of rSak |
假手术组皮层细胞层次及结构正常,核仁清楚,间质无水肿。模型组神经细胞肿胀、排列紊乱、间质疏松,胞浆空泡化、呈嗜伊红,核固缩深染。给予rSak 150 kU/kg可抑制神经细胞损伤,使这种病理改变减轻,正常形态细胞增多,变性坏死细胞减少,细胞周围间隙明显缩小,胞浆红染减轻。结果见图 2。
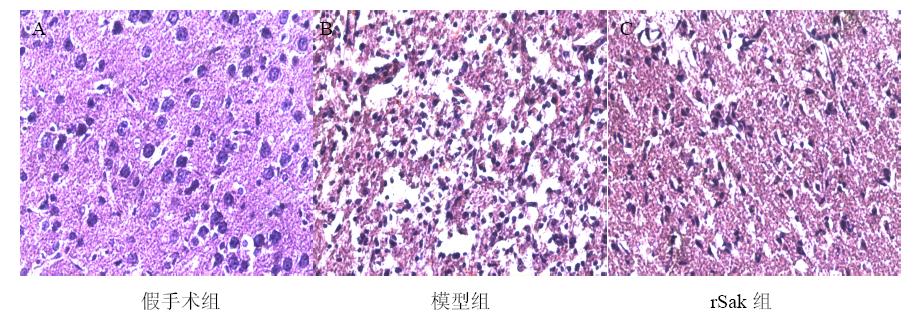 | 图 2 各组脑梗死大鼠脑病理学及rSak的作用Fig. 2 Brain Pathology of cerebral infarction rats in each group and effect of rSak |
脑缺血性疾病是危害人类健康最重要的疾病之一,给家庭和社会带来重大负担[4]。近年来,抗脑血栓药物已成为当前研究的热点。为客观评价药物的溶栓疗效,建立量化好、高灵敏度的可靠模型和方法具有重要意义。目前脑缺血动物模型的建模技术有内栓子栓塞阻断法、管腔内丝线MCAO法、光敏血栓形成法等。丝线法在制备模型和溶栓评价等环节中存在定量准确性欠佳、灵敏度较差等不足之处;光化学法需向动物体内注入光化学诱导剂,栓塞部位在皮层、呈弥漫性,且诱导剂对生化指标的检测有一定干扰[5]。而血栓栓塞性卒中模型比其他脑缺血模型更接近人类卒中,大多数的人类卒中是血栓栓塞引起的。根据国外文献报道[2],由颈外动脉经颈内动脉向大脑中动脉起始处2~3 mm处注入10 μL自体血栓和30 U凝血酶时,出现脑血流量下降、脑神经功能受损伤等脑梗死症状,为最佳模型;注入10 μL自体血栓和80 U凝血酶时,除脑以外的肺和肾中也出现了血栓,出现了明显的副作用。本实验经过摸索注入10 μL自体血栓和50 U凝血酶,结果表明,模型组脑血流量较基础值降低,并随时间延长进一步降低,120 min时较假手术组同期最大下降33.7%,而且出现严重脑梗死神经症状、较大范围脑梗死和明显神经细胞损伤等病理学改变,与Zhang等[2]报道的结果一致,为稳定可靠的理想模型。
脑栓塞是常见的脑血管病,必须及时有效地治疗,否则将严重影响患者的生活质量,甚至危及生命。早期溶栓对提高生存率和减少致残率有积极意义[6]。rSak是一种强效且具有纤维蛋白特异性的纤溶酶原激活剂类的溶栓药物,采用DNA生物工程技术研制出的高效特异性溶栓剂,先与纤溶酶原结合形成复合物,在此复合物中的纤溶酶原转变为纤溶酶,从而降解纤维蛋白发挥溶栓效果[7]。本研究发现,rSak 150 kU/kg能使脑血流量增加28.5%,脑神经缺陷评分降低23.4%,脑梗死范围缩小41.7%,而且脑神经病理学改变有所减轻。与文献报道[8]的rSak增加脑血流量、降低脑神经缺陷评分、缩小脑梗死范围一致,也验证了该模型适合溶栓药物研究。
由于脑卒中患者梗死的脑组织可能激活内源性凝血酶,凝血酶还可介导炎症和增生反应,促近白细胞聚集黏附于内皮细胞,而使缺血的细胞受到进一步损伤[9]。本模型注入自体血栓和凝血酶可能比单纯血栓造成的脑梗死模型形成更多的白细胞聚集,而使脑梗死更严重,模型更接近人类卒中。总之,该模型存在以下优点:①比其他脑缺血模型更接近人类卒中在早期血栓模型,人类血栓大多由人体血液凝块,或悬浮的同源小血块碎片产生血栓[10];②这种栓塞性脑梗死模型成功率高,不开颅,手术创伤较小,栓塞后脑水肿与颅高压的变化接近正常的生理过程。但也存在缺点:①不能再通,可能导致外源物质引起的炎症反应;②无法准确预测栓塞的部位,也可能受到侧支循环的影响。这些都需要在推广应用过程不断完善。而且如果用同位素示踪血栓,结果将更真实可靠,但受本实验室条件限制,以期改进。
综上所述,本实验室采用经颈外动脉向颈内动脉注射凝血酶栓塞大鼠大脑中动脉致局灶性脑梗死模型,所形成的血栓与人类生理病理情况比较接近,而且方法直观、结果稳定、重复性高,实用性很强,适于对溶栓药物的研究,值得广泛推广。
| [1] | Esmon C T. What did we learn from new oral anticoagulant treatment? [J]. Thromb Res, 2012, 130(1): S41-S43. |
| [2] | Zhang Z G, Rui L Z, Quan J, et al. A new rat model of thrombotic focal cerebral ischemia [J]. J Cereb Blood Flow Metab, 1997, 17(2): 123-135. |
| [3] | 徐立新, 袁 芳. 改良的大鼠脑局部缺血模型 [J]. 中国康复理论与实践, 2005, 11(1): 23-24. |
| [4] | Suh S H, Lee K Y, Seo K D, et al. Recanalization of acute intracranial artery occlusion using temporary endovascular bypass technique [J]. Neurointervention, 2013, 8(2): 80-86. |
| [5] | 王维亭, 于 冰, 赵专友, 等. 家兔微血栓栓塞中风模型的建立及应用 [J]. 中国药业, 2010, 19(5): 15-17. |
| [6] | Escudero D, Molina R, Viña L, et al. Endovascular treatment and intra-arterial thrombolysis in acute ischemic stroke [J]. Med Intensiva, 2010, 34(6): 370-378. |
| [7] | Moussa M, Ibrahim M, El Ghazaly M, et al. Expression of recombinant staphylokinase in the methylotrophic yeast Hansenula polymorpha [J]. BMC Biotechnol, 2012, 12(96): 1-13. |
| [8] | 秦智勇, 陈衔城, 马 端, 等. 基因重组葡激酶治疗幼猪急性脑梗死 [J]. 中华急诊医学杂志, 2002, 11(3): 155-157. |
| [9] | Tripathy D, Sanchez A, Yin X, et al. Thrombin, a mediator of cerebrovascular inflammation in AD and hypoxia [J]. Front Aging Neurosci, 2013, 5(19): 1-9. |
| [10] | Michota F. Transitions of care in anticoagulated patients [J]. J Multidiscip Healthc, 2013, 6: 215-228. |
 2014, Vol. 37
2014, Vol. 37


