丙型病毒性肝炎(简称丙型肝炎、丙肝)是一种由丙型肝炎病毒(HCV)感染引起的病毒性肝炎。据世界卫生组织统计,全球丙肝的感染率约为3%[1],约1.8亿人感染HCV,每年新发丙型肝炎病例约3.5万例。丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,100名患者中有1%~5%可发展为肝硬化甚至肝细胞癌(HCC)而死亡[2]。
目前,HCV病毒共有6种基因型。标准治疗方案为聚乙二醇干扰素(Peg-IFN)联合利巴韦林(RBV),总治愈率不足50%,需坚持足够剂量持续治疗一年以上。作为1周注射1次的Peg-IFN存在诸多不良反应、药物相互作用和患者依从性差等缺点,对其临床使用有所限制。因此,提高治愈率、缩短治疗时间和采用全口服而不使用Peg-IFN治疗丙肝的直接抗病毒药物(DAAs)不断出现。
2009年以来,直接抗病毒药物(DAAs)相继出现了以病毒RNA复制的NS3/4A蛋白酶抑制剂,如波普瑞韦、特拉匹韦、司普瑞韦。索非布韦作为一种新型HCV聚合酶抑制剂,它作用于病毒RNA复制的核苷酸类似物NS5B聚合酶位点,中止HCV复制[3],经临床试验证实,其对全部基因型丙肝病毒均可有效控制。美国食品药品监督管理局(FDA)于2013年12月6日,批准由美国吉利德(Gilead)公司研发并上市的新分子实体药物索非布韦(sofosbuvir)片剂,商品名Sovaldi[4, 5],用于慢性丙型肝炎(CHC)的治疗。
索非布韦(sofosbuvir)片剂中含有原料400 mg,辅料由胶态二氧化硅、交联羧甲基纤维素钠、硬脂酸镁、甘露醇和微晶纤维素组成。片剂薄膜衣材料为聚乙二醇、聚乙烯醇、滑石粉、二氧化钛、氧化铁黄等[6]。索非布韦为白色至灰白色结晶固体,分子式为C22H29FN3O9P,相对分子质量为529.45。化学名为(S)-2-((S)-(((2R,3R,4R,5R)-5-(2,4-二氧-3,4-二氢嘧啶-1-(2H))-3-羟基-4-氟-4-甲基-2-四氢呋喃)-甲氧基)-磷酰化苯氧基)氨基丙酸异丙酯,结构见图 1。
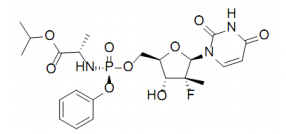 | 图 1 索非布韦结构式Fig. 1 Structure of sofosbuvir |
FDA使用说明书对索非布韦的剂量与禁忌证、特殊人群中使用进行了详细描述[6]。
1.1 剂量与禁忌证索非布韦片规格400 mg,口服给药,1 次/d,可以空腹或与食物一起服用,应与利巴韦林联用,或与聚乙二醇干扰素和利巴韦林联用治疗慢性丙型肝炎(CHC)。HCV单独感染和HCV/HIV-1共同感染患者,建议的联合治疗方案见表 1。
| 表 1 索非布韦给药方案 Table 1 Dosage regimen of Sofosbuvir |
禁忌症:当与聚乙二醇干扰素/利巴韦林或单独与利巴韦林联用时,对聚乙二醇干扰素和(或)利巴韦林的所有禁忌证也都同样适用于索非布韦。利巴韦林可能引起胎儿缺陷或胎儿死亡,妊娠期妇女和男性患者的女性伴侣禁忌使用索非布韦与聚乙二醇干扰素/利巴韦林或利巴韦林联合给药。
警告和注意事项:由于利巴韦林可能引起胎儿缺陷或胎儿死亡,在治疗开始前患者需避免妊娠。
不良反应:索非布韦与利巴韦林联用最常见的不良反应是疲劳和头痛。索非布韦与聚乙二醇干扰素和利巴韦林联用最常见的不良反应是疲劳、头痛、恶心、失眠和贫血。
1.2 特殊人群中使用 1.2.1 妊娠妇女当女性患者和男性患者的女性伴侣服用组合药物利巴韦林或聚乙二醇干扰素/利巴韦林时必须避免妊娠。育龄妇女及其男性伴侣不应使用利巴韦林,除非使用利巴韦林治疗结束后进行6个月有效避孕。
在所有动物种属利巴韦林暴露试验中证实,本品显著的致畸胎作用和(或)杀胚胎作用。因此妊娠妇女和妊娠妇女男性伴侣禁忌利巴韦林。
1.2.2 儿童尚未在儿童中确定索非布韦的安全性和有效性。
1.2.3 老年人索非布韦被给予90例65岁以上的受试者,治疗组中超过65岁的受试者观察到的反应率与较年轻的受试者相似。老年患者无需调整索非布韦剂量。
1.2.4 肾受损患者对有轻度或中度肾受损患者无需调整索非布韦剂量。有严重肾受损〔eGFR<30 mL/(min·1.73 m2)〕或肾病终末期(ESRD)需要血液透析患者中尚未确定索非布韦的安全性和疗效。对有严重肾受损或ESRD患者不能给出剂量建议。
1.2.5 肝受损患者对有轻度、中度或严重肝受损患者无需调整索非布韦剂量。在有失代偿性肝硬变患者中尚未确定索非布韦的安全性和疗效。
1.2.6 肝移植后患者尚未确定在肝移植后患者中索非布韦的安全性和疗效。
1.2.7 HCV基因5或6型感染CHC患者对有HCV基因5或6型感染受试者得到数据的不充分,不能提供给药建议。
2 临床药理学 2.1 药理作用索非布韦的代谢产物为GS-331007,为HCV特异性NS5B聚合酶的核苷抑制剂[7]。其作用靶点是HCV特异性NS5B聚合酶高度保守的活化位点[8]。核苷类似物在宿主肝细胞内磷酸化后成为有活性的三磷酸核苷,并与HCV RNA复制所用的核苷竞争,从而导致HCV基因组复制中止[9]。
2.2 药动学根据Gillian和Kirby等[10, 11]分别进行的研究,索非布韦ADME过程的药动学参数如下。
2.2.1 吸收索非布韦口服给药后,0.5~2 h检测到血药浓度峰值。GS-331007在2~4 h检测到血药浓度峰值。根据基因1至6型HCV感染受试者利巴韦林(有/无聚乙二醇干扰素)共同给药的群体药动学分析,稳态索非布韦(n=838)和GS-331007(n=1 695)的曲线下面积AUC0-24分别为828 (ng∙h)/mL和6 790 (ng∙h)/mL。
2.2.2 分布索非布韦的人体血浆蛋白结合率为61%~65%,与药物浓度无关;药物浓度的范围为1~20 μg/mL。在人血浆中GS-331007的蛋白结合率很小。
2.2.3 代谢索非布韦在肝脏中被广泛地代谢成具有药理学活性的核苷酸类似物三磷酸GS-461203。
2.2.4 消除单次给予口服400 mg索非布韦,平均总回收剂量大于92%。在尿、粪和废气中分别回收约80%、14%、2.5%。在尿中回收剂量大多数是GS-331007(78%),而3.5%为索非布韦。这表明GS-331007主要消除途径是肾清除。索非布韦和GS-331007的半衰期分别是0.4 h和27 h。
3 毒理学 3.1 癌变、基因突变、遗传毒性正在进行索非布韦的小鼠和大鼠的致癌性研究。在1组体外或体内包括细菌致突变性试验,用人外周血淋巴细胞染色体致畸和体内小鼠微核试验显示索非布韦没有致遗传毒性[6]。
在雄性动物生育能力研究方面,利巴韦林诱发可逆性睾丸毒性,而聚乙二醇干扰素可能损害雌性生育能力。在大鼠中评价最高剂量测试,索非布韦的主要循环代谢物GS-331007,AUC暴露量约为人推荐临床剂量的8倍时,对胚胎或胎鼠生存能力或生育能力无影响[6, 12, 13]。
3.2 动物毒理学针对50只大鼠给予GS-9851(含索非布韦立体异构体混合物约50%)日剂量2 000 mg/kg,5 d后观察到心脏退行性变性和炎症;在该剂量下,对主要代谢物GS-331007 AUC暴露高于人推荐临床剂量约29倍[6, 14]。在大鼠实验中,索非布韦日剂量500 mg/kg共6个月,GS-331007 AUC暴露高于人推荐临床剂量9倍后未观察到心脏退行性变性或炎症。在犬和小鼠实验中,索非布韦剂量500、1 000 mg/kg分别观察9和3个月后,未见心脏退行性变性和炎症;在该剂量下,GS-331007 AUC暴露高于人推荐临床剂量分别为27、41倍[6, 12, 13]。
4 临床研究吉利德公司开展了4项Ⅲ期临床试验评价索非布韦,即FISSION、POSITRON、FUSION、NEUTRINO试验。
FISSION试验:一项在国际多地区开展的随机、开放、非劣效性Ⅲ期临床试验(NCT01497366),针对早期未接受治疗的HCV GT2和HCV GT3患者,并将其分成接受索非布韦+利巴韦林给药12周的治疗组256例,接受聚乙二醇干扰素+利巴韦林给药24周的对照组。对于HCV GT2感染,持续病毒应答(sustained virologic response,SVR)率分别为97.1%和77.6%。对于HCV GT3感染,SVR率分别为55.7%、62.5%。常见的不良反应有疲劳、恶心、头痛、失眠和贫血等,发生率治疗组比对照组更低。试验数据表明,索非布韦+利巴韦林治疗方案可有效改善HCV GT2持续病毒应答率。而HCV GT3的治疗方案需进一步研究,如再加入一种其他作用机制的抗病毒药物或延长给药时间[10, 15, 16, 17]。
POSITRON试验:一项在国际多地区开展的随机、开放、非劣效性Ⅲ期临床试验(NCT01542788),针对不利于使用干扰素患者的HCV GT2、HCV GT3感染,治疗组病数分别为109、98例,安慰剂组病例数71例。治疗组采用索非布韦+利巴韦林联合给药12周,与安慰剂组比较,12周后持续病毒应答率(12 weeks sustained virologic response,SVR12),分别为92.7%、61.2%和0%。不利于使用干扰素患者的主要原因是预先得知患有精神疾病(57.0%)或自身免疫系统疾病(19.0%)。数据分析显示HCV GT2的12周持续病毒应答率高于HCV GT3。在受试者中,无肝硬化者的SVR12(81%)与肝硬化者的SVR12(61%)相比更高。常见的不良反应包括疲劳、恶心、头痛、失眠、瘙痒等[10, 15, 16, 18]。
FUSION试验:一项在国际多地区开展的随机、开放、非劣效性Ⅲ期临床试验(NCT01604850),针对早期接受治疗但无应答的HCV GT2和HCV GT3患者,索非布韦+利巴韦林12周治疗组(N=103)的持续病毒应答率明显低于索非布韦+利巴韦林16周治疗组(N=98)。HCV GT2的SVR分别为86.1%和93.8%;HCV GT3的SVR分别为29.7%和61.9%。通过数据分析,HCV GT2和HCV GT3的SVR有明显升高。无肝硬化患者的SVR从61.0%提高到76.0%,而肝硬化患者的SVR从31.0%提高到66.0%。针对早期接受治疗但无应答的HCV GT2和HCV GT3患者,采用索非布韦+利巴韦林的联合给药方案是有效的,并且16周更优于12周的给药方案。16周给药方案针对HCV GT2和无肝硬化的患者疗效显著,并且延长给药时间更有利于HCV GT3患者,探索24周甚至更长的时间对HCV GT3是否更有利,需进行进一步研究。常见的不良反应有疲劳、恶心、头痛、失眠和贫血等[10, 15, 16, 18]。
NEUTRINO试验:一项非比较性、美国国内多中心的Ⅲ期临床试验(NCT01641640),针对早期未接受治疗的HCV GT1、GT4、GT5、GT6感染患者(N=327),采用索非布韦+聚乙二醇干扰素+利巴韦林联合治疗12周后,总SVR12率为90.2%,其中GT1a、GT1b和GT4~6亚型的SVR12率分别为91.6%、81.8%、97.1%。无肝硬化患者和有肝硬化患者的SVR分别为92.0%和80.0%。通过本试验证明,索非布韦对HCV GT1~6都有疗效[10, 15, 16, 17]。
5 结语索非布韦是以NS5B聚合酶为靶点的唯一成药品种,与其相同作用机制的药物因毒性问题而在临床试验过程中终止或延迟[7]。目前,吉利德公司已经向FDA提交了固定剂量的索非布韦与另一种NS5A蛋白酶抑制剂Ledipasvir组合,旨在通过全口服的给药途径治疗HCV GT1感染[19]。专家预测在未来5年内,FDA和EMA不会有相同作用机制的新药申报,它将成为此作用机制下仅有的上市药品,具有广阔的市场前景。
| [1] | World Health Organization. Hepatitis C: fact sheet no. 164. 2013. [EB/OL]. (2013-12-18) [2014-02-20]. http:// www.who.int/mediacentre/factsheets/fs164/en/. |
| [2] | Wise M, Balek S, Fineli L, et al. Changing trends in hepatitis C-related mortality in the United States, 1995–2004 [J]. Hepatology, 2008, 47(4): 1128-1135. |
| [3] | Jean-Michel P. Treatment of chronic hepatitis C: current and future [J]. Curr Top Microbiol Immunol, 2013, 369: 321-342. |
| [4] | Manns M P, Cornberg M. Sofosbuvir: the final nail in the coffin for hepatitis C [J]. Lancet Infect Dis, 2013, 13(5): 378-379. |
| [5] | Hee B, Chae S, Mee P, et al. Direct-acting antivirals for the treatment of chronic hepatitis C: open issues and future perspectives [J]. Sci World J, 2013, 2013(5): 704912-704920. |
| [6] |
FDA. Sovaldi label [EB/OL]. (2013-12-06) [2013-12-06]. http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/2046 71s000lbl.pdf. |
| [7] | Rodríguez-Torres M. Sofosbuvir (GS-7977), a pan-genotype, direct-acting antiviral for hepatitis C virus infection [J]. Expert Rev Anti Infect Ther, 2013, 11(12): 1269-1279. |
| [8] | Pockros P J. Nucleoside/nucleotide analogue polymerase inhibitors in development [J]. Clin Liver Dis, 2013, 17(1): 105-110. |
| [9] | Lam A M, Murakami E, Espiritu C, et al. PSI-7851, a pronucleotide of β-D-2'-deoxy-2'-fluoro-2'-C-methyluri- dine monophosphate, is a potent and pan-genotype inhibitor of hepatitis C virus replication [J]. Antimicrob Agents Chemother, 2010, 54(8): 3187-3196. |
| [10] | Gillian M K, Asha V, Sofosbuvir: first global approval [J]. Drugs, 2014, 74(2): 273-282. |
| [11] | Kirby B, Gordi T, Symonds W T, et al. Population pharma- cokinetics of sofosbuvir and its major metabolite (GS- 331007) in healthy and HCV infected adult subjects [J]. Hepatology, 2013, 58(4 Suppl): 746A-747A. |
| [12] | Selected properties of sofosbuvir [EB/OL]. (2013-12-06) [2014-03-06]. http://hcvdruginfo.ca/downloads/HCV_ Sofosbuvir.pdf |
| [13] | Gilead Sciences Inc. Sovaldi? (sofosbuvir) tablets 400 mg sofosbuvir antiviral agent [EB/OL]. (2013-12-12)[2014-03-06]. http://www.gilead.ca/pdf/ca/sovaldi_ pm_english.pdf. |
| [14] | Eric L, Rodríguez-Torres M, Jill M D, et al. Pharmaco- kinetics, pharmacodynamics, and tolerability of GS-9851, a nucleotide analog polymerase inhibitor, following multiple ascending doses in patients with chronic hepatitis C infection [J]. Antimicrob Agents Chemother, 2013, 57(3): 1209-1217. |
| [15] | FDA. Sovaldi clinical pharmacology biopharmaceutics review (s) [EB/OL]. (2013-12-06)[2014-03-06]. http: //www. accessdata.fda.gov/drugsatfda_docs/nda/2013/ 204671Orig1s000ClinPharmR.pdf. |
| [16] | Sovaldi: epar-public assessment report [EB/OL]. (2013- 12-06)[2014-03-06]. http://www.ema.europa.eu/docs/en_ GB/ document_library/EPAR_-_Public_assessment_ report/ human/002798/WC500160600.pdf. |
| [17] | Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection [J]. N Engl J Med, 2013, 368(20): 1878-1887. |
| [18] | Jacobson I M, Gordon S C, Kowdley K V, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options [J]. N Engl J Med, 2013, 368(20): 1867-1877. |
| [19] | Kowdley K V, Gordon S C, Reddy K R, et al. Ledipasvir and Sofosbuvir for 8 or 12 weeks for chronic HCV without Cirrhosis [J]. N Engl J Med, 2014. DOI: 10.1056/NEJMoa1402355. |
 2014, Vol. 37
2014, Vol. 37

