2. 庆元县金源真菌多糖制品有限责任公司, 浙江 丽水 323800;
3. 浙江康恩贝制药股份有限公司, 浙江 杭州 310052
2. Jinyuan Fungi Polysaccharide Products Co., Ltd, Lishui 323800, China;
3. Zhejiang CONBA Pharmaceutical Co., Ltd., Hangzhou 310052, China
桦褐孔菌Inonotus obliquus (Fr.) Pilát是一种十分珍稀而名贵的药用真菌,属于真菌门、担子菌亚门、层菌纲、非褐菌目、多孔菌科、褐卧孔菌属[1]。主要分布于芬兰、波兰、俄罗斯、日本北海道等北半球北纬40°~50°的地区和我国的黑龙江和吉林一带[2]。自16世纪以来俄罗斯、波兰、芬兰等民间就广泛利用这种药用真菌来防治各种疑难杂症,如各种癌病、心脏病、糖尿病[3]。研究表明,桦褐孔菌的活性成分主要为多糖和三萜类物质,具有降血糖、抗肿瘤、抗氧化和降血脂等药理活性[4, 5, 6, 7]。桦褐孔菌作为一种具有多种药理活性的中药,具有极大的开发前景,以其为原料的产品正不断被开发出来,但食用安全性不容忽视。目前,对桦褐孔菌毒理方面的研究报道较少,为更全面了解桦褐孔菌的食用安全性,本实验根据毒理评价标准的相关要求[8],对桦褐孔菌水提物进行了急性毒性及生殖毒性评价。
1 材料与方法 1.1 材料 1.1.1 药物与试剂桦褐孔菌子实体,购自大连王力野生灵芝生物科技有限公司,2012年11月采自大兴安岭,经浙江省医学科学院保健食品研究所吴学谦研究员鉴定为桦褐孔菌Inonotus obliquus (Fr.) Pilát,样本存放于浙江工业大学生物活性物质分离提取团队实验室。环磷酰胺购于Sigma公司,伊红、乙醇、甲醛和石蜡等试剂购于上海申翔化学试剂有限公司。
1.1.2 动物ICR小鼠,(20±2)g,雌雄各半,用于急性毒性试验;Wistar大鼠,(120±10)g,雌雄各半,用于30 d喂养试验;ICR小鼠雄性,(35±2)g,雄性,用于小鼠精子畸形试验,所有动物由国家啮齿类实验动物种子中心上海分公司提供。
1.1.3 仪器超低温保存箱(日本Sanyo公司)、台式冷冻离心机(德国Eppendof公司)、c8000全自动生化仪(美国Achtection公司)、血细胞分析仪(德国Siemens公司)、显微镜(厦门Motic公司)、电子天平(德国Sartorius公司)
1.2 方法 1.2.1 桦褐孔菌水提物制备桦褐孔菌子实体粉碎过60目筛,称取500 g原料,加30倍质量的纯净水,煮沸提取3 h,5 000 r/min离心去渣,上清液真空浓缩(温度45 ℃)至原有体积的1/10,加入95%的食用乙醇至溶液终体积分数为80%沉淀,1 000 r/min,4 ℃高速冷冻离心,沉淀加适量蒸馏水复溶,冷冻干燥48 h,得到桦褐孔菌样品,收率为3.6%。经苯酚-硫酸法测定,多糖含量为42%,烘干恒重法测得水分质量分数为8.2%。使用前,桦褐孔菌样品配置成水溶液,121 ℃蒸汽高温灭菌。
1.2.2 急性毒性实验ICR小鼠60只,雌雄各半。分为5个实验组和1个对照组,每组10只。通过预实验确定最小给药剂量为1.00 g/kg,最大给药剂量设为最大灌胃剂量5.00 g/kg,中间再设3个剂量为2.00、3.00和4.00 g/kg。给药前禁食12 h,自由饮水。药物ig一次给予,给药后连续14 d内观察受试动物的一般状态、摄食、饮水、便尿及外界反应情况等。记录毒性反应的出现时间,症状表现和持续时间,是否有死亡例。第15天处死小鼠,并进行大体观察,称取肝、肾、睾丸/卵巢质量,计算脏器系数,并进行病理检查。
1.2.3 30 d喂养试验Wistar大鼠80只,雌雄各半。分为高、中、低3个剂量组(2.50、2.00和1.50 g/kg)和对照组,每组20只动物。每天在相同时间点ig给药,连续给药30 d,每周称一次体质量,两次食物摄入量。首次给药后第31天用苯巴比妥麻醉,解剖颈动脉取血和肝、肾、脾、睾丸等重大器官,进行血液学和血生化分析,计算脏器系数。解剖观察无明显病变时,可仅对最高剂量组和对照组进行组织病理学检查。
1.2.4 小鼠精子畸形试验ICR雄性小鼠50只,分为3个实验组、阳性对照组和阴性对照组,每组10只动物。实验组分为低、中、高3个剂量组(1.00、2.50、5.00 g/kg),阳性对照组给予致突变药物环磷酰胺50.00 mg/kg,阴性对照组给予溶剂,连续给药5 d。首次给药后的第35天处死小鼠,取双侧附睾,制片染色,统计畸形率。
1.3 统计学方法实验数据使用Startview 5.0统计学软件进行分析,实验结果均以x±s表示。统计中的差异使用单因素方差分析法(ANOVA)进行分析。
2 结果 2.1 急性毒性试验 2.1.1 一般症状观察对照组小鼠采食、饮水、活动、对外反应、大小便分泌物均无异常。最高剂量组小鼠染毒30 min后,老鼠静伏少动,背毛竖立,走动时腹部拖地,出现腹泻症状。其余剂量组的中毒表现同上,但中毒程度和时间随剂量递减而减轻和延后,无小鼠死亡,存活小鼠24 h后能恢复正常。
2.1.2 小鼠体质量和脏器系数小鼠在整个试验过程中体质量增长正常,组内与组间均无显著性差异(表 1)。小鼠肝、肾、脾、睾丸和卵巢的脏器系数也无显著性差异(表 2)。
| 表 1 桦褐孔菌水提物对小鼠体质量的影响 (x±s,n=10) Table 1 Effect of I. obliquus water extracts on body weight of mice (x±s,n=10) |
| 表 2 桦褐孔菌水提物对小鼠脏器系数的影响(x±s,n=10) Table 2 Effect of I. obliquus water extracts on organ indexes of mice (x±s,n=10) |
解剖时进行大体观察发现各组实验动物肝、心、肾、肺、脾等重大脏器的颜色、大小、质地均正常,无明显生理病变。对高剂量组和对照组小鼠的肝、肾、睾丸、卵巢进行组织病理学观察,结果(图 1)显示,所有动物肝脏细胞形态正常,由单层肝细胞排列而成的肝索围绕在中央静脉周围,肝索之间的空隙为肝血窦,肝索和肝血窦形态正常,无明显生理性病变;肾脏形态正常,肾小球、近曲小管和远曲小管清晰可见,无明显的生理性病变;睾丸细胞中生精小管内壁依次贴有精原细胞、初级精母细胞、精子细胞,大量的成熟精子(头黑尾红)靠近管腔中央,各种细胞形态和数量无明显差异性变化;卵巢细胞内皮质外缘分布大量原始卵泡细胞,中央有一明亮、大而圆的卵母细胞,所有细胞形态正常,未见明显生理性病变。
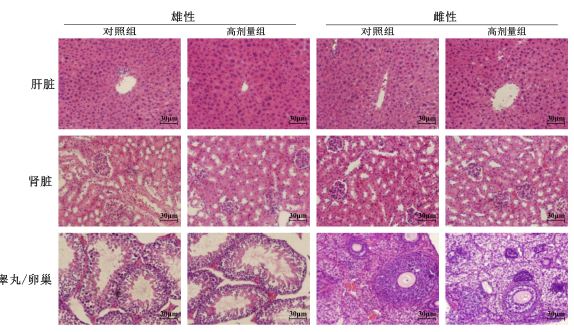 | 图 1 急性毒性实验小鼠病理组织学检查Fig. 1 Histopathological observation on mice in ATT |
所有受试动物在试验期间体质量持续增长,各组间体质量差异无显著性(表 3)。每周的食物利用率随饲养时间的增加呈下降趋势,但组与组之间相比差异无显著性。中剂量组雄性大鼠总的食物利用率与对照组相比有一个显著性下降(表 4)。
| 表 3 桦褐孔菌水提物对大鼠体质量影响 (x±s,n=20) Table 3 Effect of I. obliquus water extracts on body weight of rats (x±s,n=20) |
| 表 4 桦褐孔菌水提物对大鼠食物利用率的影响(x±s,n=20) Table 4 Effect of I. obliquus water extracts on food utilization rate of rats (x±s,n=20) |
与对照组相比,雄性大鼠的肝脏系数无显著性变化,低剂量和高剂量组雄性大鼠的肾脏系数显著性升高,高剂量组雄性大鼠睾丸系数显著性升高。雌性大鼠的肝、肾、脾脏的系数与对照组相比差异均无显著性(表 5)。
| 表 5 桦褐孔菌水提物对大鼠脏器系数的影响 (x±s,n=20) Table 5 Effect of I. obliquus water extracts on organ indexes of rats (x±s,n=20) |
所有受试大鼠血液中白细胞计数、红细胞计数和血红蛋白含量均无显著性变化;雌性大鼠白细胞分类计数正常无显著变化,雄性大鼠中剂量给药组大鼠的单核细胞和嗜酸性粒细胞所占白细胞比例显著增加(表 6)。
| 表 6 桦褐孔菌水提物对大鼠血液常规检测的影响 (x±s,n=20) Table 6 Effect of I. obliquus water extracts on blood routine test of rats (x±s,n=20) |
与对照组相比,中剂量组大鼠血液中肌酐和总胆固醇显著性下降,高剂量组大鼠血液中肌酐显著下降。雌性大鼠中,高剂量组大鼠血液中门冬氨酸氨基转移酶较对照组显著性下降,白蛋白含量显著上升;中剂量组大鼠血糖相对于对照组有一个显著上升。其余各项指标未见显著性差异(表 7)。
| 表 7 桦褐孔菌水提物对大鼠血液生化检测的影响(x±s,n=20) Table 7 Effect of I. obliquus water extracts on blood biochemical parameters in rats (x±s,n=20) |
大体剖检观察各组实验动物脏器位置及大小正常;胸腔、腹腔、心包无积液与粘连;肝、脾、肾色泽均匀,表面光滑,无肿大及包块;胃、十二指肠亦未发现溃疡、出血点及其他异常改变。此后仅对高剂量组和对照组相关器官做病理学检查(图 2)。肝脏组织:呈暗红色,质软,表面光滑、平整,未见隆起及包块。镜下所见肝细胞形态正常,肝细胞索排列整齐无明显生理病变。肾脏组织:表面光滑平整,未见明显增大与缩小。镜下观察肾小球结构清晰,肾小管环绕于肾小球周围,形态正常无明显生理病变。脾脏组织:呈暗红色,质软,表面光滑平整,未见明显肿大或缩小。镜下观察被膜完整,深蓝色部分为白髓,红髓分布在白髓之间,白髓中脾小体清晰可见,结构正常未见充血及其他病理改变。胃组织:胃黏膜清晰可见,其中黏膜层上皮细胞下陷形成胃小凹,上皮层下面胃壁细胞整齐排列,未见明显生理病变。十二指肠:小肠黏膜清晰可见,其形态结构正常,黏膜层、黏膜下层、肌层及外膜结构正常,未发现病理改变。睾丸:双侧等大,表面光滑,被膜完整,镜下所见生精小管清晰,其原细胞、精母细胞、精细胞和精子结构完整。卵巢:表面上皮形态正常,其下为不同发育阶段的卵泡(图中未表示)和卵泡间结缔组织构成的皮质及疏松结缔组织构成的髓质,未见异常改变。
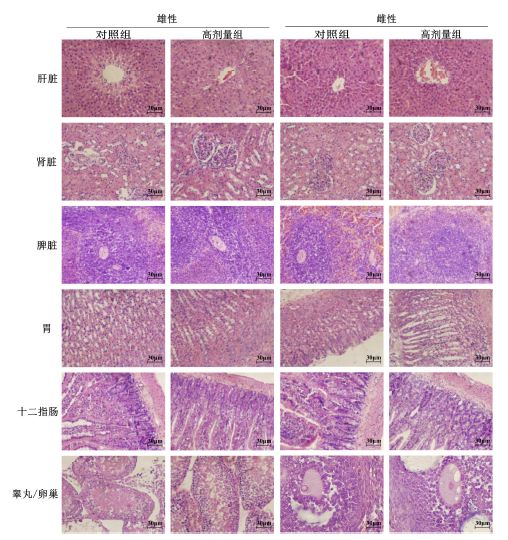 | 图 2 30 d喂养试验大鼠组织病理学观察Fig. 2 Histopathological observation on mice in TDFT |
所有给药组的精子畸形率与阳性对照组(环磷酰胺处理)相比都显著性降低,给药组中5.00 g/kg组相对于阴性对照组有上升趋势(表 8)。
| 表 8 桦褐孔菌水提物对小鼠精子畸形率的影响 (x±s,n=10) Table 8 Effectof I. obliquus water extracts on rate of sperm deformity of mice (x±s,n=10) |
目前,对桦褐孔菌及其提取物药理作用的研究已有大量报道[9, 10, 11, 12],对其药理活性的研究也较为全面和成熟。随着其药用价值越来越被人们所重视,其使用安全性不容忽视。在本研究中采用急性毒性、30 d喂养试验、小鼠精子畸形试验相结合的方法测试桦褐孔菌水提物可能的生理和生殖毒性。
急性毒性试验是毒理学安全性评价的基础,主要研究24 h内单次或多次染毒后动物所产生的毒性反应和死亡情况[13]。初步估计药物的毒性,为后续其他毒性试验的剂量设定提供参考。本研究急性毒性试验采用半数致死剂量(LD50)法,对雌、雄小鼠最大给药剂量为5.00 g/kg。观察14 d,小鼠无死亡,可推断出两种性别小鼠的LD50大于5.00 g/kg,按照《中华人民共和国国家标准GB 15193.3-2003》[8]中的急性毒性剂量分级表,属实际无毒级,表明桦褐孔菌毒性极小或无毒。
30 d喂养试验又称亚急性毒性试验,是在了解受试物的有关急性毒性的初步资料后进行的长期毒性试验。本研究以1.50、2.00和2.50 g/kg 3个剂量的桦褐孔菌水提物对大鼠ig给药30 d。试验结果显示各剂量组雌、雄性大鼠每周体质量增长和食物利用率均无显著性差异,但中剂量组雄性大鼠总的食物利用率与对照组相比有显著性下降。与对照组相比,低剂量组的雄性大鼠的肾脏系数有所提高,高剂量组雄性大鼠的肾脏和睾丸系数也有所提高,但上升程度均是在正常范围内波动[14]。雌雄大鼠均有少数血液生化指标水平发生变化,但均是在正常范围内波动[15]。以上结果初步说明了桦褐孔菌作为药品或保健品的相对安全性。
生殖系统对化学毒物的作用十分敏感,化学物质作用于动物,在其他系统出现毒性反应前,生殖系统可能已经出现损害。由于其对有害物质的高度敏感,小鼠精子畸形试验在国内外毒理学研究工作中得到广泛应用,是我国相关法律规定食品、添加剂、中成药等外源性化学物质的安全性评价的检测项目之一[16]。小鼠精子畸形试验结果显示,各实验组相对于阳性对照组(环磷酰胺),精子畸形率均显著降低。低、中剂量组精子畸形率与阴性对照组相比差异无显著性,只有高剂量组相对于阴性对照组畸形率有上升趋势,说明大剂量服用桦褐孔菌水提物时可能具有一定的生殖毒性影响。
本研究对桦褐孔菌水提物进行了一个初步的毒理学评价,结果显示桦褐孔菌毒性较小。为实现对桦褐孔菌的开发利用,还有待对桦褐孔菌水提物进一步纯化和长期的慢性毒理评价试验,从而为其安全性提供更有力地依据。
| [1] | 陈艳秋, 李 玉. 桦褐孔菌的研究进展 [J]. 微生物学通报, 2005, 32(2): 124-127. |
| [2] | 杜文婧, 王 琦. 桦褐孔菌资源分布及药理活性研究进展 [J]. 菌物研究, 2013, 11(1): 49-56. |
| [3] | 黄年来. 俄罗斯神秘的民间药用真菌——桦褐孔菌 [J]. 中国食用菌, 2002, 21(4): 7-8. |
| [4] | 梁清乐, 王秋颖, 樊锦燕, 等. 桦褐孔菌的研究概况 [J]. 中草药, 2005, 36(4): 623-625. |
| [5] | Kim Y O, Park H W, Kim J H, et al. Anti-cancer effect and structural characterization of endo-polysaccharide from cultivated mycelia of Inonotus obliquus [J]. Life Sci, 2006, 79(1): 72-80. |
| [6] | Xu X Q, Wu Y D, Chen H. Comparative antioxidative characteristics of polysaccharide-enriched extract from natural sclerotia and cultured mycelia in submerged fermentation of Inonotus obliquus [J]. Food Chem, 2011, 127(1): 74-79. |
| [7] | Sun J E, Ao Z H, Lu Z M, et al. Antihyperglycemic and antilipidperoxidative effects of dry matter of culture broth of Inonotus obliquus in submerged culture on normal and alloxan-diabetes mice [J]. J Ethnopharmacol, 2008, 118(1): 7-13. |
| [8] | 食品安全性毒理学评价程序和方法 [S]. 2003. |
| [9] | 刘继强, 梅 洵, 梁永红, 等. 斜生褐孔菌菌质对链脲佐菌素诱导的2型糖尿病的影响 [J]. 中草药, 2013, 44(7): 869-874. |
| [10] | 陈义勇, 顾小红, 汤 坚. 桦褐孔菌多糖的抗肿瘤活性研究 [J]. 食品与生物技术学报, 2011, 30(1): 65-69. |
| [11] | 杜秀菊, 徐 伟, 穆红梅, 等. 桦褐孔菌多糖的药理活性与化学结构研究进展 [J]. 食用菌学报, 2012, 19(1): 100-104. |
| [12] | 张泽生, 杨超慧, 史 珅, 等. 桦褐孔菌多糖对小鼠免疫调节作用的影响 [J]. 食品研究与开发, 2008, 29(7): 35-37. |
| [13] | 张天亮. 急性经口毒性试验替代测试方法进展 [J]. 预防医学, 2008, (12): 1225-1226. |
| [14] | 李 岩, 高 虹, 孙井江, 等. Wistar大鼠体重和主要脏器参考值的研究 [J]. 实用预防医学, 2009, 12(6): 1708-1711. |
| [15] | 高珉之, 柴玮杰, 王玉燕, 等. Wistar大鼠血液、生化指标及ICR小鼠免疫学指标正常参考值的研究 [J]. 医学动物防制, 2008, 24(9): 675-677. |
| [16] | 食品安全性毒理学评价程序和方法之小鼠精子畸形试验 [S]. 2003. |
 2014, Vol. 37
2014, Vol. 37


