2. 南华大学, 湖南 衡阳 421001
2. Nanhua University, Hengyang 421001, China
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史,而以肝实质细胞脂肪贮积和脂肪变性为特征的临床病理综合征。根据疾病发展的不同阶段主要分为单纯性脂肪肝(non-alcoholic fatty liver,NAFL)以及由其演变的脂肪性肝炎(non-alcoholic steatohepatitis,NASH)和脂肪性肝硬化(non-alcoholic fatty hepatocirrhosis,NAFH)。NASH由于炎症、坏死、纤维化对NAFLD病程进程和预后产生重要的影响,因此采取药物治疗NASH是必须且关键的。
中医药由于其多靶点、多途径、少副作用等特点,在临床上对肝病的治疗疗效得到肯定。四逆散首见于张仲景的《伤寒论》。据《伤寒论》少阴病篇318条记载:“少阴病,四逆,其人或咳,或悸,或小便不利,或腹中痛,或泄利下重者,四逆散主之。”普遍认为,四逆散的应用病机是肝气郁结,阳气内郁,不能透达四肢的热厥证。四逆散对肝脏的保护作用尤为明显。如对肝纤维化、肝损伤、肝硬化、酒精性肝病、脂肪肝、肝炎都有临床疗效[1, 2]。因此对四逆散的治疗作用的研究需求更加迫切。
1 材料与方法 1.1 动物C57BL/6小鼠,雄性,18~20 g,SPF级,购于湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2011-0003。
1.2 材料蛋氨酸-胆碱缺乏(methionine-choline-deficient,MCD)饲料[3]和对照饮食蛋氨酸胆碱正常含量(MCS)饲料(MCD饮食配方加上胆碱2 g/kg、蛋氨酸3 g/kg)均由江苏南通特洛菲饲料有限公司加工制作,为清洁级饲料,4 ℃低温保存。四逆散组成药物(柴胡、白芍、枳实、甘草)配方颗粒,购自湖南中医药大学附属第一医院;普罗布考片,批号292210-039,承德颈复康药业集团有限公司;丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、三酰甘油(TG)、超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂购于南京建成生物公司。
1.3 方法 1.3.1 分组及处置50只小鼠予普通饲料适应性饲喂1周后随机分成对照组、模型组、普罗布考组(700 mg/kg)、四逆散高剂量组(7.28 g/kg)及四逆散低剂量组(3.64 g/kg),每组小鼠10只。其中正常对照组饲喂MCS饮食;其余饲喂MCD饮食,自由摄食、饮水。从喂养MCD饮食当日起预防性给药,正常对照组及模型组ig配制药物的溶剂,每日一次,连续ig 4周,每周6 d。处置小鼠前禁食12 h,称体质量,麻醉,摘眼球取血;肝脏称质量后部分液氮冻存,部分4%多聚甲醛固定。
1.3.2 血清及肝组织ALT、AST、TG含量测定小鼠血清ALT、AST、TG根据试剂盒说明进行测定;用脂质提取液正庚烷-异丙醇(2∶3.5)取10%肝匀浆,离心后取上清测定肝脏TG含量。
1.3.3 肝组织病理学检测肝组织石蜡切片,行常规HE染色。
1.3.4 肝组织SOD、MDA含量用PBS制备10%肝匀浆,根据试剂盒说明测定SOD、MDA含量。
1.3.5 统计学处理计数资料用x±s表示,两组之间采用重复测量方差分析进行统计分析,统计学显著性用双侧检验,统计软件采用SPSS16.0。
2 结果 2.1 血清ALT、AST酶活力与对照组比较,模型组小鼠血清ALT、AST含量显著升高,差异有极显著性(P<0.01);与模型组比较,各用药组ALT、AST含量均有下降,其中四逆散高剂量组差异具有显著性(P<0.05),其余各组未见差异,见表 1。
| 表 1 各组小鼠ALT酶和AST酶活力比较 (x±s,n=10) Table 1 Comparison on activities of ALT and ASTin mice in each group (x±s,n=10) |
与对照组比较,模型组小鼠血清TG含量降低,而肝脏TG含量升高,差异均有显著性(P<0.01)。与模型组比较,四逆散高剂量组能增加血清TG中的含量,并降低肝脏TG含量,差异具有显著性 (P<0.05)。见图 1~2。
 | 与对照组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01 *P < 0.05 vs normal group; ##P < 0.01 vs model group 图 1 各组小鼠血清TG含量比较Fig. 1 Comparison on TG content in serum of mice in each group |
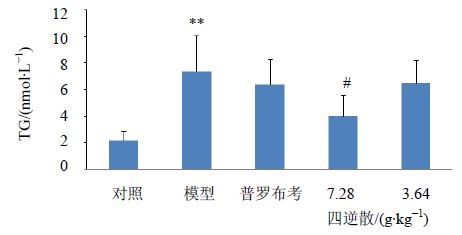 | 与对照组比较:**P<0.01;与模型组比较:#P<0.05 ** P < 0.01 vs normal group; #P < 0.05 vs model group 图 2 各组小鼠肝脏TG含量比较Fig. 2 Comparison of TG content in liver of mice in each group |
对照组小鼠肝组织形态结构正常。模型组肝细胞内充满大量脂肪空泡,肝细胞呈气球样变,炎性细胞浸润明显,呈灶状分布;普罗布考组肝细胞内同样充满大量脂肪空泡,炎性细胞浸润较模型组减少;四逆散高剂量组脂肪空泡显著减少,肝组织结构较正常,炎性细胞浸润模型减少;四逆散低剂量组脂肪空泡较多,炎性细胞浸润较明显。见图 3。
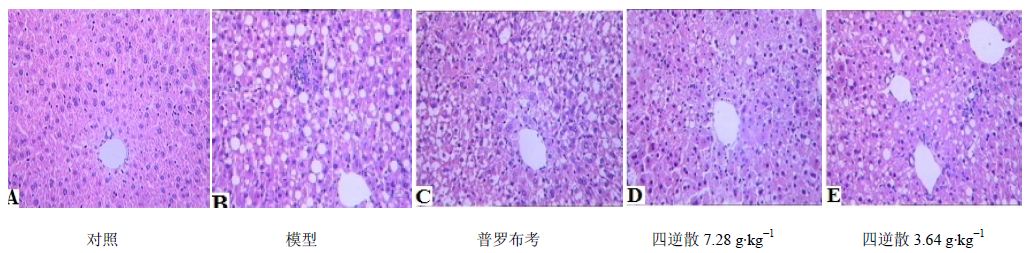 | 图 3 各组小鼠肝组织HE染色病理变化Fig. 3 HE staining of liver tissue of mice in each group |
与对照组比较,模型组小鼠肝组织SOD含量下降,而MDA含量增加,差异具有显著性(P<0.05);与模型组比较,各用药组均能增加SOD含量,降低MDA含量,差异均有显著性(P<0.05)。见表 3。
| 表 3 各组小鼠肝脏SOD活力及MDA含量比较(x±s,n=10) Table 3 Comparison on SOD activity and MDA content inliverof micein eachgroup (x±s,n=10) |
MCD饮食诱发的NASH模型是国际上被广泛认可的动物模型,操作简便,成模率高,是研究NASH发病机制及防治药物的主要动物模型。蛋氨酸和胆碱是肝细胞卵磷脂生物合成的必需前体物质,是极低密度脂蛋白(VLDL)合成和分泌的重 要基底物质,当蛋氨酸胆碱缺乏时,VLDL的合成和分泌受损。而VLDL是运输内源性TG出肝细胞的主要形式,从而使TG在肝细胞内积聚迅速沉积,导致肝细胞脂肪变性。由于肝细胞的脂肪变性,线粒体对游离脂肪酸(free fatty acid,FFA)的摄入减少了,促使FFA的β-氧化增加,导致活性氧自由基的合成和脂质过氧化反应;另一方面,胆碱蛋氨酸的缺乏,可导致活性甲基减少,而活性甲基是谷胱甘肽等肝内抗氧化物合成的前体物质,因而MCD饮食使肝内抗氧化物严重缺乏,抗氧化防御屏障受损[4, 5]。脂质过氧化反应以及抗氧化屏障的损伤,可激活ROS系统和氧化应激反应,从而引起肝细胞的炎症反应和凋亡等,促进有毒物质合成并损伤线粒体和肝细胞[6]。因此MCD饮食诱导的NASH动物模型尤其适合抗氧化应激药物的研究。
四逆散由柴胡、白芍、枳实和甘草各等分组成,选药精炼,配伍严谨,后世医家对其进行化裁,创造出了诸如逍遥散、柴胡疏肝散等方剂,因而被誉为“疏肝祖方”。方中柴胡疏肝解郁、调畅气机,为君药;芍药柔肝、养阴、和血,与柴胡配合,助疏肝解郁之力,为臣药;枳实泻脾气、调运化,佐柴胡芍药;甘草调和诸药,缓急止痛,为使药。全方疏肝理脾、透解郁热、和中缓急、散收结合、升中有降。通过对非酒精性脂肪肝的中医药治疗文献分析,发现使用频率较高的药物中,柴胡、枳实、白芍均位列其中[7]。现代医学研究表明四逆散中各组成药物的主要成分均有抗氧化、保肝等多种药理活性[8, 9, 10]。因此四逆散极有可能通过抗氧化途径对非酒精性脂肪肝炎进行治疗的。
本实验通过MCD饮食诱导小鼠非酒精性脂肪肝炎模型,发现喂养MCD饮食4周后,小鼠血清ALT、AST值升高,TG显著下降,而肝脏TG急剧增加;肝脏病理切片结果显示肝细胞内充满大量脂肪空泡,肝细胞呈气球样变,炎性细胞浸润明显,呈灶状分布;肝脏组织中SOD含量降低以及MDA含量增加,说明符合MCD饮食诱导的非酒精性脂肪肝炎模型特征,证明模型成功,并且小鼠的抗氧化屏障遭到破坏。预防性给药组中发现,各用药组均能改善小鼠肝功能异常,并能降低肝脏中TG含量,其中以四逆散高剂量组作用最为突出,并且四逆散还能升高血清中TG,推测四逆散能促进肝脏中TG向外输出至血液中,从而降低肝脏TG含量,改善脂肪肝症状;同时各用药组既能增加肝脏SOD含量,同时降低MDA含量,增强小鼠抗氧化能力,改善体内过氧化物质的损害。
综上所述,高剂量的四逆散能调节血清和肝脏TG的分布,增加肝组织抗氧化能力,减少体内过氧化物损害,从而达到预防非酒精性脂肪肝炎的效果。中医复方多靶点、多途径的作用特点要求更进一步深入研究其具体的分子机制,而本实验正在继续研究中。
| [1] | 王 伟, 毕宏伟. 四逆散的临床应用进展 [J]. 中医药信息, 2006, 23(5): 56-57. |
| [2] | 张福华. 四逆散及其类方的研究 [D]. 济南: 山东中医药大学, 2005. |
| [3] | Lee G S, Yan J S, Ng R K, et al. Polyunsaturated fat in the methionine-choline-deficient diet influences hepatic inflammation but not hepatocellular injury [J]. J Lipid Res, 2007, 48: 1885-1896. |
| [4] | Anstee Q M, Goldin R D. Mouse models in non-alcoholic fatty liver disease and steatohepatitis research [J]. Int J Exp Pathol, 2006, 87: 1-16. |
| [5] | 吴 娜, 蔡光明, 何 群. 氧化应激与肝脏损伤 [J]. 世界华人消化杂志, 2008, 16: 3310-3315. |
| [6] | Schreuder T C, Verwer B J, van Nieuwkerk C M, et al. Nonalcoholic fatty liver disease: an overview of current insights in pathogenesis, diagnosis and treatment [J]. World J Gastroenterol, 2008, 14: 2474-2486. |
| [7] | 刘秀娥. 非酒精性脂肪肝的中医药治疗文献分析 [D]. 北京: 北京中医药大学, 2010. |
| [8] | 谢东浩, 蔡宝昌, 安益强, 等. 柴胡皂苷类化学成分及药理作用研究进展 [J]. 南京中医药大学学报, 2007, 23(1): 63-65. |
| [9] | 高小荣, 田庚元. 白芍化学成分研究进展 [J]. 中国新药杂志, 2006, 15(6): 416-418. |
| [10] | 张 红, 孙明江, 王 凌. 枳实的化学成分及药理作用研究进展 [J]. 中药材, 2009, 32(11): 1787-1790. |
 2014, Vol. 37
2014, Vol. 37


