2. 解放军94医院, 江西 南昌 330053
2. The 94 Hospital of PLA, Nanchang 330053, China
丹参最早收载于《神农本草经》,被列为上品,其功效主要是祛瘀止痛、活血通经、清心除烦等[4]。本课题组提取了丹参中的酚酸类成分,制备了冠心舒胶囊,动物体内的药理实验表明,冠心舒胶囊能很好的治疗心血管系统疾病[1, 2, 3, 4, 5, 6, 7]。在本研究中,建立大鼠血浆中丹参素的LC-MS/MS测定方法,并将该方法应用于冠心舒胶囊在大鼠体内的药动学研究。
1 仪器和材料沃特斯Premier XE三重四级杆串联质谱仪和Acquity超高效液相(美国沃特斯公司),沃特斯BEH C18 column(50 mm×2.1 mm,1.7 μm,美国沃特斯公司)。
丹参素(danshensu,DSS)对照品(批号134678-201101)和对羟基苯甲酸对照品(批号389213-201005)购自中国食品药品检定研究院,质量分数均为99.3%。冠心舒胶囊(批号20100912)由中药固体制剂制造技术国家工程研究中心制备。甲醇、乙腈(色谱级,美国Fisher公司),醋酸乙酯(分析纯,天津科密欧化学试剂有限公司),甲酸(色谱级,Sigma公司)。
SD大鼠,购自湖南斯莱克景达实验动物有限公司(合格证号SLK20110215)。
2 方法和结果 2.1 溶液的配制及样品的处理 2.1.1 系列标准曲线溶液的配制取丹参素约12.5 mg,精密称定,置25 mL量瓶中,用水溶解并稀释至刻度,摇匀,制备成质量浓度是500 μg/mL的储备液Ⅰ。稀释储备液Ⅰ,制备质量浓度是10 μg/mL的储备液Ⅱ。
将储备液Ⅱ逐级稀释,制备质量浓度分别是1、2、5、50、100、500、1 000 ng/mL的系列标准曲线溶液。将储备液II稀释,制备低、中、高3个质量浓度的质量控制(QC)溶液,质量浓度分别是2、500、800 ng/mL。所有溶液置于4 ℃冰箱保存。
2.1.2 内标溶液的制备取对羟基苯甲酸10.1 mg,精密称定,置20 mL量瓶中,用水溶解并稀释至刻度,摇匀,制备成质量浓度是505.0 μg/mL的储备液。取该储备液适量,用水稀释成质量浓度是1.0 μg/mL的内标工作溶液。
2.1.3 血浆样品的处理方法
取血浆样品60 μL,加入内标工作溶液60 μL,水60 μL,加10 μL的盐酸溶液(1 mol/L),涡旋1 min之后,加入1.5 mL的醋酸乙酯溶液,涡旋5 min后,5 000 r/min离心,取上清液,37 ℃氮气吹干,残留物用200 μL乙腈-水(80∶20)的混合溶液复溶,取5 μL进行LC-MS/MS分析。
2.2 测定条件 2.2.1 液相条件色谱柱为沃特斯UPLC BEH C18 column(50 mm×2.1 mm,1.7 μm,美国沃特斯公司)。流动相A是乙腈,流动相B是水(含0.1%甲酸),梯度程序如下:0 min,5%A;2.6 min,30%A;2.61 min,5%A;4.0 min,5%A。体积流量0.2 mL/min;柱温30 ℃;进样量5 μL。弱洗和强洗溶液分别是乙腈-水-0.1% 甲酸(5∶95∶0.1)和乙腈-水-0.1% 甲酸(95∶5∶0.1)。
2.2.2 质谱条件离子源:ESI源,负离子检测,高纯氮气用作脱溶剂气(600 L/h)和锥孔气(50 L/h),气体温度380 ℃,离子源温度是120 ℃,毛细管电压2 700 V,锥孔电压是22 V。以多反应监测(multiple reaction monitoring,MRM)为扫描模式,用于定量反应的离子分别是197→135(丹参素,碰撞能量是17 eV),137→93(对羟基苯甲酸,碰撞能量是22 eV)。二级扫描图见图 1。
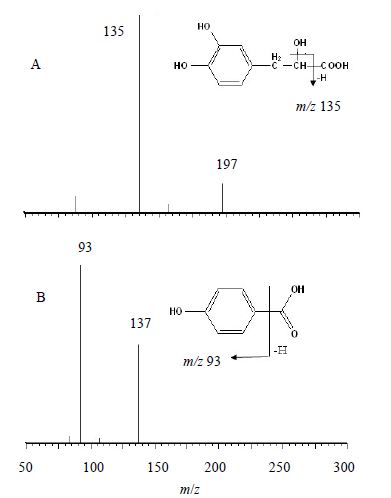 | 图 1 丹参素(A)和对羟基苯甲酸(B)的MRM图Fig. 1 Representative MRM chromatograms of DSS (A) and p-hydroxybenzoic acid (B) |
分别取6只大鼠的空白血浆60 μL,除不加内标外(补加相应体积的甲醇),其余按照2.1.3操作,进行LC-MS/MS分析,获得空白血浆色谱图,见图 2A;将最低定量限的丹参素和内标加入到空白血浆中,按照2.1.3操作,获得色谱图,见图 2B;取大鼠给药后的血浆60 μL,按照2.1.3操作,获得样品色谱图,见图 2C。由图 2可知,空白血浆中内源性物质不干扰丹参素和内标的测定。
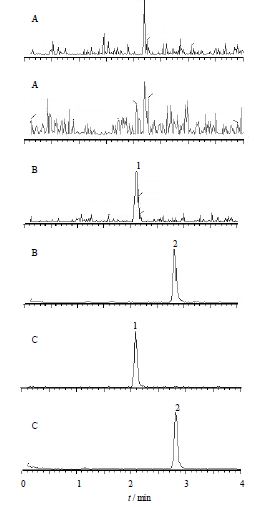 | 1-丹参素;2-对羟基苯甲酸 1-DSS; p-hydroxybenzoic acid 图 2 空白血浆(A)、空白血浆加最低定量限的丹参素和内标(B)及大鼠给予冠心舒胶囊后的血浆(C)LC-MS/MS谱图 Fig. 2 LC-MS/MS chromatogram of blank rat plasma sample(A), blank plasma spiked with DSS at LLOQ and IS(B), and rat plasma sample following an oral dose of Guanxinshu Capsule (C) |
取空白血浆60 μL,分别加入系列标准溶液60 μL,按照2.1.3操作,每一浓度进行双样本分析,记录色谱图,连续记录3 d。以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权最小二乘法进行回归运算,得回归方程如下,丹参素:Y=0.007 2X-0.008 5,r=0.9956,线性范围1.0~1 000.0 ng/mL。信噪比(S/N)为10时丹参素的最低定量限是1.0 ng/mL。
2.3.3 精密度和准确度取空白血浆60 μL,将60 μL的水换成相应体积的QC样品,其余按照2.1.3操作,连续测定3 d,并与标准曲线同时进行,计算QC样品的测得浓度,与配制浓度对照,计算精密度与准确度,结果见表 1。
| 表 1 LC-MS/MS法测定丹参素的精密度和准确度 Table 1 Precision and accuracy of DSS in rat plasma by LC-MS/MS |
取空白血浆60 μL,将60 μL的水换成相应体积的QC样品,其余按照2.1.3操作,制备低浓度和高浓度的质量控制血浆样品,6样本平行分析,峰面积是A1;另取空白血浆60 μL,按照2.1.3操作,残留物用丹参素QC样品的溶液溶解,制成的样品浓度分别是丹参素(2.0、800.0 ng/mL)进样分析,获得峰面积是A2。以每一浓度正常提取样品所得的峰面积A1,与未提取样品峰面积A2均值的比值计算提取回收率。内标按照同样的方法测定回收率。丹参素和内标的提取回收率分别是 (87.1±6.6)%和(89.3±5.4)%。
2.3.5 基质效应丹参素低浓度和高浓度的QC样品分别进样分析,记录峰面积A3。与2.3.4制备的血浆样品的峰面积A2进行比较,以同一质量浓度血浆基质样品的峰面积A2和无基质样品的峰面积A3的比值计算基质效应。丹参素的平均基质效应是(106.5±3.7)%。
2.3.6 稳定性研究考察处理后的血浆样品4 ℃放置24 h的稳定性,考察血浆样品在3个冻融循环(−80~22 ℃),长期稳定性(−80 ℃放置30 d)和室温放置2 h的稳定性。实验结果表明,样品在上述条件下是稳定的。见表 2。
| 表 2 丹参素在不同条件下的稳定性 Table 2 Stability of DSS in human plasma under different conditions |
6只SD大鼠,给药前禁食过夜,给水,ig给予冠心舒胶囊内容物的羧甲基纤维素钠混悬液,在5.0、15.0、30.0 min和1、1.5、2.0、3.0、4.0、6.0、8.0、12.0、24.0 h眼眶取血0.2 mL,放置在涂有肝素的离心管中,4 000 r/min离心10 min,取血浆,放在−80 ℃冰箱中待测。
2.4.2 血浆样品测定按照2.1.3进行血浆样品的处理,同时制备丹参素低、中、高3个质量浓度的QC样品,每一质量浓度进行双样本分析。以当日的标准曲线计算QC样品及各时间点样品中丹参素的质量浓度,质量控制样品测定结果的RE在±15%之内。血药质量浓度-时间曲线见图 3。
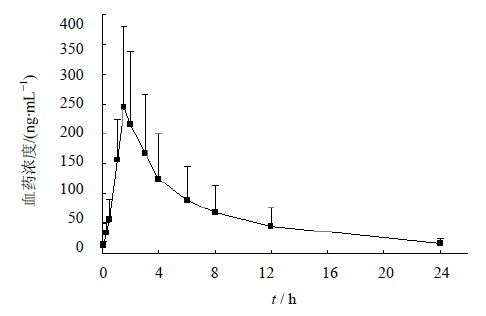 | 图 3 大鼠口服冠心舒胶囊后的血药浓度-时间曲线Fig. 3 Blood drug concentration-time profiles of DSS following oral administration of Guanxinshu Capsule |
丹参素大鼠体内的最大血药浓度(Cmax)和达峰时间(Tmax)直接由实测值读出。由血药浓度-时间曲线末四点做半对数图,以lgC-t按最小二乘法进行线性回归,所得斜率的绝对值即为消除速率常速(ke);消除半衰期(t1/2)为ln2/ke。药时曲线下面积(AUC0-t)由梯形法求得。Cmax和Tmax分别是245.7 ng/mL和1.5 h,AUC0-t是1582.1 ng·h/mL,消除半衰期(t1/2)是2.1 h。
3 讨论本文建立了HPLC-MS/MS法测定大鼠血浆中的丹参素浓度。本方法灵敏度高,满足了血浆样品中低浓度成分的测定。液液萃取的样品制备方法提高了样品的洁净度,降低了基质效应。最后本方法成功应用于冠心舒胶囊大鼠体内的药动学研究,为中药新药的开发提供了支持。
| [1] | Lu T, Yang J L, Gao X M, et al. Plasma and urinary tanshinol from salvia miltiorrhiza (Danshen) can be used as pharmacokinetic markers for cardiotonic pills, a cardiovascular herbal medicine [J]. Drug Metab Dispos, 2008, 36: 1578-1586. |
| [2] | Luo X J, Bi K S, Zhou S Y, et al. Determination of danshensu, a major active compound of salvia miltiorrhiza in dog plasma by HPLC with fluocescence detection [J]. Biomed Chromatogr, 2001, 15: 493-496. |
| [3] | Chang B B, Zhang L, Cao W W, et al. Pharmacokinetic interactions induced by content variation of major water-soluble components of Danshen preparation in rats [J]. Acta Pharmacol Sin, 2010, 31: 638-646. |
| [4] | Guo X R, Chen X H, Li L, et al. LC-MS determination and pharmacokinetic study of six phenolic components in rat plasma after taking traditional Chinese medicinal- preparation: Guanxinning lyophilized powder for injection [J]. J Chromatogr B, 2008, 873: 51-58. |
| [5] | Li X H, Yu C, Cai Y B, et al. Simultaneous determination of six phenolic constituents of danshen in human serum using liquid chromatography tandem mass spectrometry [J]. J Chromatogr B, 2005, 820: 41-47. |
| [6] | Liu Y, Li X R, Li Y H, et al. Simultaneous determination of danshensu, rosmarinic acid, cryptotanshinone, tanshinone IIA, tanshinone I and dihydrotanshinone I by liquid chromatographic-mass spectrometry and the application to pharmacokinetics in rats [J]. J Pharm Biomed Ana, 2010, 53: 698-704. |
| [7] | Wang S P, Liu L, Wang L L, et al. Simultaneous determination of six hydrophilic components in rat plasma after oral administration of Jitai tablet by liquid chromatography- electrospray ionization-tandem mass spectrometry: application to a pharmacokinetic study [J]. J Chromatogr B, 2013, 912: 75-84. |
 2014, Vol. 37
2014, Vol. 37


