小胶质细胞(microglia)是中枢神经的巨噬细胞,其最显著特点是对外界环境刺激敏感,在脑缺血、神经退行性疾病、感染等病理条件下,许多微环境因子的变化可使小胶质细胞迅速激活。显著上调许多细胞因子的分泌水平,其中少部分为神经营养因子或抗炎因子(如BDNF、IL-10等),能够促进神经元的存活或产生抗炎作用;而大部分为促炎因子(如TNF-α、IL-1β、IL-6等),还有趋化因子、活性氧簇(ROS)等,能直接损伤神经元或引起其他继发性损伤。抑制小胶质细胞过度活化所引起的炎症反应可以作为治疗和缓解神经退行性疾病和脑损伤的重要途径之一[1, 2]。
延龄草苷是很多种中药含有的单体成分,如蒺藜、延龄草等。本实验采用脂多糖(LPS)激活小胶质细胞,考察其抗神经炎症的作用机制。
1 材料与方法 1.1 材料 1.1.1 试剂小胶质细胞株BV-2(北京协和医科大学);延龄草苷(天津中新药业集团股份有限公司,CAS: 14144-06-0);DMEM培养基(C11995,Gibco);双抗(15140,Gibco);胎牛血清(16000-044,Gibco);0.05%胰蛋白酶(25300062,Gibco);一氧化氮检测试剂盒(S0021,碧云天);Cell Counting Kit-8(CK04,同仁化学);LPS(S1732,碧云天);TNF-α Elisa试剂盒(MTA00B,R&D,USA),米诺环素(Sigma,CAS:13614-98-7)。
1.1.2 仪器FORMA3111型CO2恒温培养箱(美国Thermo公司),TE200倒置相差显微镜(日本Nikon公司),7500型定量PCR仪(美国ABI公司),64R型低温高速离心机(美国Beckman公司),DU—800紫外分光光度计(DNA/Protein Analyzer,美国Beckman公司)。
1.2 分组正常对照组(DMSO,终体积浓度1∶1 000)、LPS组(终质量浓度0.1 μg/mL)、延龄草苷(终浓度为10、5、1 μmol/L)加LPS组、阳性对照米诺环素(终浓度为10 μmol/L)加LPS组。
1.3 延龄草苷对小胶质细胞活力的影响完全DMEM培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)培养小鼠小胶质细胞株BV-2,调整细胞浓度为4×105个/mL,接种到48孔培养板内过夜,加入不同浓度的延龄草苷(1、5、10 μmol/L)培养24 h后,弃上清,加入CCK-8(终体积浓度1∶10),继续孵育0.5 h,于450 nm波长处测定吸光度(A)值。
1.4 延龄草苷对小胶质细胞分泌炎性介质的影响完全DMEM培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)培养小鼠小胶质细胞株BV-2。调整细胞浓度为4×105个/mL,接种到48孔培养板内过夜,加入不同浓度的延龄草苷(终浓度为1、5、10 μmol/L)预孵育0.5 h,然后加入LPS(终质量浓度0.1 μg/mL)进行刺激。细胞加入LPS后培养24 h后收集各处理组细胞培养上清液,用Greiss法检测NO的浓度。Elisa法检测细胞因子TNF-a含量。操作步骤按试剂盒说明书(R&D Systems公司)完成。
1.5 延龄草苷对小胶质细胞TNF-α、IL-1β、IL-6、iNOS、COX-1、COX-2 mRNA表达的影响小鼠小胶质细胞系BV-2加入延龄草苷(10 μmol/L)预孵育0.5 h,然后加入LPS(0.1 μg/mL)进行刺激8 h。用PBS洗1次,以Trizol试剂提取细胞总RNA。采用TaqMan Reverse Transcription Reagents试剂盒将总RNA(1.5 μg)反转录为cDNA(20 μL体系)。取1 μL的cDNA产物用作定量PCR扩增的模板,看家基因GAPDH作为内参。数据采用2−△△CT相对定量法分析,数值用x±s表示。
1.6 统计学处理所有试验数据采用SPSS软件进行统计,实验组与对照组间比较用t检验,组间差异性比较采用单因素方差分析。
2 结果 2.1 CCK-8检测延龄草苷对小胶质细胞活力的影响与对照组相比,阳性药米诺环素没有细胞毒作用;延龄草苷(1~10 μmol/L)没有细胞毒作用(图 1)。
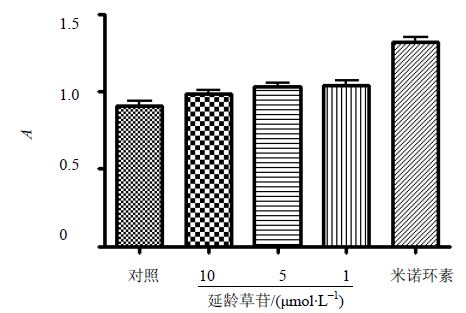 | 图 1 延龄草苷对小胶质细胞活力的影响Fig. 1 Effect of trillin on microglia viability |
与对照组相比,LPS组能增加NO的释放;与LPS组相比,阳性对照组能明显抑制NO的释放,延龄草苷也能抑制NO的释放,并且在一定范围内呈剂量相关关系,见图 2。
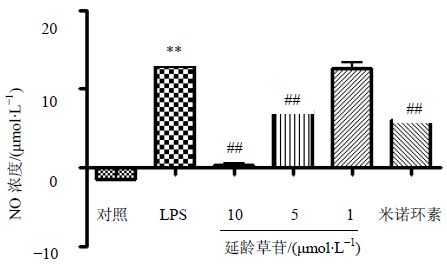 | 与对照组比较:**P<0.01;与模型组比较:##P<0.01 **P<0.01 vs control group; ##P<0.01 vs LPS group 图 2 延龄草苷对活化的小胶质细胞分泌NO的影响Fig. 2 Effect of trillin on NO release in active microglia cells |
与对照组相比,LPS组能显著提高BV-2细胞对TNF-α的分泌;与LPS组相比,延龄草苷能明显抑制TNF-α的分泌,并且在一定范围内呈剂量相关关系,见图 3。
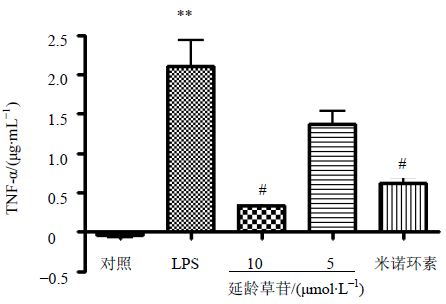 | 与对照组比较:**P<0.01;与LPS组比较:#P<0.05 **P<0.01 vs control group; #P<0.05 vs LPS group 图 3 延龄草苷对活化的小胶质细胞分泌TNF-α的影响Fig. 3 Effect of trillin on TNF-α release in active microglia |
与对照组比较,LPS组可以显著提高BV-2细胞中TNF-α、IL-1β、IL-6、iNOS、COX-2 mRNA的表达;与LPS组比较,延龄草苷(10 μmol/L)可以不同程度降低LPS诱导的神经炎性因子TNF-α、IL-1β、IL-6、iNOS、COX-2 mRNA的表达,对COX-1 mRNA的表达没有抑制作用,见图 4。
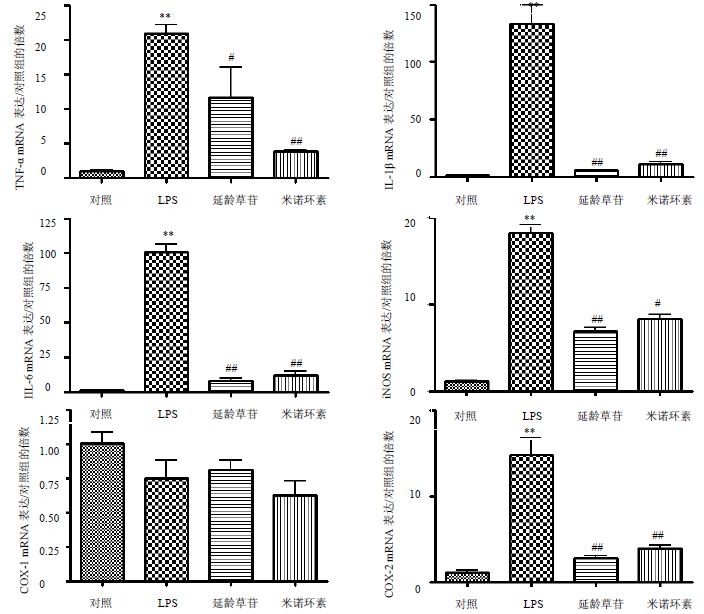 | 与对照组比较:**P<0.01;与LPS组比较:#P<0.05, ##P<0.01 **P<0.01 vs control group; #P<0.05, ##P<0.01 vs LPS group 图 4 延龄草苷对LPS诱导的BV-2细胞炎性因子mRNA的表达量的影响Fig. 4 Effect of trillin on mRNA expression of inflammatory factor in BV2 cells induced by LPS |
延龄草苷1~10 μmol/L能抑制LPS诱导的小胶质细胞NO的产生,能显著抑制促炎因子TNF-α、IL-1β、IL-6、iNOS、COX-2等mRNA的表达。
小胶质细胞是中枢神经系统的巨噬细胞,具有免疫防御和炎症反应[3]。在生理条件下,休眠的小胶质细胞有平衡神经系统和支持神经细胞的重要作用。抑制小胶质细胞过度活化所引起的炎症反应可以作为治疗和缓解神经退行性疾病和脑损伤的重要途径之一[1, 2]。脂多糖能激活休眠的小胶质细胞产生促炎介质和神经毒性。活化的小胶质细胞通过吸引活化的T细胞、单核细胞、嗜中性粒细胞进入神经系统而产生基质金属蛋白酶和趋化因子破坏血脑屏障[4]。研究表明,延龄草苷在不影响细胞活力的前提下,能有效抑制小胶质细胞NO的释放,并且能明显抑制炎性基因的表达。因此,延龄草苷抑制小胶质细胞炎症介质的释放可能是其发挥神经保护作用的机制之一。
| [1] | Giovannini M G, Scali C, Prosperi C. et al. Beta-amyloid-induced inflammation and cholinergic hypofunction in the rat brain in vivo: involvement of the p38MAPK pathway [J]. Neurobiol Dis, 2002. 11(2): 257-274. |
| [2] | van Rossum D, Hanisch U K. Microglia [J]. Metab Brain Dis, 2004, 19(3-4): 393-411. |
| [3] | Kim S S, Kong P J, Kim B S, et al. Inhibitory action of minocycline on lipopolysaccharide-induced release of nitric oxide and prostaglandin E2 in BV2 microglial cells [J]. Arch Pharm Res, 2004, 27(3):314-318. |
| [4] | Li J, Zhang S, Lu M. Hydroxysafflor yellow A suppresses inflammatory responses of BV2 microglia after oxygen-glucose deprivation [J]. Neurosci Lett, 2013, 535: 51-56. |
| [5] | Ladecola C, Anrather J. The immunology of stroke: from mechanisms to translation [J]. Nat Med, 2011, 17(7): 796-808. |
 2014, Vol. 37
2014, Vol. 37



