2. 南方医科大学附属郑州人民医院 肿瘤内科, 河南 郑州 450003
2. Department of Medical Oncology, People's Hospital of Zhengzhou Affiliated to Southern Medical University, Zhengzhou 450003, China
氟尿嘧啶是进展期胃癌化疗的基础药物,通过抑制DNA和RNA的合成发挥抑制肿瘤的作用,有研究表明持续静脉滴注效果更优[1]。但老年患者由于生理机能的改变对化疗药物的耐受性较差。卡培他滨和替吉奥是模拟持续的两种氟尿嘧啶类口服药物,不良反应相对较小,耐受性好。目前卡培他滨联合铂类已列入2013年胃癌NCCN指南,而替吉奥在疗效和安全性方面是否优于卡培他滨,国内外的临床研究结果不一。本研究通过meta分析方法比较替吉奥与卡培他滨在老年晚期胃癌的疗效与安全性,为临床应用提供参考。
1 资料与方法 1.1 文献来源2名文献工作者共同制定文献检索策略,分别独自检索,中文检索以卡培他滨and替吉奥and老年and胃癌为关键词,检索中国知网,维普数据库、万方资源数据和中国生物医学文献数据库系统。英文检索以capecitabine and S-1 and elderly and gastric cancer为关键词,检索Cochrane library,pubmed和ovid(elsevier)数据库系统。语种限定为中文和英文,时间均从建库至2013年12月,并手工检索相关杂志、会议论文等。
1.2 纳入标准 1.2.1 研究类型公开发表的随机对照试验(RCT),无论是否采用盲法。
1.2.2 研究对象经病理或细胞学证实为晚期胃癌患者或不能手术的胃癌患者;年龄>65岁(或文献中注明老年患者);有可评价的病灶;ECOG评分为0~2分;血常规、肝肾功及心电图等均无明显异常。
1.2.3 干预措施试验组:替吉奥±奥沙利铂化疗;对照组:卡培他滨±奥沙利铂化疗。
1.2.4 结局指标有效率、不良反应发生率。
1.3 排除标准非RCT研究;综述性文献;同时合并其他治疗的研究;重复发表的文献。
1.4 资料提取与质量评价两名研究者独立进行文献选择和资料提取工作,如遇分歧由第三方最终决定解决。采用Cochrane系统评价手册5.1版对纳入的临床试验进行方法学质量评价:包括随机方法、盲法、分配隐藏、结果数据完整性、有无选择性报告研究结果及有无其他偏倚来源。
1.5 统计学方法对收集的数据采用RevMan 5.0软件进行Meta分析,纳入的研究采用卡方检验分析各资料结果的异质性,并进行定量分析,I2>50%表示研究结果存在异质性;异质性不显著时,应用固定效应模型进行分析,反之采用随机效应模型。计数资料采用相对危险度(RR),均以95%可信区间表示,检验水平P=0.05。研究中存在低质量研究时进行敏感性分析。
2 结果 2.1 文献检索结果本研究共检出39篇相关文献,其中中文29篇,英文10篇;去除重复文献后共纳入18篇,通过标题及摘要后,初步纳入相关研究8篇。再进行全文筛查,排除非RCT研究,最终纳入研究6篇[2, 3, 4, 5, 6, 7](中文5篇,英文1篇)。
2.2 纳入研究特点与研究方法质量评价最终纳入6项研究,共332例研究对象,其中替吉奥±奥沙利铂166例,卡培他滨±奥沙利铂166例。6项研究质量评价均为偏倚风险未知。纳入研究的基本情况及质量评价见表 1、2。
| 表 1 纳入研究的基本情况 Table 1 Basic information of included trials |
| 表 2 纳入研究的质量评价 Table 2 Quality evaluation of included trials |
6项研究均报道了有效率,异质性检验P>0.05,I2=0%,说明结果间效应值差异不存在异质性,采用固定效应模型分析,结果见图 1。Meta分析结果显示,替吉奥单药与卡培他滨单药的有效率相比,差异无显著性(RR=1.19,P>0.05,95% CI:0.81~1.74);替吉奥+奥沙利铂组的有效率与卡培他滨+奥沙利铂比较,差异无显著性 (RR=0.99,P>0.05,95% CI:0.67~1.48)。总有效率替吉奥组与卡培他滨组相比,差异无显著性(RR=1.10,P>0.05,95%CI:0.84-1.45)。森林图与漏斗图分析时发现不对称,提示可能存在偏倚;可能与纳入研究均为亚洲患者有关。结果见图 1。
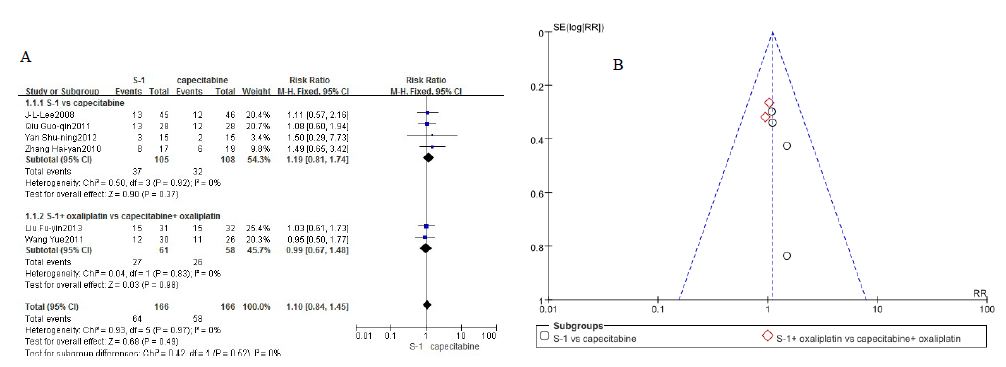 | 图 1 有效率的Meta分析森林图(A)和漏斗图(B)Fig. 1 Forest plot (A) and funnel plot (B) for meta-analysis of response rate |
在排除效应尺度较小的2个研究[5, 7]数据进行敏感性分析,未改变结果方向(RR=1.07,P>0.05,95%CI:0.65-1.77),提示Meta分析结果稳定(图 2)。
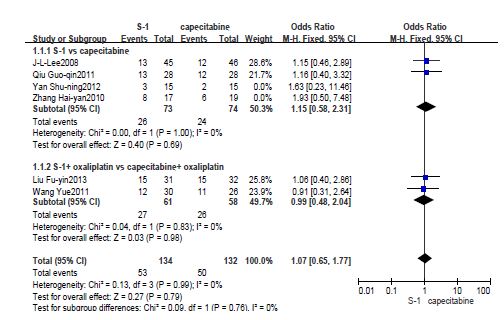 | 图 2 有效率敏感性分析森林图Fig. 2 Sensitivity analysis forest plot of response rate |
联合奥沙利铂化疗时,3~4度不良反应主要有白细胞减少、粒细胞减少、血小板下降、贫血、恶心呕吐、腹泻、HFS等,替吉奥组与卡培他滨组不良反应发生率差异无显著性;单药化疗组3~4度HFS发生率替吉奥明显低于卡培他滨(RR=0.11,P<0.05,95% CI:0.01~0.87)。见表 3。
| 表 3 3~4度不良反应的meta分析 Table 3 Meta-analysis of grade 3/4 toxicities |
尽管胃癌的发生率在过去的几十年中有所下降,但仍然是中国、韩国和日本等国家死亡率较高的癌症之一,5年生存率仅有20%[8]。早期胃癌患者,手术切除加或不加辅助化疗已成为标准的治疗方案,而晚期胃癌患者,化疗通常是有效的治疗选择[9]。氟尿嘧啶类药物多年来一直作为胃癌治疗的基础药物,通常与铂类联用,有时还可加用蒽环类药物或紫杉类药物[10, 11];然而老年癌症患者通常伴有合并症和器官损伤等生理机能的减退,选择合适的治疗方案比较困难[12]。由于伦理学原因,大型随机对照临床试验一般不纳入老年患者,仅有一小部分关于老年胃癌患者化疗方案应用的数据。本研究拟比较两种口服药物在老年胃癌患者中的有效性与安全性。
奥沙利铂为第3代铂类化合物,与顺铂相比,其不需水化治疗,耐受性更好[13];临床试验研究表明在老年患者中,奥沙利铂联合氟尿嘧啶疗效明显优于顺铂[14]。卡培他滨和替吉奥均为5-氟尿嘧啶的前体药物,研究表明与静脉应用5-氟尿嘧啶相比,口服药物等效而且在老年患者中应用比较安全,剂量调整更为方便[15, 16]。奥沙利铂+卡培他滨在2013年NCCN胃癌指南中作为一线可选化疗方案之一;由于CYP2A6基因多态性导致替吉奥在东西方人群中的剂量耐受性、安全性甚至有效性有明显差 异[17],替吉奥并未被列入NCCN胃癌指南中;但替吉奥在日本早已作为治疗晚期胃癌的一线化疗药 物[18]。替吉奥为替加氟、吉美嘧啶和奥替拉西钾1∶0.4∶1的复合物。替加氟在肝脏中经过CYP2A6酶代谢成5-氟尿嘧啶;吉美嘧啶可抑制二氢嘧啶脱氢酶,使替加氟转变成5-氟尿嘧啶的浓度增加;奥替拉西钾能够特异性抑制乳清酸核糖转移酶,阻断5-氟尿嘧啶在肠道的磷酸化,从而减少胃肠道不良反应[19]。其组分也很好的阐释了其高效低毒的特性。
本次纳入6项研究的Meta分析结果显示,替吉奥在老年晚期胃癌患者中的有效率与卡培他滨相当;亚组分析显示,替吉奥单药或联合奥沙利铂治疗的有效率与卡培他滨单药或联合奥沙利铂均无显著性差异。从结果可看出,联合奥沙利铂化疗时有效率均高于单药化疗,可能与奥沙利铂与氟尿嘧啶类药物有协同作用有关。老年患者化疗关注的另一个焦点是安全性和耐受性,本次Meta分析结果显示,3度以上不良反应(联合奥沙利铂化疗组)主要有白细胞下降、中性粒细胞下降、血小板减少、贫血、恶心呕吐、腹泻、HFS等,替吉奥与卡培他滨不良反应发生率差异无显著性;可能与纳入研究的数目较少、例数较少有关。单药组3度以上不良反应除上述外,还有中性粒细胞减少伴发热、乏力、厌食、腹痛、口腔炎、转氨酶升高、高胆红素血症、色素沉着和周围神经炎等症状,其中3度以上HFS发生率替吉奥显著低于卡培他滨(RR=0.11,95% CI:0.01~0.87,P=0.04)(邱国钦文献中卡培他滨组给予维生素B6 30 mg tid预防卡培他滨的HFS),其他不良反应发生率差异无显著性。
本次纳入的6项研究中4项为单药研究,另外2项为联合奥沙利铂化疗的研究。6项研究中有2项研究有长期生存指标PFS及OS,但一项为单药研究,一项为联合奥沙利铂化疗研究,无法进行远期效果的比较。纳入的研究中有1项来自韩国,其余均来自中国,无来自西方国家的研究数据,可能原因是CYP2A6基因多态性导致的替吉奥在西方人群中耐受性较差、剂量较小从而导致有效性较低,在西方人群中的研究相对较少。6项研究中,所有文献研究质量评定均为未知风险,有4项研究未描述分配隐藏、盲法,因此本Meta存在一定的选择性偏倚风险。但目前肿瘤临床试验对盲法的要求相对较低,有效率是比较客观的衡量指标,故本分析结果尚稳定可靠,可为临床制定治疗方案提供循证医学证据。
本Meta分析表明,对老年晚期胃癌患者无论是否联合奥沙利铂化疗,替吉奥与卡培他滨在有效率方面疗效是相当的,但在安全性方面,替吉奥不良反应发生率更低;对于中国患者,替吉奥是老年晚期胃癌患者一线化疗的较佳选择。由于本Meta分析纳入研究的方法学质量、替吉奥的生产商、用药疗程、随访周期的差异,同时纳入研究的样本量较少,上述结论尚需要更多大样本、多中心的随机对照临床试验来证实。
| [1] | Wagner A D, Grothe W, Haerting J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data [J]. J Clin Oncol, 2006, 24: 2903-2909. |
| [2] | 王 月, 蔡 哲, 成 建, 等. 替吉奥联合奥沙利铂治疗老年进展期胃癌的疗效 [J]. 中国老年学杂志, 2011, 31: 1504-1505. |
| [3] | 刘福银, 孟丽娟, 王 峻, 等. 替吉奥联合奥沙利铂与卡培他滨联合奥沙利铂一线治疗老年晚期胃癌的疗效分析 [J]. 中国医药科学, 2013, (3): 14-17. |
| [4] | Lee J L, Kang Y K, Kang H J, et al. A randomized multicentre phase Ⅱ trial of capecitabine vs S-1 as first-line treatment in elderly patients with metastatic or recurrent unresectable gastric cancer [J]. Br J Cancer, 2008, 99: 584-590. |
| [5] | 章海燕, 孙立柱. 国产替吉奥胶囊单药一线治疗老年晚期胃癌临床研究 [J]. 中国医学创新, 2010, (7): 94-96. |
| [6] | 邱国钦, 许丽贞, 林智才, 等. 替吉奥治疗老年进展期胃癌的临床观察 [J]. 中国肿瘤临床与康复, 2011, 18: 61-63. |
| [7] | 闫树宁. 替吉奥与卡培他滨治疗老年晚期胃癌30例疗效比较 [J]. 中国老年学杂志, 2012, 32: 2382-2383. |
| [8] | Crew K D, Neugut A I. Epidemiology of gastric cancer [J]. World J Gastroenterol, 2006, 12: 354-362.Casaretto L, Sousa P L R, Mari J J, et al. Chemotherapy versus support cancer treatment in advanced gastric cancer: a meta-analysis [J]. Braz J Med Biol Res, 2006, 39: 431-440. |
| [9] | Vanhoefer U, Rougier P, Wilke H, et al. Final results of a randomized phase III trial of sequential high-dose methotrexate, fluorouracil, and doxorubicin vs etoposide, leucovorin, and fluorouracil vs infusional fluorouracil and cisplatin in advanced gastric cancer: a trial of the European Organization for Research and Treatment of Cancer Gastrointestinal Tract Cancer Cooperative Group [J]. J Clin Oncol, 2000, 18: 2648-2657. |
| [10] | Van Cutsem E, Moiseyenko V M, Tjulandin S, et al. V325 Study Group Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group [J]. J Clin Oncol, 2006, 24: 4991-4997. |
| [11] | Lichtman S M, Wildiers H, Chatelut E, et al. International society of geriatric oncology chemotherapy taskforce: evaluation of chemotherapy in older patients-an analysis of the medical literature [J]. J Clin Oncol, 2007b, 25: 1832-1843. |
| [12] | Zaniboni A, Meriqqi F. The emerging role of oxaliplatin in the treatment of gastric cancer [J]. J Chemother, 2005, 17: 656-662. |
| [13] | Al-Batran S E, Hartmann J T, Probst S, et al. Phase III trial in metastatic gastroesophageal adenocarcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: a study of the Arbeitsgemeinschaft Internistische Onkologie [J]. J Clin Oncol, 2008, 26: 1435-1442. |
| [14] | Kang Y, Kang W K, Shin D B. Randomized phase III trial of capecitabine/cisplatin (XP) versus continuous infusion of 5FU/cisplatin (FP) as first-line therapy in patients with advanced gastric cancer: efficacy and safety results [J]. J Clin Oncol, 2006, 24(18-suppl): LBA4018. |
| [15] | Boku N, Yamamoto S, Shirao K. Randomised phase III study of 5-fluorouracil alone versus combination of irinotecan and cisplatin versus S-1 alone in advanced gastric cancer (JCOG9912) [J]. J Clin Oncol, 2007, 25(18S): LBA4513. |
| [16] | Blum M, Suzuki A, Ajani J A. A comprehensive review of S-1 in the treatment of advanced gastric adenocarcinoma [J]. Future Oncol, 2011, 7: 715-726. |
| [17] | Sato A, Ito T, Tomita T, et al. Chemotherapy of gastric cancer-a review of clinical trials in Japan [J]. Gan To Kagaku Ryoho, 2002, 29: 1522-1531. |
| [18] | Van Groeningen C J, Peters G J, Schornagel J H, et al. Phase I clinical and pharmacokinetic study of oral S-1 in patients with advanced solid tumors [J]. J Clin Oncol, 2000, 18: 2772-2779. |
 2014, Vol. 37
2014, Vol. 37

