2. 天津市新药安全评价研究中心, 天津 300193
2. Tianjin Center for New Drug Safety Evaluation and Research, Tianjin 300193, China
抗体与药物偶联技术的概念产生于1970年[1]。随着偶联技术和靶向技术的进步,以及对抗体认识的发展,到本世纪初,已经产生几个具有治疗特点的抗体药物偶联物用于临床,开创了抗体药物的新天地。在癌症治疗中,化疗已经成为一个重要治疗手段。然而,细胞毒性试剂对肿瘤细胞缺少特异性,导致严重的副反应。抗体-药物偶联物(antibody drug conjugate,ADC),也被称为免疫偶联物,是靶向抗癌药物的一种。
ADC将单克隆抗体和高效细胞毒素完美地结合到一起,充分利用了前者靶向、选择性强以及后者活性高的优点,同时又消除了前者疗效偏低和后者副作用偏大等缺陷。ADC包括靶头(targeting moiety)抗体、间隔子(spacer)、化学连接子(chemical linker)和药物如细胞毒药物(drug)等4部分(图 1),其中靶头(如抗体)是ADC的制导系统,能够靶向性地把效应分子输送到肿瘤细胞,有效地提高了抗体本身对癌细胞的杀伤力。通过靶向特定抗原,ADC有效地渗透到肿瘤组织,并被肿瘤细胞吞噬进入酶溶体,释放效应分子。在新型靶向偶联药物设计中,靶头除抗体(antibody)外,还可以是肽(peptide)、适体(aptamer)、叶酸等(folic acid),间隔子可以选择多聚物(polymer)、可裂解肽酶(enzyme cleavable peptide)等,化学链接子可以选择酯(ester)、酰胺(amide)、二硫物(disulfine)、硫醚(thioether)、亚胺肟(oximi)、亚胺(imine)等。但在命名时,将要根据靶头所谓类型来定,如抗体药物偶联(ADC),肽偶联药物(PDC)等。目前研究最多的是ADC。
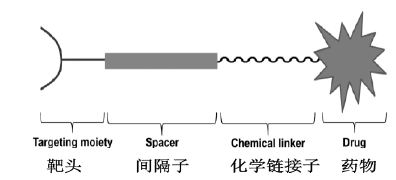 | 图 1 抗体-药物偶联物的组成 Fig. 1 Antibody drug conjugate |
尽管ADC新药的开发已经获得前所未有的成功,但技术上仍然有待进一步优化,其中包括被肿瘤细胞吞噬的效率、细胞毒素的活性以及效应分子的释放等。抗体-药物偶联物由药物、抗体以及偶联抗体和化学的连接子组成。当抗体和癌细胞表面的抗原特异性结合时,抗体药物偶联物即可将药物成功靶向作用部位。抗体-药物偶联物的内在化过程和组成部分在设计和应用抗体偶联物到广泛的疾病模型中至关重要。
ADC是由具有靶向特异性的单抗和具有高毒性的小分子结合而成的新药,比原来的单抗和小分子药物具有特异性高和毒性低的特征。由于这种不均匀性,用于ADC的药动学研究的生物分析方法的建立和选择具有挑战性。同时具有大分子抗体和小分子组分生物分析方法的组合通常对了解ADC的体外、体内过程,认识药物运送到作用部位和暴露反应关系十分重要。本文就ADC的药动学研究进展和难点予以介绍,以期与从事该类药物的研究者一起讨论分析。
1 研发的趋势和挑战以前制备ADC药物的方法具有多种混合效果,部分抗体会比其他抗体携带更多的药物,因此很难确定最佳的药物用量。在2008年7月出版的《自然:生物技术》期刊上,Junutula等[2]报告一种具有癌症治疗潜力的新型ADC技术,有望减少药物对健康细胞的伤害,副作用也更小。在敏锐识别癌细胞的同时,以肿瘤为靶标的抗体也能忽略正常细胞,抗体的这种特征被用于靶向药物输送的研发中,研究人员希望将化学治疗药缚束到这种抗体上,形成ADC药物。与以前的方法相比,其对健康细胞的副作用就更少。他们在抗体的结构上修改了特别位点以促进药物的缚束,同时又不会影响抗体的整体结构或识别癌细胞的能力。对模式小鼠的研究显示,这种新型ADC药物比传统的ADC药物更有效,而且这种新型的ADC药物对兔和猴具有更好的耐受性。由于ADC可特异性地将毒性药物靶向恶性病变区域而不会对正常组织产生不良影响的潜力,因而极受瞩目。2013年2月,美国FDA批准ADC新药Kadcyla(ado-曲妥珠单抗emtansine)上市,用于治疗HER2阳性的转移性乳腺癌。同年6月,中国浙江医药集团也宣布将利用引进的Ambrx公司技术,共同开发靶点为HER2的ADC药物。
ADC属于靶向抗癌药物的一种。由单抗与有治疗作用的物质(放射性同位素、毒素与药物等)和“弹头”构成的“导弹药物”(guided missile drug),其中包括放射免疫偶联物、免疫毒素、化学免疫偶联物,此外还有酶结合单抗偶联物、光敏剂结合单抗偶联物等[3, 4]。如单抗与有治疗作用的放射性核素物质形成“弹头”两部分构成的抗体-放射性核素偶联物[5, 6, 7, 8],其中包括放射免疫偶联物。当抗体和癌细胞表面的抗原特异性结合时,抗体-药物偶联物可将药物成功地靶向体内部位。2011年以来,Spirogen公司和Roche公司采用相关的联结技术研发ADC类抗癌制剂,希望开发ADC制剂可能成为具有重大影响力的新型抗癌药。尽管ADC新药的开发已经获得前所未有的成功,但技术上仍然有待进一步优化,其中包括被肿瘤细胞吞噬的效率、细胞毒素的活性以及效应分子的释放等。试图从抗体、接头和效应分子3个方面开展研究,在提高ADC分子在循环系统的稳定性等一系列优化,使其特征获得较大进展。但是这类研究还存在一些尚未解决的问题,最突出的问题是如何降低单抗的免疫原性。单抗的异源性所引起的抗体反应,不但降低了单抗的效价,而且会给患者带来严重的后果。ADC的内在过程和组成部分在设计和应用抗体偶联物到广泛的疾病模型中至关重要。通过结构分析,发现组成部分的类型、相互作用及其对抗体-药物偶联物的靶向性、稳定性和活性的影响。
分析面临的挑战主要有4方面。(1)连接物的构建:ADC药物由抗体、细胞毒基团及连接物共同构成。在ADC药物研究中,连接物的构建是难点之一。它必须具备一定的稳定性,在未达到靶细胞前,要确保ADC药物的完整性。早期ADC药物的研发失败,多是由于连接物技术的落后,后者直接影响了ADC药物的安全性和有效性。(2)确保“弹头”药物的有效释放:进入靶细胞后,又要确保“弹头”药物的有效释放。ADC药物中抗体负载的“弹头”数量也取决于连接物。(3)抗体的优化是关键:ADC药物为大分子物质,而大药物分子难于透过毛细管内皮层和穿过肿瘤细胞外间隙到达实体瘤的深部。而使用抗体片段(如Fab、Fab′)制备相对分子质量较小的ADC,可能提高对细胞外间隙的穿透性,增加到达深部肿瘤细胞的药物量。(4)提高稳定性和建立符合该药物特点的药代研究方法也是关键和难点:肿瘤靶向性差、应用鼠源单抗造成人抗鼠免疫反应、偶联不稳定导致药物在循环系统稳定性差等是早期ADC药物的缺陷。针对实体瘤的抑制和转移研究,ADC药物分子数目会直接影响其在体内的分布。今后,ADC药物研究的定位偶联技术、定量偶联技术、药代技术等的突破可能有利于创新研发水平的提高。
2 ADC作用原理2011年8月,美国FDA批准了首个偶联药物Adcetris(CD30-导向抗体药物结合物)用于治疗霍奇金淋巴瘤(HL)和复发性间质性大细胞淋巴瘤(ALCL),而后世界多家制药企业纷纷开展针对胰腺癌、肾癌和其他癌症治疗药物的研究。2013年2月,Roche研发的治疗晚期或转移乳腺癌ADC偶联药物Kadcyla被美国FDA批准上市。患者静脉注射Kadcyla后,偶联物随着血液分布于全身,在找到乳腺癌细胞表面上的HER2特定蛋白后,偶联物的抗体与蛋白质结合,被癌细胞误判ADC被吸收进入细胞。最后,在癌细胞内分离成有杀伤力的细胞毒物和抗体,从而阻止癌细胞的分裂、阻止其无限生长,达到治疗癌症的目的[3]。
对于该药物来说,ADC药物是一新型的抗癌治疗给药系统和疗法。犹如全球定位系统GPS那样,成为定位功能的巡航导弹(guided missile)。这一给药系统可以精确地加工有效药物带到作用病灶部位的癌细胞,而可以避免有效药物的严重毒副作用的发生。ADC药物作用原理可分为7步[3]:(1)人源化抗体与药物偶联物(ADC)形成药物导弹。在研发实验室证实患者的免疫系统不会排斥这种ADC。(2)人源化抗体通过抗体的某些分子与高活性的药物偶联物(ADC)形成一个药物偶联物。(3)当这种ADC静脉给药后,通过血液循环系统将ADC输送到靶部位。(4)ADC到达一个特殊蛋白质,大量ADC在癌靶出现。(5)ADC发现癌靶细胞,并结合到靶细胞上。(6)在癌细胞里,药物从抗体上分离。(7)药物达到目标癌细胞,发挥治疗作用。其中,第1步和第2步是与制备有关的研究过程,第3~6步是与药动学有关的过程,第7步是与疗效有关的过程。
根据靶向药物体内转运和代谢的特点,笔者认为它与非靶向药物有以下明显不同的特点:(1)普通药物制剂进入血液中后是以游离药物的形式存在的,而靶向药物在达到作用靶之前,其药物是被包裹、吸附或偶联的状态存在。(2)被包裹、吸附或偶联的药物必须具备靶向转运的条件,在体内释放也必须具备一定条件才能定位释放;不能活化的部分,基本不能在转运过程中成为游离的活性药物。(3)靶向药物在体内外的释药行为受到药物在载体中分布(吸附、包裹或偶联位置)的影响。(4)靶向载药体系自身在体内就有分布过程,这可能影响药物在体内的分布。因此,准确测定靶向药物不同组成部分在体内体液、组织、靶部位的含量,是常规的研究方法不能胜任的。准确测定生物样品中靶向药物或其组成部分载体材料的含量是技术瓶颈。建立区别测定生物样品中载体材料、载药系统(如靶头、间隔子、连接子,药物)、释放出的游离药物和血浆蛋白结合药物、代谢和消除等药动学过程存在技术难点和挑战。
ADC由药物、抗体以及偶联抗体和化学的连接子组成的复杂性,给发展新的药动学研究方法,认识药物体内过程,以及与治疗作用和安全性的关系带来困难,因而新生物分析方法研究开发日益受到重视。近期检索到的有关ADC药动学、生物分布、代谢和消除的文献,可以看到对抗体药物,特别是ADC药物的研究和发展的重要性[9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34]。与小分子药物和蛋白质疗法相比,ADC的生物分析具有挑战性,因为ADC具有复杂的分子结构,具有结合小分子药物与蛋白质疗法的分子特征。ADC从血清或血浆中运行到作用部位或靶细胞,在酶的作用下,抗体-连接子-活性药物被裂解而释放药物,产生治疗作用。针对这种新颖的药物作用方式,其生物分析方法必须顾及抗体-连接子-活性药物3者,需要专门设计用于这种复杂ADC给药系统,才能提供更多、更完整的药动学信息,而不能靠传统的生物分析方法来实现。
3 生物分析方法的特殊性2011年和2012年《生物分析》杂志连续以白皮书形势讨论了生物分析方法的挑战问题[35, 36, 37]。2013年该杂志又以专刊形式,聚焦讨论ADC药物生物分析难点[32, 33, 38, 39, 40]。
配体结合的方法和LC-MS/MS两者结合的方法可用于ADC的定量分析。在注意到两种方法有一定局限性的情况下,LC-MS/MS的分析必须先假设转运过程中的ADC并不是释放药物,也就是说ADC在转运过程中是稳定的。如在理论上是可行的,所释放的有效药物,或药物与连接子部分,或与抗体结合的ADC都能分别检测出来,这种生物分析方法才是可以用于ADC药动学研究的方法。
酶联免疫吸附试验(ELISA)检测和定量是生物技术药物研究中常用的方法,也是ADC药物药动学研究有效方法之一。抗体-连接子-药物偶联物(ADC)具有在转运中的稳定性和肿瘤细胞瘤药物的高效释放性。针对CD30+间变性大细胞淋巴瘤霍奇金病模型,单抗偶联物(monomethylauristatin,EMMAE)抗CD30单克隆抗体(mAb),CAC10,产生了选择性的和有效的ADC。该ADC CAC10-缬氨酸-瓜氨酸-MMAE,采用的是蛋白酶敏感的二肽连接子设计释放在靶细胞中的溶酶体组织蛋白酶B MMAE保持稳定的联系和衰减药效循环。为了评估ADC稳定在体内,Russell等开发测量处理小鼠和灵长类动物的血浆中ADC药物的方法[34]。抗独特型单克隆抗体允许捕获和定量抗体CAC10,该作者提供偶联药物定量检测组织蛋白酶B体外释放的数据,验证一种替代ELISA的检测方法。
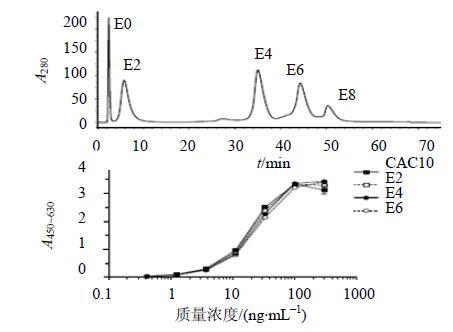 | 图 2 由CAC10-ELISA检测纯化CAC10的ADC(E2,E4,E8)Fig. 2 Purification of CAC10 ADCs (E2, E4, and E8) and detection by cAC10-ELISA. |
ADC药物检测特异性是极其重要的,如使用CAC10抗独特型单克隆抗体亲和捕获ADC,在体外和体内研究中,使用CAC10单克隆抗体的ELISA法进行检测和定量含有单克隆抗体的ADC。纯化的E2、E4和E8系列与原型CAC10比较,每一单克隆抗体捕获或CAC10偶联多达8个药物连接子时,显示检测的影响最小(图 2)[34]。在CAC10或ADC的不同浓度下,3种ADC药物(E2、E4、E8)与CAC10的4条吸收曲线基本一致。
定量药物/血浆中的抗体比率也是对方法可行性的挑战。实验确定的药物/血浆背景中的单克隆抗体比值近似已知每个ADC的比率(表 1)[34],从给药动物猴和小鼠的血浆样品分析,建立CAC10单克隆抗体的ELISA法和竞争ELISA的数据相结合的实用程序,确定平均的药物/血浆样品中的单克隆抗体比例的ADC。
| 表 1 ADC药物在血浆中药物/单抗的比例 Table 1 Drug/mAb ratios for ADC drugs in plasma |
所有的生物技术药物,包括抗体偶联药物(ADC),有可能引起宿主的免疫反应,可能会影响它们的药动学,影响其有效性和安全性。ADC的单克隆抗体偶联的细胞毒药物通过一个化学连接子与具有细胞毒性药物连接。新抗体为靶向基础,采用双/多特异性抗体、抗体片段和其他抗体衍生物,开发出新ADC,达到更具选择性的靶向目的。一种正在研究中的新型ADC,如Kadcyla与目前偶联抗 体-细胞毒性药物相比,这可能影响其免疫原性潜力。因此在研究其新型ADC的药动学时,要求研究所有成分的分子反应,研究测定用的生物分析策略,以便能够反映其作用特点[34]。为此,需要对所研究的生物分析方法进行筛选,进行免疫原性测定时,需要定义等于或高于某一浓度值(水平)为检测阳性的样品,而低于该值定义检测阴性的样品。为开发所使用的检测试剂,必须确定免疫反应,必须对这类ADC药物的各个组成部分进行独立检测。这类新型T-DM1治疗药物,检测抗体应该能够结合抗治疗性抗体(antitherapeutic antibody,ATA)的所有T-DM1组成部分。因此研究者的评估样品策略是采用一种分层的方法,类似于常规的生物治疗药物,以单一的筛选为目的实验设计,并建议随后评估的特异性阳性ATA响应。
4 生物分析方法建立、筛选和验证为确证生物分析方法的可用性,所建立的方法需要经过筛选验证、分层比较,用已经确证所要检测的成分,如抗体、偶联用的连接子、抗体片断和活性药物进行验证比较才能用于试验样品的分析。图 3给出一个免疫原性检测的临床样本的分层方 法[32]。首先分析从临床研究的样品中的筛选试验(验证实验)与ADO-单抗emtansine竞争结合筛检出呈阳性的样品。其ATA特异性的特点是由与曲妥珠单抗ADO-emtansine和曲妥珠单抗的竞争结合曲线,确认阳性样品连续稀释获得滴度。
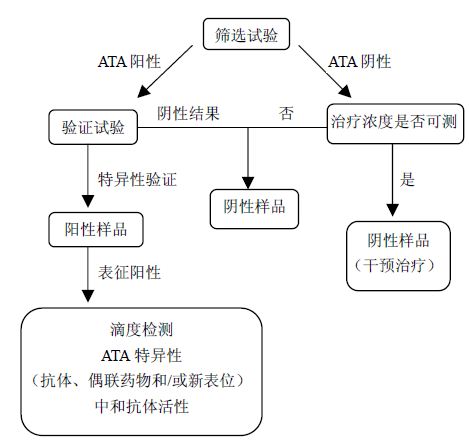 | 图 3 免疫原性检测的临床样本的分层方法Fig. 3 Layered approach of clinical samples in immunogenicity test |
验证性检测是确定方法的必要试验,用于确认筛选抗治疗的抗体阳性的样品为真阳性,以及消除假阳性样品的第二层次的免疫原性测定影响。最常用的验证试验采用竞争结合的试验步骤,在筛选试验中的测试样品前将治疗性ADC掺入到样品中。对T-DM1,采用以风险为基础的分层方法,包括筛选和滴度检测抗治疗抗体的阳性效应,确认和表征的免疫原性,评估免疫反应是否与抗体或连接子、药物和/(或)产生新的抗原决定簇的单抗偶联有关[32]。
使用食蟹猴做的体内试验显示,以相同模型ADC的食蟹猴的超免疫与一个单抗偶联药物的毒理学研究的样品进行体内评价检测,也包括竞争性结合试验评价,表征ATA的多个ADC组成成分的能力。图 4所示,使用桥接测定形式的ADC不同组成部分的抗治疗性抗体检测的结果,分别检测曲妥珠单抗偶联药物(trastuzumab-linker-drug)、曲妥珠单抗(trastuzumab)、曲妥珠单抗片段(trastuzumab fab),游离药物(free drug)和阴性对照单抗(negative control mAb)的结果[32]。图 4A为使用ATA在2个超免疫猕猴用曲妥珠单抗偶联药物的特异性结果,图 4B为ATA在食蟹猴体内的特异性,开发了高水平的ATA(效价>4)在多剂量研究中,曲妥珠单抗偶联药物的结果。
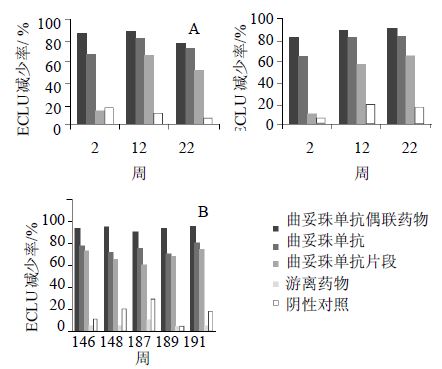 | 图 4 使用桥接测定的ADC不同组成部分的抗治疗性抗体Fig. 4 Anti-therapeutic antibodies of different components in ADCdetermining by bridge form |
从上述实验中使用的替代来源的ATA和从食蟹猴样品包含单抗偶联药物,证实其分层的免疫原性策略是有用的。包括对不同成分的ADC检测所有ATA的桥接检测方法。从非临床的研究样本中测定滴度水平对下一层次ATA作用和对药动学研究可能是有用的。此外,对一个ADC,由于ATA组成成分的特异性,在相同的筛选试验之前,可以通过添加具有竞争力的结合测试样品,评价适当的竞争剂[32]。
图 5显示用ELISA法检测的动物具有高ATA滴度差异的药动学曲线,给药曲妥珠单抗偶联药物剂量4 mg/kg,曲妥珠单抗偶联药物药动学处置特征,而低ATA滴度的动物药动学处置特征与ATA为阴性的动物类似。这些结果表明,其筛选检测能够检测ATA的模型曲妥珠单抗偶联药物和ATA药动学特征,与ATA-阴性的猴相比并未影响药动学行为。此外,确定ATA滴度的样本中,筛选出阳性ATA数据是有用的,显示了ATA滴度和药动学特性的潜在影响之间的关系[32]。
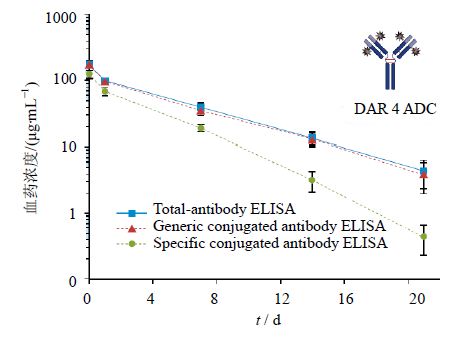 | 图 5 动物具有高ATA滴度差异的药动学曲线 Fig. 5 Pharmacokinetic profile with high ATA titer difference in animals |
LC-MS或LC-MS/MS对于分析生物样品中的小分子活性药物或与连接子-药物或ADC的片断都是可行的分析方法。与ELISA方法比较具有定量准确的优势。由于用LC-MS/MS分析大分子仍是相对较新的方法,也可以通过合理的组合使这一技术更先进。典型的配基结合的方法进行分析,可能时,LC-MS/MS方法应包括使用一个内标物。除了药物共同给药和被分析物的相对分子质量是相似的,当使用LC-MS/MS法时,获得测定特异性更高,并能显著减少干扰测定的潜在因素。使用QC样品通常提供足够的信息来检测潜在的稳定性问题。如亲和LC-MS可以分析特定的工程化半胱氨酸连接子的ADC,这种亲和力LC-MS在评估药物的释放程度也可以使用。
亲和-捕获LC-MS和亲和-捕获疏水性相互作用色谱法是新颖的,这种生物分析工具可以用来表征在体外和体内的完好的ADC。通过实验获得完整的ADC药物对抗体分布的变化来了解体内的ADC的命运。建议使用新型亲和LC-MS检测血浆/血清中的ADC时,应根据其共轭状况和结构表征数据,了解生物分析方法的稳定性,对确定ADC的生物活性至关重要。此外,这样的数据也可以用以确保精确定量的ELISA试剂盒的开发。
6 PK/PD模型研究和体外实验的应用抗体药物具有明显的靶向性,靶向分布是药动学研究的关键,以靶组织浓度高于非靶组织浓度表示靶向性;抗体药物在体内的消除半衰期长;存在明显的PK/PD关系和治疗目标浓度;不同抗体类药物具有各自药动学(PK)和药效学(PD)特点。
在选定的肿瘤细胞系和正常细胞内化率的生物学基础上,建立ADC的PK/PD模型是理解药物作用机制的基础。用免疫组化方法相对地测定作用靶标的表达,更准确的决定自放射性标记的饱和理性结合的体外研究。对于治疗抗体,用直接标记药物和基于细胞的亲和力和表达的流式细胞仪测量的结合试验是常用的方法。经典的方法来确定受体-配体的内在比依赖于放射性配体和各种体外实验设计来完成。荧光激活细胞分选(FACS)为基础的方法允许选择绑定到特定的细胞群。基于流式细胞仪的方法能够获得大量信息。特别是有价值的血液和组织分析方法是在适当的时候,可对具有代表性的单细胞悬液进行研究。
7 讨论在临床实践中,治疗性抗体药物已经显示强的特异性、副作用也较小。但是其疗效在单独使用时还是不很满意。小分子抗癌药物作用特异性差、严重副作用限制其使用。因此,考虑将靶向药物与化疗药物结合或联合来提高其治疗特异性和降低其副作用。所以在新药研发过程中,抗体-药物偶联的设想赋予实践,开始了ADC药物研发。而研发成功的关键,在于5个方面的考虑:一是合适靶的筛选,二是抗体的制备,三是化学链接物的选择,四是高效小分子药物的选择,五是抗体与药物的偶联如何实现。在世界范围内,科技工作者做了大量研究,2009—2013年总计有30多种ADC药物在研发之中,其中2009—2010年有7种ADC在临床试验,2011—2013年有17种ADC药物在临床试验。2013年美国FDA以有限批准程序获得上市的ADC新药Kadcyla就是一个成功的ADC药物的例子。
ADC被称为是一种复杂的药物体系,因为它的共轭化学性质,其体内过程具有复杂性,在转运过程中受到多种宽膜效应的影响和代谢酶的作用。预计在体内,由于随时间的循环,这可能不仅影响它的安全性和有效性,也呈现增加的生物分析挑战过早药物的解离。重要的是要了解到ADC的组合物在体内的变化。因此分析体外结果时必须格外小心。
在研究其新型ADC的药动学时,要求所建立的测定用生物分析方法能够反映其作用特点十分重要。因为ADC具有复杂的分子结构,具有结合小分子药物与蛋白质疗法的分子特征。与小分子药物和蛋白质疗法相比,ADC的生物分析极具挑战性,建立区别测定生物样品中载体材料、载药系统(如靶头、间隔子、链接子,药物)的生物分析方法,弄清释放游离药物机制,分析血浆蛋白结合药物、代谢和消除等药动学特征是具有难度的研究工作。
| [1] | Junutula J R, Raab H, Clark S, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index [J]. Nat Biotechnol, 2008, 26: 925-932. |
| [2] |
Rockoff J D. The guided-missile cancer treatment [J/OL]. Wall Street J Report, [2013-04-05](2014-03-18). http://online.wsj.com/news/articles/SB100014241278873238267045 78356482668645090. |
| [3] | Govindan S V, Goldenberg D M. New antibody conjugates in cancer therapy [J]. Scientific World J, 2010 (10): 2070-2089. |
| [4] | Janevik-Ivanovska E, Gautherot E, de Hillairet B M, et al. Bivalent hapten-bearing peptides designed for iodine-131 pretargetedradioimmunotherapy [J]. Bioconjug Chem, 1997, 8: 526-533. |
| [5] | Sharkey R M, Karacay H, Richel H, et al. Optimizing bispecific antibody pretargeting for use in radioimmunotherapy [J]. Clin Cancer Res, 2003, 9: 3897S-3913S. |
| [6] | Sharkey R M, Goldenberg D M. Advances in radioimmunotherapy in the age of molecular engineering and pretargeting [J]. Cancer Invest, 2006, 24: 82-97 |
| [7] | Weiden P L, Breitz H B. Pretargetedradioimmunotherapy (PRIT) for treatment of non-Hodgkin's lymphoma (NHL) [J]. Crit Rev Oncol Hematol, 2001, 40: 37-51. |
| [8] | Boylan N J, Zhou W, Proos R J, et al. Conjugation site heterogeneity causes variable electrostatic properties in fc conjugates [J]. Bioconjug Chem, 2013, 24(6): 1008-1016. |
| [9] | Strop P, Liu S H, Dorywalska M, et al. Location matters: site of conjugation modulates stability and pharmaco- kinetics of antibody drug conjugates [J]. Chem Biol, 2013, 20(2): 161-167. |
| [10] | Sapra P, Damelin M, Dijoseph J, et al. Long-term tumor regression induced by an antibody-drug conjugate that targets 5T4, an oncofetal antigen expressed on tumor-initiating cells [J]. Mol Cancer Ther, 2013, 12(1): 38-47. |
| [11] | Axup J Y, Bajjuri K M, Ritland M, et al. Synthesis of site-specific antibody-drug conjugates using unnatural amino acids [J]. Proc Natl Acad Sci U S A, 2012, 109(40): 16101-16106. |
| [12] | Lin K, Tibbitts J. Pharmacokinetic considerations for antibody drug conjugates [J]. Pharm Res, 2012, 29(9): 2354-2366. |
| [13] | Petrul H M, Schatz C A, Kopitz C C, et al. Therapeutic mechanism and efficacy of the antibody-drug conjugate BAY 79-4620 targeting human carbonic anhydrase 9 [J]. Mol Cancer Ther, 2012, 11(2): 340-349. |
| [14] | Boswell C A, Mundo E E, Zhang C, et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats [J]. Bioconjug Chem, 2011, 22(10): 1994-2004. |
| [15] | Kovtun Y V, Audette C A, Mayo M F, et al. Antibody-maytansinoid conjugates designed to bypass multidrug resistance [J]. Cancer Res, 2010, 70(6): 2528-2537. |
| [16] | McDonagh C F, Kim K M, Turcott E, et al. Engineered anti-CD70 antibody-drug conjugate with increased therapeutic index [J]. Mol Cancer Ther, 2008, 7(9): 2913-2923. |
| [17] | Junutula J R, Raab H, Clark S, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index [J]. Nat Biotechnol, 2008, 26(8): 925-932. |
| [18] | McDonagh C F, Turcott E, Westendorf L, et al. Engineered antibody-drug conjugates with defined sites and stoichiometries of drug attachment [J]. Protein Eng Des Sel, 2006, 19(7): 299-307. |
| [19] | Lillo A M, Sun C, Gao C, et al. A human single-chain antibody specific for integrin alpha3beta1 capable of cell internalization and delivery of antitumor agents [J]. Chem Biol, 2004, 11(7): 897-906. |
| [20] | Grünberg J, Jeger S, Sarko D, et al. DOTA-functionalized polylysine: a high number of DOTA chelates positively influences the biodistribution of enzymatic conjugated anti-tumor antibody chCE7agl [J]. PLoS One, 2013, 8(4): e60350. |
| [21] | Pimm M V. Drug-monoclonal antibody conjugates for cancer therapy: potentials and limitations [J]. Crit Rev Ther Drug Carrier Syst, 1988, 5(3): 189-227. |
| [22] | Petrul H M, Schatz C A, Kopitz C C, et al. mechanism and efficacy of the antibody-drug conjugate BAY 79-4620 targeting human carbonic anhydrase 9 [J]. Mol Cancer Ther, 2012, 11(2): 340-349. |
| [23] | Bar H, Yacoby I, BenharI. Killing cancer cells by targeted drug-carrying phage nanomedicines [J]. BMC Biotechnol, 2008, 8: 37. |
| [24] | Dosio F, Brusa P, CattelL. Immunotoxins and anticancer drug conjugate assemblies: The role of the linkage between components [J]. Toxins (Basel), 2011, 3(7): 848-883. |
| [25] | Acchione M, Kwon H, Jochheim C M, et al. Impact of linker and conjugation chemistry on antigen binding, Fc receptor binding and thermal stability of model antibody- drug conjugates [J]. MAbs, 2012, 4(3): 362-372. |
| [26] | Shen B Q, Xu K, Liu L, et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody- drug conjugates [J]. Nat Biotechnol, 2012, 30(2): 184-189. |
| [27] | Boswell C A, Mundo E E, Zhang C, et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats [J]. Bioconjug Chem, 2011, 22(10): 1994-2004. |
| [28] | Wakankar A A, Feeney M B, Rivera J, et al. Physicochemical stability of the antibody-drug conjugate Trastuzumab-DM1: changes due to modification and conjugation processes [J]. Bioconjug Chem, 2010, 21(9):1588-1595. |
| [29] | Carter P J, Senter P D. Antibody-drug conjugates for cancer therapy [J]. Cancer J, 2008, 14(3): 154-169. |
| [30] | Sanderson R J, Hering M A, James S F, et al. In vivo drug-linker stability of an anti-CD30 dipeptide-linked auristatinimmunoconjugate [J]. Clin Cancer Res, 2005, 11(2 Pt 1): 843-852. |
| [31] | Carrasco-Triguero M, Yi J H, Dere R, et al. Immunogenicity assays for antibody-drug conjugates: Case study with ado-trastuzumab emtansine [J]. Bioanalysis, 2013, 5(9): 1007-1023. |
| [32] | Xu K Y, Liu L N, Dere R, et al. Characterization of the drug-to-antibody ratio distribution for antibody-drug conjugates in plasma/serum [J]. Bioanalysis, 2013, 5(9): 1057-1071. |
| [33] | Sanderson R J, Hering M A, James S F, et al.In vivo drug-linker stability of an anti-CD30 dipeptide-linked Auristatin immunoconjugate [J]. Clin Cancer Res, 2005, 11: 843-852. |
| [34] | Garofolo F, Rocci Jr M L, Dumont I, et al. 2011 White Paper on Recent Issues in Bioanalysis and Regulatory Findings from Audits and Inspections [J]. Bioanalysis, 2011, 3(18): 2081-2096. |
| [35] | Stephan J P, Kozak K R, Wong W L. Challenges in developing bioanalytical assays for characterization of antibody-drug conjugates [J]. Bioanalysis, 2011, 3(6): 677-700. |
| [36] | DeSilva B, Garofolo F, Rocci M, et al. 2012 White paper on recent issues in bioanalysis and alignment of multiple guidelines [J]. Bioanalysis, 2012, 4(18): 2213-2226. |
| [37] | Kaur S. Bioanalysis special focus issue on antibody–drug conjugates [J]. Bioanalysis, 2013, 5(9): 981-983. |
| [38] | Clark T, Han X G, King L, et al. Insights into antibody—drug conjugates: bioanalysis and biomeasures in discovery [J]. Bioanalysis, 2013, 5(9): 985-987. |
| [39] | Gorovits B, Alley S C, Bilic S, et al. Bioanalysis of antibody-drug conjugates: American association of pharmaceutical scientists antibody-drug conjugate working group position paper [J]. Bioanalysis, 2013, 5(9): 997-1006. |
| [40] | Gorovits B, Alley S C, Bilic S, et al. Bioanalysis of antibody-drug conjugates: American association of pharmaceutical scientists antibody-drug conjugate working group position paper [J]. Bioanalysis, 2013, 5(9): 997-1006. |
 2014, Vol. 37
2014, Vol. 37

