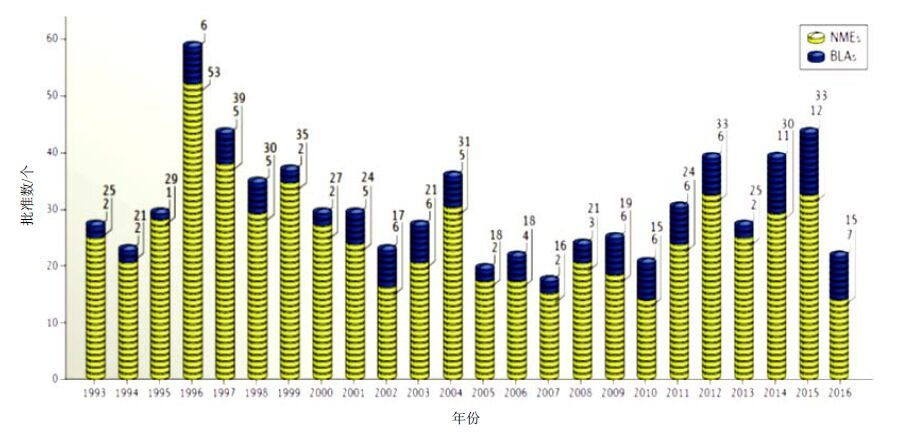
在连续两年高位数之后,FDA批准的新药数量在2016年急剧下降,只有22个,位于1993年以来的第19位,该数量不仅远低于2015年的批准数,也低于过去5年的平均批准数35个以及10年的平均批准数29个。1993年以来FDA每年度批准的新药数量见图 1。2016年FDA药品评价和研究中心(CDER)批准的新药见表 1,其中有5个已经在中国申请进口或临床验证,表明国际制药公司对中国市场的重视。2016年获批新药中有7个获得突破性疗法资格,占32%,2015年有10个(10%),2014年有9个(22%)。至今已有141个品种获得突破性疗法资格,有人认为FDA设定的突破性疗法的门槛可能太低了。2016年FDA批准了9个(41%)是孤儿药,这与业界近来对罕见病兴趣增加相一致,2015年和2014年分别是21个(47%)和17个(41%)。
|
图 1 1993年以来CDER历年批准的新药 Fig. 1 NMEs and BLAs approved by CDER since 1993 |
| 表 1 2016年CDER新批的品种 Table 1 New CDER approvals in 2016 |
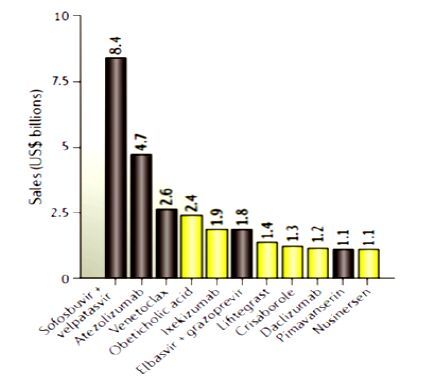
2016 年批准数量的下降并不能完全反映FDA或制药界的真实情况,有些仅是因为提交申请或批准时间所致。如在2015年获批的5个品种按计划应在2016年批准的,如果考虑到这一因素,则2015年和2016年批准获批的新药数量就很接近了。另外,新药的申请数量也可以佐证这一观点,至2016年12月中旬,业界共提交了36个新药申请(NDAs)和生物制品许可申请(BLAs),2015年和2014年全年的申请数量分别为41、40个。2016年获批数量减少的另一个重要原因是被FDA拒绝的数量增多了,这一年FDA共签发了14封完全回复函,大部分遭拒的原因是申报者不符合GMP要求。综合分析各种原因,这种现象并不意味着制药界出现了创新产出危机。2016年FDA部分完全回应函见表 2。据波士顿咨询公司(BCG)的分析,2016年获批新药的累积销售峰值也将小于往年,据预测其累加销售峰值约350亿美元,仅为2015年新药峰值的一半。2016年获批新药中有11个品种有发展成重磅炸弹的潜力,2015年批准品种中则有16个,2014年批准新品中有12个。不过,这些销售额预测很不可靠,误测率高达40%。2016年批准可能的重磅炸弹品种及销售峰值见图 2。
| 表 2 2016年FDA部分完全回复函 Table 2 Part of fully back to reply of FDA in 2016 |
|
图 2 2016年批准可能的重磅炸弹品种及销售峰值 Fig. 2 Anticipated blockbusters approved in 2016 and estimated sales |
2 FDA批准新药的类别构成
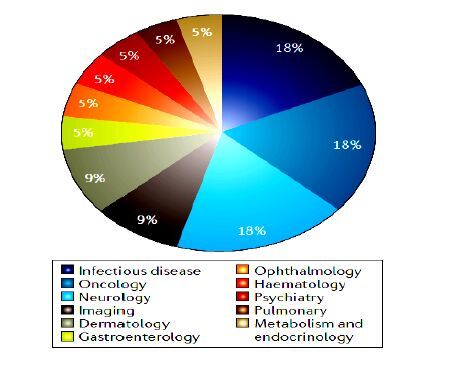
2016 年获批新药的类别构成见图 3,一个重大变化是抗肿瘤新药不再占居占据优势,2016年只批准了4个(18%),远少于2015年的14个(31%),2014年的9个(22%),和2013年的9个(33%)。但这可能仅是暂时现象,2016年制药企业向血液学和肿瘤学办公室提交的新药申请约占申请量的三分之一。全社会仍倾向肿瘤、免疫疗法以及罕见病药物的开发。
|
图 3 2016年新批品种的领域分布 Fig. 3 Approvals by therapeutic area |
新批准的抗肿瘤药中有2个的销售额有可能超过20亿美元。其中基因泰克公司的atezolizumab最有希望,这是第1个靶向PDL-1的单抗。AbbVie公司的venetoclax是另一候选者,这是第1个阻止癌细胞逃离凋亡的小分子抑制剂,同时也是第1个上市的蛋白-蛋白相互作用的抑制剂。
抗感染药物和神经系统药物均为4个。抗感染药物中,吉利德的丙肝复方制剂epclusa被认为是2016年批准获批新药品种中最赚钱的。本品是聚合
酶抑制剂索非布韦和NS5A抑制剂velpatasvir的复方,对所有6种基因型的HCV均有效,吉利德尤其看好本品对基因型2和3(这是目前治疗丙肝药中疗效最差的二种基因型)丙肝的疗效,吉利德相信epclusa将成为抢占日益竞争激烈的市场的有力武器。
FDA批准了黙克公司的bezlotoxumab单抗,这是一种开创性的毒素靶向的抗菌抗体药物,用于防止艰难芽孢杆菌感染的反复。
神经系统药物中,FDA特别给治疗DMD的eteplirsen开了绿灯,DMD是由基因缺陷引起的肌肉退行性疾病。本品是一种反义寡核苷酸,能够促进51外显子的表达,以避免基因缺陷的后果。本品的批准也遭到一些界内人士的批评,因为仅根据12例Ⅱ期临床试验的结果。FDA批准了另1个绞接修饰的反义寡核苷酸药物,Biogen&Ionis公司治疗脊髓性肌萎缩症(SMA)的nusinersen。SMA是由于SMN1基因突变所致的肌肉无能疾病,nusinersen可以修饰与SMN2基因相关的转录绞接,于补代偿SMN1突变的功能。绞接修饰技术也给其他疾病提供了一种新的治疗手法。
Acadia公司的匹莫范林是首个用于治疗伴有妄想、幻觉等精神症状的帕金森患者的药物,多达一半的帕金森患者有此症状。
Biogen公司抗IL-2单抗daclizumab获新批准用于多发性硬皮病治疗。FDA在1997年曾拒绝本品用于肾移植排斥,后来罗氏获得了daclizumab治疗肾移植排斥的权力,但因需求少于2009年撤市。
Intercept公司的鹅去氧奥贝胆酸获得批准用于治疗原发性胆汁性胆管炎主胆管炎,证明了法尼醇X受体(FXR)激动剂的价值,但本品真正的市场价值在于将获得批准用于酒精性脂肪肝,这个目前临床未满足的治疗领域有150亿元的市场规模。
2016 年CDER未批准心血管系统和抗风湿类药物。2016年生物制品评价和研究中心(CBER)批准了去年有几个引人注目的新药,见表 3。3个新批准的生物类似药加剧了融合蛋白和单抗的竞争,见表 4。
| 表 3 2016年CBER批准的部分新药 Table 3 Part of new CBER approvals in 2016 |
| 表 4 2016年批准的生物类似物 Table 4 Biosimilars approved in 2016 |
表 5列出了部分可能在2017年获得批准的品种。罗氏的抗CD20单抗,提供了进行性多发性硬皮病的新疗法,安进公司的romosozumab是首个抗硬骨素单抗,可以促进骨质形成,减少骨吸收,用于治疗骨质疏松。个别2016年被FDA拒绝的品种在2017年再次申请,其中就有梯瓦公司的氘化四苯噻嗪,这是第1个氘化药物。
| 表 5 2017年部分有潜力获得批准的药物 Table 5 Part of potential approvals in 2017 |
3 EMA批准新药的简况
EMA在2016年也只批准了27个新治疗产品,少于2015年的39个和2014年的40个。EMA批准的产品中包括了小分子药物、抗体、血液制品、细胞产品及疫苗等,FDA的CDER只包括小分子药物和部分生物制品,二者间没有可比性。
EMA批准的产品大部分都是FDA 2016年或2015年批准的品种,但有1个明显的差异,就是欧盟批准了2个前沿性的细胞治疗产品,FDA还没有批准。
GS公司的strimvelis是欧盟批准的第2个基因治疗产品,用于治疗腺苷脱氨酶(ADA)缺陷所造成的严重免疫缺陷,这些细胞从特定患者的骨髓中制备,并在体外导入可表达ADA的病毒载体。
EMA批准的另1个细胞治疗产品是MolMed公司的zalmoxis,这是一种经过基因改造后的外源T细胞,携带有低亲和力的神经生长因子受体和胞疹病毒胸腺嘧啶激酶(HSV-TK Mut2),EMA批准本品用于治疗造血干细胞移植后免疫系统的重建。HSV-TK Mut2是一种自杀开关,一旦这些T-细胞可能使宿主致病时,就引发这些细胞对更昔洛韦、缬更昔络韦的敏感性。
EMA率先批准了礼来的JAK抑制剂baricitinib用于治疗风湿性关节炎,FDA对本品的批准按PDUFA预计在2017年4月。
有2个在2016年被FDA拒绝的新药在EMA获批,一个是Amicus的migalastat,这是一种治疗Fary病的药物伴侣,还有一个是安进的etelcalcetide,这是一种拟钙剂,用于治疗慢性肾炎所致的继发性高甲状旁腺机能亢进。
 2017, Vol. 32
2017, Vol. 32

