口服给药方式,因为相对安全、方便而更易为广大患者接受。但药物口服吸收的主要场所在胃肠道,胃肠道的pH值和蛋白酶的消化作用会使药物分解失活,从而影响口服药物的生物利用度。普通口服制剂在胃肠道中对药物成分没有保护作用,开发一种新型纳米给药系统,提高药物胃肠道稳定性并提高生物利用度,是亟待解决的问题。丹酚酸B是丹参水溶性酚酸类成分中含量最高、活性最强的成分[1],对心血管系统、肝脏、肾脏、肺均具有保护作用[2]。但丹酚酸B化学结构不稳定,在水溶液、胃肠道中易降解,大大限制了其临床应用[3]。本课题组创新研制的新型给药系统脂化乳为载药系统,制备了丹参酮IIA脂化乳,并研究了其稳定性[4]。本实验以丹酚酸B为模型药物,制备了丹酚酸B脂化乳,并制备不含稳定体系的丹酚酸B脂化乳粒,以丹酚酸B为对照,采用紫外分光光度法对丹酚酸B脂化乳、丹酚酸B脂化乳粒及原形药物中的丹酚酸B在人工胃肠液孵育不同时间后的变化进行测定,为脂化乳的作为口服制剂的合理性和可行性研究提供依据。
1 仪器与试药 1.1 仪器TU-1810APC型紫外分光光度计(北京普析通用仪器有限责任公司);TK-12D型透皮扩散试验仪(上海锴凯科技贸易有限公司,使用其磁力搅拌功能);CP225D、BS210S型电子天平(德国Sartorius公司);KQ-5200DE型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药丹酚酸B(宝鸡国康生物科技有效公司,批号MUST-12020104,质量分数≥98%);蛋黄卵磷脂PC-98T(日本产,高纯度级);蛋黄卵磷脂PL-100M(上海艾韦特医药科技有限公司,批号93685-90-6);大豆卵磷脂(德国Lipoid公司,质量分数>94%);氢化大豆磷脂HSPC(上海艾韦特医药科技有限公司,批号92128-87-5);中链甘油三酸酯(MCT);蓖麻油聚氧乙烯(医用级别);大豆油(药用级,西安悦来医药科技有限公司);十二烷基硫酸钠(SDS);自制甘氨酸-盐酸缓冲溶液(pH 3.32);胃蛋白酶(Sigma Vetec,货号V900497);胰蛋白酶(Sigma公司,货号85450C);甲醇(Fisher,色谱纯)。
2 方法与结果 2.1 丹酚酸B脂化乳、脂化乳粒的制备称取2.625 g油相,溶于2 mL无水乙醇中,置于60 ℃水浴中至乙醇挥尽。称取适量稳定材料聚丙烯酰胺加入甘氨酸-盐酸缓冲溶液(pH 3.32)中静置过夜溶胀后,加入丹酚酸B 30 mg即为水相。将18 mL水相加入油相中,电动搅拌器3 500 r/min搅拌2 min后,4.14 MPa下高压乳匀1 min即得均一乳白色丹酚酸B脂化乳。
丹酚酸B脂化乳粒制备方法与脂化乳相同,但水相中不加入稳定体系材料。所得丹酚酸B脂化乳粒径为(251.3±3.98)nm,多分散系数(PDI)为(0.061±0.02)、电位为(-6.87±0.67)mV。丹酚酸B脂化乳粒的粒径为(246.4±5.87)nm,PDI为(0.066±0.02)、电位为(-5.76± 0.56)mV。
2.2 紫外分光光度法测定丹酚酸B 2.2.1 光谱条件对丹酚酸B甲醇溶液于190~400 nm进行全波长扫描,确定丹酚酸B的最大吸收波长为288 nm。
2.2.2 标准曲线的绘制精密量取7.5 mg丹酚酸B,置于25 mL量瓶中,加甲醇至刻度,摇匀,即得300 μg/mL丹酚酸B对照品母液。精密量取丹酚酸B对照品母液100、300、500、700、1 000 μL,分别置于10 mL棕色量瓶中,加甲醇至刻度,分别得到3.0、9.0、15.0、21.0、30.0 μg/mL系列溶液。于上述最大吸收波长处测定,记录吸光度(A)值。以A与质量浓度绘制标准曲线,得回归方程A=0.022 4 C-0.017 2,r2=0.996 7。结果表明丹酚酸B在3.0~30.0 μg/mL时吸光度值与质量浓度的线性关系良好。
2.2.3 精密度试验取丹酚酸B适量,精密称定,配成质量浓度为15.0 μg/mL的溶液,在288 nm处连续测定6次,记录A值,结果RSD值为2.21%。
2.2.4 稳定性试验取丹酚酸B脂化乳,4 ℃条件下保存,分别于0、2、4、8、24、48 h测定,记录A值,结果RSD值为4.79%,说明丹酚酸B脂化乳4 ℃条件下保存较为稳定,未出现显著降解。
2.2.5 重复性试验取丹酚酸B脂化乳6份,测定A值,结果RSD值为3.91%。
2.2.6 加样回收率试验取丹酚酸B脂化乳6份各0.1 mL于10 mL量瓶中,其中3份加入0.1 mL丹酚酸B对照品溶液,另外3份加入0.2 mL丹酚酸B对照品溶液,加入甲醇定容、混匀,测定A值,计算得平均回收率为103.97%,RSD值为4.07%。
2.3 人工胃液中稳定性试验 2.3.1 人工胃液(pH2.0)的配制取稀盐酸0.5 mL,加水约900 mL、胃蛋白酶10 g,摇匀后,加水稀释成1 000 mL,即得。
2.3.2 丹酚酸B水溶液的配制称取适量丹酚酸B,加水配制成质量浓度为0.8 mg/mL的丹酚酸B水溶液。于使用前现配。
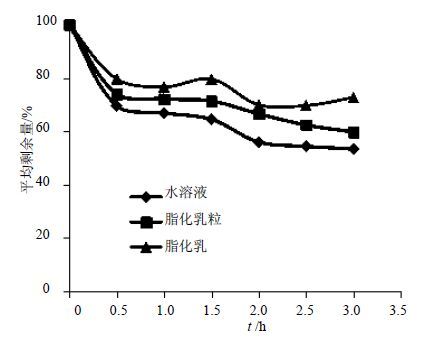
2.3.3 在人工胃液(pH2.0)中的释放适量37 ℃人工胃液中加入丹酚酸B水溶液、丹酚酸B脂化乳、丹酚酸B脂化乳粒各5 mL,于TK-12D型透皮扩散试验仪中37 ℃水浴以80 r/min进行搅拌。30 min取一次消化液,每次1 mL。每次取出的消化液样品加入6 mL甲醇以灭活胃蛋白酶及破乳后,在288 nm波长下测定吸光度值。与测得供试样品液中质量浓度(100%)进行比较,计算质量浓度变化,得到平均剩余量,结果见图 1。
|
图 1 人工胃液中不同制剂所含丹酚酸B平均剩余量曲线 Fig. 1 Time-varying curves of salvanolic acid B of different preparations in artificial gastric juice |
由实验结果可知,不同制剂中丹酚酸B在人工胃液中的量均有所降低,但脂化乳和脂化乳粒均较水溶液中丹酚酸B的量高,3 h后丹酚酸B水溶液中药物的量分别较脂化乳、脂化乳粒少19.3%、6.4%,说明脂化乳、脂化乳粒均可提高丹酚酸B的稳定性。增加了稳定体系的脂化乳效果优于不含稳定体系的脂化乳粒,说明稳定体系有助于进一步提高制剂的稳定性。
2.4 人工肠液中稳定性试验 2.4.1 人工肠液(pH6.8)的配制取磷酸二氢钾6.8 g,加水500 mL使溶解,用0.1 mol/L NaOH溶液调节pH值至6.8;另取胰酶10 g,加水适量使溶解,将两液混合后,加水稀释至1 000 mL,即得。
2.4.2 丹酚酸B水溶液的配制称取适量丹酚酸B,加水配制成质量浓度为0.8 mg/mL的丹酚酸B水溶液。于使用前现配。
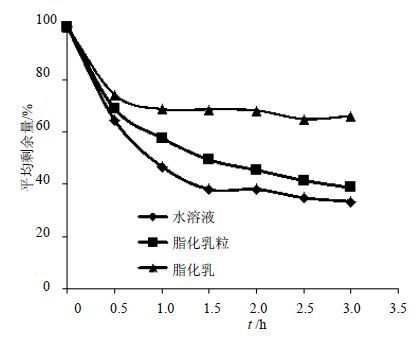
2.4.3 在人工肠液(pH6.8)中的释放适量37 ℃人工肠液中分别加入丹酚酸B水溶液、脂化乳、脂化乳粒各5 mL,TK-12D型透皮扩散试验仪中37 ℃水浴以80 r/min进行搅拌。30 min取一次消化液,每次1 mL。每次取出的消化液样品加入6 mL甲醇以灭活胰蛋白酶及破乳后,在288 nm波长下测定A值。与测得供试样品液中质量浓度(100%)进行比较,计算质量浓度,得到平均剩余量,结果见图 2。
|
图 2 人工胃液中不同制剂所含丹酚酸B平均剩余量曲线 Fig. 2 Time-varying curves of salvanolic acid B of different preparations in artificial intestinal juice |
由实验结果可知,不同制剂中丹酚酸B在人工肠液中的量均有所降低,但脂化乳、脂化乳粒均较水溶液中丹酚酸B的量高,6 h后丹酚酸B水溶液中药物的量分别较脂化乳、脂化乳粒少32.7%、5.3%。说明稳定体系有助于进一步提高人工肠液中制剂稳定性,同时,脂化乳、脂化乳粒均能提高人工肠液中所包载药物丹酚酸B的稳定性。
3 讨论药物口服生物利用度低,一是因为在胃肠道中药物成分遭到破坏,二是药物成分的溶解性和/或渗透性低。构建一种提高药物成分在胃肠道中稳定性,提高药物成分溶解性和/或渗透性的新型给药系统,有着迫切需求及广阔应用前景。
丹酚酸B属于生物药剂学分类系统(BCS)III类药物[5],其水溶性好,具有良好的药理活性。但丹酚酸B生物膜透过性差,且在胃肠道中不稳定,导致其口服生物利用度很低,在大鼠和犬体内生物利用度很低,分别为2.3%、1.07%[6-7]。本文从提高药物制剂在人工胃肠液中稳定性的角度,阐释新型给药系统脂化乳口服给药的合理性。关于脂化乳提升水溶性药物渗透性的研究,将作为后续的研究继续进行。
实验结果表明,脂化乳、脂化乳粒均能提高包载药物丹酚酸B在人工胃、肠液中的稳定性,且脂化乳的稳定效果均明显优于脂化乳粒,说明稳定体系有助于进一步提高人工胃、肠液中制剂稳定性。但从图 1、2中均可看出,丹酚酸B脂化乳中药物剩余含量出现反复情况,说明制剂存在包载药物含量不均一的情况,在后续研究中可通过优化制备工艺改善此情况。
| [1] |
马金鹏, 舒乐新, 刘志东.
丹酚酸B脂质体的制备及其体外释药的研究[J]. 中草药, 2011, 42(1) : 65–68.
( 0) 0)
|
| [2] |
赵先, 王婧雯, 陆杨, 等.
丹酚酸B药理作用的研究进展[J]. 西北药学杂志, 2015, 21(1) : 107–110.
( 0) 0)
|
| [3] |
林珈好. 丹参酮ⅡA、丹酚酸B与甘草次酸复方脂质体构建及体内外评价研究[D]. 北京:北京中医药大学, 2014.
( 0) 0)
|
| [4] |
张秀荣, 陈芳宁, 王秀丽, 等.
丹参酮IIA脂化乳的制备及其稳定性研究[J]. 现代药物与临床, 2017, 32(1) : 16–19.
( 0) 0)
|
| [5] |
刘嘉, 李俊松, 狄留庆, 等.
丹酚酸B及其磷脂复合物在SD大鼠的生物利用度研究[J]. 中国药学杂志, 2010, 45(18) : 1408–1411.
( 0) 0)
|
| [6] |
田葆萍, 袁志芳, 张兰桐.
丹参及其制剂的体内药代动力学研究概述[J]. 中国药房, 2003, 14(6) : 375–376.
( 0) 0)
|
| [7] |
Gao D Y, Han L M, Zhang L H, et al.
Bioavailability of salvianolic acid B and effect on blood viscosities after oral administration of salvianolic acids in beagle dogs[J]. Arch Pharm Res, 2009, 32(5) : 773–779.
DOI:10.1007/s12272-009-1517-2 ( 0) 0)
|
 2017, Vol. 32
2017, Vol. 32


