2. Ernest Mario School of Pharmacy, Rutgers, The State University of New Jersey, Piscataway, NJ 08854, USA
2. Ernest Mario School of Pharmacy, Rutgers, The State University of New Jersey, Piscataway, NJ 08854, USA
c-Met激酶作为受体酪氨酸家族中的一员,是由原癌基因c-Met编码的一种酪氨酸激酶受体[1],c-Met/HGF信号通路与多种肿瘤形成相关,包括肺癌、胃癌、结肠癌、肝癌、乳腺癌等。在这些肿瘤细胞中都出现异常的活化,涉及c-Met基因的过表达、扩增和突变等,通过一系列的信号转导,促进肿瘤的生长、侵袭和转移,因此阻断HGF/c-Met信号途径可有效抑制肿瘤的发生发展和转移[2]。针对c-Met信号通路治疗肿瘤的药物大致可以分为4类:HGF激活抑制剂、HGF抑制剂、c-Met拮抗剂和c-Met激酶抑制剂[3]。目前临床上应用的主要是小分子c-Met激酶抑制剂。根据抑制剂与c-Met激酶的结合构象不同分为Ⅰ型和Ⅱ型[4],Ⅱ型与Ⅰ型相比,具有更高的选择性,对多种激酶都有抑制作用。目前已有多个Ⅱ型小分子c-Met激酶抑制剂进入临床研究阶段,如capmatinib、golvatinib、altiratinib[5-7]。
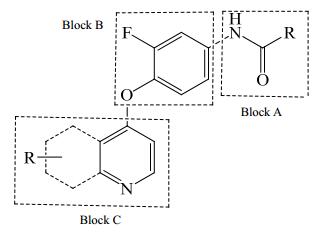
通过结构分析以及对文献的调研[8-9],笔者将Ⅱ型c-Met激酶抑制剂的基本结构骨架分为Block A、Block B和Block C 3个部分(图 1),其中酰胺结构为重要基团,可以与腺嘌呤核苷三磷酸(ATP)结合位点结合,形成两个氢键[10],Block A部分的连接臂为5个原子最佳,可以对其连接臂进行结构修饰。Block B部分为3位氟原子取代活性最佳,醚必须在氮的对位以作为氢键的受体。Block C部分可以用各种含氮杂环结构来代替。在此基础上,本实验以4-氯-6, 7-二甲氧基喹啉、6-氯-7氮杂吲哚、4-氯-7-氮杂吲哚为起始物,与具有多种生物活性的优势结构噻吩环、呋喃环以及邻甲氧基苯环进行连接,经过取代、还原、缩合反应,共合成9个酰胺类化合物,其结构经ESI-MS、1H-NMR、13C-NMR确证,并采用MTT法测定其对GTL-16细胞株增殖的抑制作用,探讨其构效关系,以期进一步发现具有研究价值的、抗肿瘤活性良好的化合物。
|
图 1 Ⅱ型c-Met激酶抑制剂的基本骨架 Fig. 1 Basic skeleton of type Ⅱc-Met kinase inhibitors |
1 仪器与试剂
N-1001EYELA旋转蒸发仪(上海爱郎仪器有限公司);AR224CN型电子天平(上海奥豪斯仪器有限公司);IKA C-MAJ HS7电动磁力搅拌器(广州仪科实验室技术有限公司);Bruker Advance Ⅱ 600 MHz核磁共振波谱仪;Bruker Advance Ⅲ HD 400 MHz核磁共振仪;酶标仪(Thermo Fisher Scientific Co.)。
4-氯-6, 7-二甲氧基喹啉、6-氯-7-氮杂嘌呤、4-氯-7氮杂吲哚质量分数分别为95%、98%、97%,均由百灵威科技有限公司提供。HATU、DIEPA均由阿拉丁试剂(上海)有限公司提供;GTL-16人胃癌细胞株(广州吉妮欧生物科技有限公司);标准胚牛血清和胰酶(GIBCO公司)、噻唑蓝(MTT,Sigma公司);BMS-2(AstaTech,质量分数97%);其余所用试剂均为分析纯。
2 方法与结果 2.1 苯胺化合物2的合成[11] 2.1.1 3-氟-4-(6, 7-二甲氧基-喹啉-4-氧基)-苯胺(2a)的制备在50 mL单口瓶中加入4-氯-6, 7-二甲氧基喹啉446 mg(2 mmol),加入5 mL氯苯,搅拌加热至140 ℃,加入2-氟-4-硝基苯酚628 mg(4 mmol),反应10 h,冷却至室温,抽滤,干燥后得粗品(1a),溶于10 mL乙醇中,加入氯化铵固体1.07 g,加热至85 ℃,原料全部溶解后,分批加入Fe粉,石油醚-醋酸乙酯(1:1)为展开剂,TLC监测反应完全后,立即抽滤除去Fe粉,旋蒸除去溶剂,所得固体经硅胶柱色谱纯化,石油醚-醋酸乙酯(2:1)洗脱得浅灰色固体2a(420 mg),收率为67%;MS m/z:315.11 [M+H]+。1H-NMR(600 MHz,DMSO)δ:8.46(d,1H,J=7.8 Hz,ArH),7.50(s,1H,ArH),7.38(s,1H,ArH),7.07(t,1H,J=8.4 Hz,ArH),6.48~6.38(m,3H,ArH),5.53(s,2H,NH),3.94(s,6H,CH3-H)。
2.1.2 3-氟-4-(7H-吡咯[2, 3-d]嘧啶-4-氧基)-苯胺(2b)的制备按照化合物2a合成方法,由6-氯-7-氮杂嘌呤1 g(6.5 mmol)和2-氟-4-硝基苯酚1.5 g(9.5 mmol)反应,干燥后得粗品(1b),溶于10 mL乙醇中,加入氯化铵固体3.47 g,加热至85 ℃,再分批加入Fe粉还原,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯(2:1)洗脱得白色固体2b(983 mg),收率62%;MS m/z:245.08 [M+H]+。1H-NMR(600 MHz,DMSO)δ:12.21(s,1H,NH),8.24(s,1H,ArH),7.41(m,1H,ArH),7.01(t,1H,J=8.4 Hz,ArH),6.48(m,2H,ArH),6.41(dd,1H,J=6.6、1.8 Hz,ArH),5.40(s,2H,NH)。
2.1.3 3-氟-4-(1H-吡咯[2, 3-b]吡啶-4-氧基)苯胺(2c)的制备按照化合物2a合成方法,由4-氯-7-氮杂吲哚833 mg(5.4 mmol)和2-氟-4-硝基苯酚1, 25 g(7.96 mmol)反应,干燥后得粗品(1c),溶于10 mL乙醇中,加入氯化铵固体2.86 g,加热至85 ℃,再分批加入Fe粉还原,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯(2:1)洗脱得白色固体2c(895 mg),收率68%;MS m/z:244.08 [M+H]+。1H-NMR(600 MHz,DMSO)δ:11.70(s,1H,NH),8.03(s,1H,ArH),7.34(m,1H,ArH),7.03(t,1H,J=9 Hz,ArH),6.52(dd,1H,J=7.8、2.4 Hz,ArH),6.47(dd,1H,J=6、2.4 Hz,ArH),6.29(d,1H,J=5.4 Hz,NH),6.24(m,1H,ArH),5.45(s,2H,NH)。
2.2 苯酰胺化合物3a~5c的合成[12] 2.2.1 N-[4-(6, 7-二甲氧基喹啉-4-氧基)-3-氟-苯基]-2-甲氧基-苯甲酰胺(3a)的制备取25 mL茄瓶,加入邻甲氧基苯甲酸100 mg(0.657 mmol)、HATU 300 mg(0.789 mmol),溶于4 mL干燥乙腈中,0 ℃条件下搅拌10 min,加入DIEPA 117 μL(0.657 mmol),待反应液颜色发生变化后,加入化合物2a 103 mg(0.328 mmol),石油醚-醋酸乙酯-氨水(1:1:0.024)为展开剂,TLC监测反应,6 h后反应结束,旋蒸除去溶剂,分别用10%柠檬酸(10 mL×3)、饱和碳酸氢钠溶液(10 mL×3)萃取,合并有机相,减压蒸发除去溶剂,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(2:1:0.036)洗脱得到白色固体化合物3a(80 mg),收率54%;MS m/z:449.43 [M+H]+。1H-NMR(600 MHz,CDCl3-d)δ:9.98(s,1H,NH),8.50(d,1H,J=7.8 Hz,ArH),8.31(dd,1H,J=9.6 Hz,2.4 Hz,ArH),7.92(dd,1H,J=15、3.6 Hz,ArH),7.60(s,1H,ArH),7.54(t,1H,J=10.8 Hz,ArH),7.43(s,1H,ArH),7.38(d,1H,J=13.2 Hz,ArH),7.25(t,1H,J=12.6 Hz,ArH),7.17(t,1H,J= 11.4 Hz,ArH),7.07(d,1H,J=12 Hz,ArH),6.44(d,1H,J=7.8 Hz,ArH),4.10(s,3H,CH3-H),4.07(s,3H,CH3-H),4.05(s,3H,CH3-H)。13C-NMR δ:163.43,160.29,157.19,153.16,152.95,149.61,148.56,146.58,137.25,136.85,133.69,132.46,123.66,121.76,121.12,116.46,115.52,111.57,107.58,102.2,99.46,56.18。
2.2.2 N-[3-氟-4-(7H-吡咯[2, 3-d]嘧啶-4-氧基)-苯基]-2-甲氧基-苯甲酰胺(3b)的制备按照化合物3a的合成方法,由邻甲氧基苯甲酸100 mg(0.657 mmol)和2b 80 mg(0.328 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(3:1:0.048)洗脱得白色固体3b(65 mg),收率52%;MS m/z:379.06 [M+H]+。1H-NMR(400 MHz,CDCl3-d)δ:11.10(s,1H,NH),9.97(s,1H,ArH),8.51(s,1H,ArH),8.32(d,1H,J=7.6 Hz,ArH),7.92(d,1H,J=12 Hz,ArH),7.56(t,1H,J=7.6 Hz,ArH),7.31(t,1H,J=6.4 Hz,ArH),7.19(t,1H,J=6.4 Hz,ArH),7.08(d,1H,J=8 Hz,ArH),6.74(s,1H,ArH),5.33(d,2H,NH,ArH),4.10(s,3H,CH3-H);13C-NMR δ:175.51,163.24,161.93,157.20,153.68,137.07,136.77,132.60,129.88,123.97,123.61,121.83,116.04,111.58,109.32,105.13,99.44,56.32。
2.2.3 N-[3-氟-4-(1H-吡咯[2, 3-b]吡啶-4-氧基)-苯基]-2-甲氧基-苯甲酰胺(3c)的制备按照化合物3a的合成方法,由邻甲氧基苯甲酸100 mg(0.657 mmol)和2c 80 mg(0.328 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(3:1:0.048)洗脱得白色固体3c(65 mg),收率52%;MS m/z:378.06 [M+H]+。1H-NMR(400 MHz,DMSO)δ:9.99(s,1H,NH),8.32(d,1H,J=8 Hz,ArH),8.17(d,1H,J=5.6 Hz,ArH),7.93(dd,1H,J=11.2,1.2 Hz,ArH),7.56(t,1H,J=8 Hz,ArH),7.40(d,1H,J=8.8 Hz,ArH),7.27(m,2H,ArH),7.19(t,1H,J=7.6 Hz,ArH),7.10(d,1H,J=8 Hz,ArH),6.50(m,2H,ArH),5.32(s,1H,NH),4.12(s,3H,CH3-H);13C-NMR δ:164.34,159.49,157.49,141.50,137.22,136.96,133.74,132.65,123.87,123.82,123.44,121.90,121.09,116.22,111.59,110.80,109.93,109.58,102.22,98.74,56.36。
2.2.4 噻吩-2-甲酸[4-(6, 7-二甲氧基-喹啉-4-氧基)-3-氟-苯基]-酰胺(4a)的制备按照化合物3a的合成方法,由2-噻吩羧酸68 mg(0.54 mmol)和2a 85 mg(0.27 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(2:1:0.036)洗脱得白色固体4a(55 mg),收率48%;MS m/z:425.03 [M+H]+。1H-NMR(600 MHz,DMSO)δ:10.54(s,1H,NH),8.50(d,1H,J=5.2 Hz,ArH),8.06(d,1H,J=3.3 Hz,ArH),7.98(dd,1H,J=13.0、2.1 Hz,ArH),7.91(t,1H,J=8.8 Hz,ArH),7.66(d,1H,J=8.7 Hz,ArH),7.55(s,1H,ArH),7.49(t,1H,J=9.0 Hz,ArH),7.42(s,1H,ArH),7.30~7.25(m,1H,ArH),6.49(d,1H,J=5.1 Hz,ArH),3.96(s,6H,CH3-H);13C-NMR δ:160.17,155.64,153.16,152.93,149.61,148.68,146.68,138.66,137.31,136.53,128.92,123.82,116.39,115.54,107.58,102.28,99.46,56.16。
2.2.5 噻吩-2-甲酸[3-氟-4-(7H-吡咯[2, 3-d]嘧啶-4-氧基)-苯基]-酰胺(4b)的制备按照化合物3a的合成方法,由2-噻吩羧酸78 mg(0.614 mmol)和2b 75 mg(0.307 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(3:1:0.048)洗脱得白色固体4b(53 mg),收率49%;MS m/z:355.11 [M+H]+。1H-NMR(600 MHz,DMSO-d)δ:12.30(s,1H,NH),10.47(s,1H,ArH),8.30(s,1H,ArH),8.04(d,1H,J=4.8 Hz,ArH),7.91(d,1H,J=7.2 Hz,ArH),7.86(dd,1H,J=16.2,3 Hz,ArH),7.57(dd,1H,J=12、1.8 Hz,ArH),7.52(t,1H,J=3.6 Hz,ArH),7.42(t,1H,J=13.2 Hz,ArH),7.26(t,1H,J=4.8 Hz,ArH),6.60(dd,1H,J=2.4、2.4 Hz,ArH);13C-NMR δ:173.21,163.97,156.32,153.18,145.13,138.52,137.06,136.57,129.18,123.83,121.72,116.32,111.45,109.72,105.42,99.52。
2.2.6 噻吩-2-甲酸[3-氟-4-(1H-吡咯[2, 3-b]吡啶-4-氧基)-苯基]-酰胺(4c)的制备按照化合物3a的合成方法,由2-噻吩羧酸53 mg(0.414 mmol)和2b 50 mg(0.204 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(3:1:0.048)洗脱得白色固体4b(36 mg),收率48%;MS m/z:354.21 [M+H]+。1H-NMR(600 MHz,DMSO-d)δ:11.81(s,1H,ArH),10.51(s,1H,NH),8.10(d,1H,J=5.4 Hz,ArH),8.05(d,1H,J=4.5 Hz,ArH),7.94(m,2H,ArH),7.61(d,1H,J=8.4 Hz,ArH),7.36(m,2H,ArH),7.26(t,1H,J=4.2 Hz,ArH),6.41(d,1H,J=6 Hz,ArH),6.27(m,1H,ArH);13C-NMR δ:160.56,157.63,154.73,153.11,151.55,144.70,139.90,132.83,130.06,128.63,124.76,124.15,117.23,109.85,109.48,109.22,101.21,97.25。
2.2.7 呋喃-2-甲酸[3-氟-4-(6, 7-二甲氧基喹啉-4-氧基)-3-氟-苯基]-酰胺(5a)的制备按照化合物3a的合成方法,由糠酸37 mg(0.33 mmol)和2a 90 mg(0.286 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(2:1:0.036)洗脱得白色固体5a(60 mg),收率52%;MS m/z:409.19 [M+H]+。1H-NMR(600 MHz,CDCl3-d)δ:8.51(d,1H,J=6 Hz,ArH),8.22(s,1H,NH),7.88(dd,1H,J=14.4、3.6 Hz,ArH),7.59(s,1H,ArH),7.55(d,1H,J=1.2 Hz,ArH),7.45(s,1H,ArH),7.39(m,1H,ArH),7.30(d,1H,J=5.4 Hz,ArH),7.28(t,1H,J=12.6 Hz,ArH),6.61(dd,1H,J=3、2.4 Hz,ArH),6.45(dd,1H,J=7.2、1.2 Hz,ArH),4.07(s,3H,CH3-H),4.05(s,3H,CH3-H);13C-NMR δ:160.07,155.89,153.21,149.58,148.77,147.23,146.80,137.35,136.14,123.89,115.89,115.52,112.86,109.56,107.74,102.26,99.41,56.17。
2.2.8 呋喃-2-甲酸[3-氟-4-(7H-吡咯[2, 3-d]嘧啶-4-氧基)-苯基]-酰胺(5b)的制备按照化合物3a的合成方法,由糠酸37 mg(0.33 mmol)和2b 70 mg(0.286 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(3:1:0.048)洗脱得白色固体5b(48 mg),收率50%;MS m/z:354.98 [M+H]+。1H-NMR(400 MHz,CDCl3-d)δ:12.30(s,1H,NH),10.47(s,1H,ArH),8.30(s,1H,ArH),8.04(d,1H,J=4.8 Hz,ArH),7.91(d,1H,J=7.2 Hz,ArH),7.86(dd,1H,J=16.2、3 Hz,ArH),7.57(dd,1H,J=12、1.8 Hz,ArH),7.52(t,1H,J=3.6 Hz,ArH),7.42(t,1H,J=13.2 Hz,ArH),7.26(t,1H,J=4.8 Hz,ArH),6.60(dd,1H,J=2.4、2.4 Hz,ArH);13C-NMR δ:173.21,164.17,156.12,152.48,145.06,138.73,137.32,136.44,128.58,123.73,121.29,116.58,111.48,109.80,105.36,99.45。
2.2.9 呋喃-2-甲酸[3-氟-4-(1H-吡咯[2, 3-b]吡啶-4-氧基)-苯基]-酰胺(5c)的制备按照化合物3a的合成方法,由糠酸46 mg(0.396 mmol)和2c 50 mg(0.204 mmol)进行反应,粗品经硅胶柱色谱纯化,石油醚-醋酸乙酯-氨水(3:1:0.048)洗脱得白色固体5c(35 mg),收率51%;MS m/z:354.98 [M+H]+。1H-NMR(400 MHz,DMSO-d)δ:11.79(s,1H,NH),10.52(s,1H,ArH),8.08(d,1H,J=5.4 Hz,ArH),7.97(m,2H,ArH),7.67(d,1H,J=8.4 Hz,ArH),7.40(m,3H,ArH),6.73(s,1H,ArH),6.38(d,1H,J=5.4 Hz,ArH),6.27(s,1H,ArH);13C-NMR δ:157.62,156.78,151.55,147.59,146.52,144.71, 130.11,125.34,124.14,117.28,115.82,112.80,109.47,109.37,109.22,101.13,97.23。
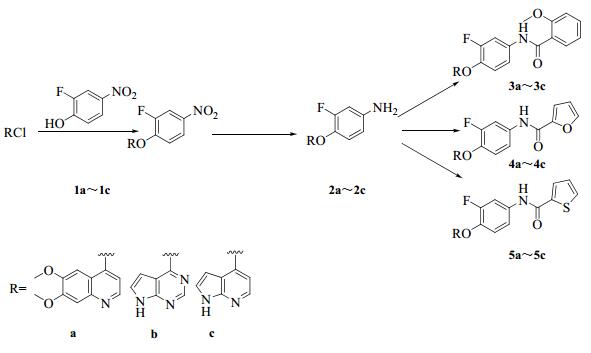
目标化合物3a~5c的合成路线见图 2。
|
图 2 目标化合物的合成路线 Fig. 2 Synthetic route of target compounds |
2.3 体外活性试验
以BMS-2为阳性对照药,采用MTT法对合成的苯酰胺类化合物进行体外抗肿瘤活性测试,所选用的肿瘤细胞为人胃癌细胞GTL-16[13]。用含0.5%血清的培养基将对数生长期的细胞制成细胞悬液,接种于96孔板中,每孔体积100 μL,置于37 ℃、5% CO2恒温箱中培养。孵育24 h使细胞贴壁。将待测的化合物用DMSO助溶,同时用完全培养基稀释至相应浓度(DMSO浓度为0.1%),药物浓度分别为1 000、500、200、40、8 nmol/L,BMS-2浓度分别为20、10、5、2.5、1.25 nmol/L,每个浓度设4个复孔,药物作用72 h,加药培养结束后,每孔加入无血清培养基100 μL和5 mg/mL MTT溶液10 μL,37 ℃,5% CO2条件下避光培养4 h后,每孔再加入DMSO 100 μL震荡使结晶溶解。用酶标仪检测490 nm处的吸光度(A)值,计算被测物对肿瘤细胞的抑制率[抑制率=(A对照-A实验)/A对照],用Graphpad Prism 5.0计算IC50。见表 1。可见目标化合物对GTL-16肿瘤细胞的增殖有一定的抑制作用,除4b、4c、5c外其他化合物对GLT-16细胞的抑制活性均小于1 000 nmol/L,其中活性最佳的为3c,IC50值达到411 nmol/L。
| 表 1 目标化合物对GTL-16细胞增殖的抑制作用 Table 1 Antitumor effects of target compounds against GTL-16 cells |
3 讨论
3-氟-4-苯胺化合物(2)的合成参照文献报道方法[11],本实验将取代、还原两步反应合并为一步反应,方法简单便捷,产率提高。在进行还原反应时,首先尝试10%乙醇作为溶剂,Zn粉作为还原剂进行反应,后处理繁琐,之后选择93%乙醇作为溶剂,Zn粉作为还原剂,发现反应速度过快,最终实验选择93%乙醇作为溶剂,Fe粉作为还原剂,以1个当量为起始加入量,分批加入,TLC监测反应进程,最终反应完全,副产物少,产率为62%~68%。
酰胺化合物(3a~5c)的形成具有多种缩合方法,缩合剂的不同对实验有着重要的影响。本实验前期合成酰胺化合物,首先将不同的酸与氯化亚砜反应形成酰氯,之后与相应的胺进行缩合,得到酰胺化合物。但是该反应对无水条件要求高,且反应进程不宜控制,杂点多,纯度低。之后以TBTU为缩合剂进行反应,杂质的生成有所减少,但是对比HATU为缩合剂时反应时间长,且杂质多。故最后选用HATU作为缩合剂进行反应,形成酰胺化合物产率为48%~54%。
对合成的9个苯酰胺类c-Met激酶抑制剂进行体外抗肿瘤活性筛选,其中3a~3c在GTL-16细胞上有相对较好的药效活性,Block A为苯环时活性优于五元环结构,五元环取代时呋喃取代的化合物活性高于噻吩取代的化合物,当Block A同为邻甲氧基苯环时,喹啉环取代的酰胺化合物活性优于氮杂嘌呤结构和氮杂吲哚的结构,对GTL-16细胞的IC50为411 nmol/L,但是相比较阳性对照药BMS-2还存在一定差距,分析原因可能是Block A部分没有与c-Met激酶完全结合,因此以后的工作将对该部分进行进一步的结构修饰,具有一定研究的价值。
| [1] |
Jung K H, Park B H, Hong S S.
Progress in cancer therapy targeting c-Met signaling pathway[J]. Arch Pharm Res , 2012, 35 (4) : 595–604.
DOI:10.1007/s12272-012-0402-6 ( 0) 0)
|
| [2] |
李永文, 刘红雨, 陈军.
肺癌细胞中HGF/c-Met信号通路的异常调控及其靶向药物研究进展[J]. 中国肺癌杂志 , 2014, 17 (8) : 625–634.
( 0) 0)
|
| [3] |
Garajová I, Giovannetti E, Biasco G, et al.
c-Met as a target for personalized therapy[J]. Transl Oncogenomics , 2015, 7 (Suppl 1) : 13–31.
( 0) 0)
|
| [4] |
Timofeevski S L, Mctigue M A, Ryan K, et al.
Enzymatic characterization of c-Met receptor tyrosine kinase oncogenic mutants and kinetic studies with aminopyridine and triazolopyrazine inhibitors[J]. Biochemistry , 2009, 48 (23) : 5339–5349.
DOI:10.1021/bi900438w ( 0) 0)
|
| [5] |
Liu X, Wang Q, Yang G, et al.
A novel kinase inhibitor, INCB28060, blocks c-MET-dependent signaling, neoplastic activities, and cross-talk with EGFR and HER-3[J]. Clin Cancer Res , 2011, 17 (22) : 7127–7138.
DOI:10.1158/1078-0432.CCR-11-1157 ( 0) 0)
|
| [6] |
Nakagawa T, Tohyama O, Yamaguchi A, et al.
E7050:a dual c-Met and VEGFR-2 tyrosine kinase inhibitor promotes tumor regression and prolongs survival in mouse xenograft models[J]. Cancer Sci , 2010, 101 (1) : 210–215.
DOI:10.1111/cas.2009.101.issue-1 ( 0) 0)
|
| [7] |
Kwon Y, Smith B D, Zhou Y, et al.
Effective inhibition of c-MET-mediated signaling, growth and migration of ovarian cancer cells is influenced by the ovarian tissue microenvironment[J]. Oncogene , 2013, 34 (2) : 144–153.
( 0) 0)
|
| [8] |
Qi B, Tao H, Wu D, et al.
Synthesis and biological evaluation of 4-phenoxy-6, 7-disubstituted quinolines possessing semicarbazone scaffolds as selective c-Met inhibitors[J]. Arch Pharm (Weinheim) , 2013, 346 (8) : 596–609.
DOI:10.1002/ardp.v346.8 ( 0) 0)
|
| [9] |
史大阔.基于C-Met靶点的抗肿瘤药物及Combretastatin A-4类似物的设计、合成与生物活性研究[D].青岛:中国海洋大学, 2012.
( 0) 0)
|
| [10] |
倪春燕, 张虞婷, 赵育, 等.
吡唑并[1, 5-a]嘧啶类c-Met激酶抑制剂的合成及生物活性研究[J]. 有机化学 , 2012, 32 (12) : 2294–2299.
( 0) 0)
|
| [11] |
Li S, Jiang R, Qin M, et al.
Synthesis and antitumor activity of novel 4-(2-fluorophenoxy)quinoline derivatives bearing the 4-oxo-1, 4-dihydroquinoline-3-carboxamide moiety[J]. Arch Pharm (Weinheim) , 2013, 346 (7) : 521–533.
DOI:10.1002/ardp.v346.7 ( 0) 0)
|
| [12] |
Zhang W, Ai J, Shi D, et al.
Discovery of novel type Ⅱ c-Met inhibitors based on BMS-777607[J]. Eur J Med Chem , 2014, 80 : 254–266.
DOI:10.1016/j.ejmech.2014.04.056 ( 0) 0)
|
| [13] |
Kim K S, Zhang L, Schmidt R, et al.
Discovery of pyrrolopyridine-pyridone based inhibitors of Met kinase:synthesis, X-ray crystallographic analysis, and biological activities[J]. J Med Chem , 2008, 51 (17) : 5330–5341.
DOI:10.1021/jm800476q ( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


