原发性肝癌是世界上严重威胁人类健康的恶性肿瘤之一,目前肝癌已排在全球癌症死因的第3位[1],全球每年新发肝癌约75万人,而我国占半数以上[2]。肝癌的治疗主要是手术切除,但80%的肝癌患者有不能切除或进展性的病灶,而即使那些行手术切除的患者2年内复发率也高达50%。早期患者治疗机会多,取得的疗效也更确切[3]。系统性化疗大部分无效且对肝功能不全的患者有明显的毒性,且80%以上进展期原发性肝癌患者的病情不能通过肝移植、肝脏局部治疗等控制病情发展。近年来,一些中药的提取物成为抗肝癌药物研究的热点,苦参碱是苦参根中提取的活性成分之一,大量研究表明苦参碱体外有抑制肝癌细胞增殖、诱导肝癌细胞自噬、凋亡作用[4-6],临床研究也表明苦参碱对肝癌有抑制作用[7-8]。Survivin属于凋亡抑制蛋白家族成员(inhibitor of apoptosis gene family,IAP),是目前发现的作用最强的凋亡抑制蛋白。多项研究表明Survivin在肝癌中高表达[9-10],可能成为肝癌基因治疗的新靶点[11]。本研究建立裸鼠人肝癌细胞HepG2荷瘤模型,观察不同剂量苦参碱对裸鼠瘤体生长有无抑制作用,以进一步证实苦参碱的抗肝癌作用,并通过免疫组化及RT-PCR检测瘤体凋亡抑制蛋白Survivin的表达,以进一步观察苦参碱对瘤体Survivin的调节作用。
1 材料 1.1 仪器BH-2普通光镜:日本Olympus公司;TGL216G高速台式离心机:Sigma公司;MSC1.2 FACS calibur超净工作台:Thermo公司;RKI100-B CO2细胞培养箱:REVCO-ELITE2;Applied Biosystems 7300 Real-Time PCR仪。
1.2 药物与试剂苦参碱购自中国食品药品检定研究院,质量分数98%,用无菌注射用水配制成0.5、1.0、1.5 mg/mL溶液。
兔抗人Survivin多克隆抗体购自Santa-Cruz公司,批号sc-10811。Envision试剂盒购自Dako公司。逆转录试剂盒:High-Capacity cDNA Reverse Transcripition Kits,批号PN4368814;RT-PCR试剂盒:Power SYBR Green PCR Master Mix,批号PN4368577,美国ABI公司。Trizol试剂:Invitrogen公司。氯仿、异丙醇、75%乙醇(DEPC H2O配制),DEPC水。
1.3 动物雄性BALB/C裸鼠,8周龄,开始实验时体质量(20±2.5)g,购于中国食品药品检定研究院实验动物中心,许可证号SCXK(京)2005-0004。所有裸鼠分笼饲养于中日友好医院临床研究所动物房,SPF级,采用标准化光照及饮食,适应期1周,处死前12 h开始禁食。
2 方法 2.1 分组BALB/C裸鼠随机分为对照组和苦参碱25、50、75 mg/kg组,每组各10只。
2.2 肝癌细胞HepG2移植瘤模型的建立收集对数生长期的人肝癌细胞HepG2,调整浓度为5×107/mL,用一次性注射器将细胞注射至BALB/C裸鼠右侧腋窝皮下,0.1 mL/只,连续10 d,瘤块长至约5 mm×5 mm×5 mm认为建模成功,成瘤率为100%。
2.3 给药苦参碱人用临床用药剂量为150 mg/d,约2~3 mg/(kg·d)。小鼠用药剂量与人临床用药剂量换算系数约为12,应为24~36 mg/(kg·d),因此本实验选用苦参碱组小鼠剂量为25、50、75 mg/kg。
对照组ip生理盐水1 mL,1次/d;苦参碱25、75、150 mg/kg组分别ip 0.5、1.0、1.5 mg/mL苦参碱溶液1 mL,1次/d。连续给药35 d。
2.4 瘤体体积的测定每3天测量肿瘤长、短径,计算瘤体体积。第35天处死全部裸鼠,称定瘤质量,计算瘤体积,绘制肿瘤生长曲线,并计算瘤体积抑制率。
瘤体体积=长径×短径2
瘤体积抑制率=(对照组平均瘤体积-给药组平均瘤体积)/对照组平均瘤体积
2.5 瘤体HE染色病理检查将所有裸鼠瘤体等分为2份,1份用10%甲醛固定、石蜡包埋,每例标本连续切片,每张切片厚5 μm,分别供常规HE染色和Survivin免疫组织化学染色使用。另1份放入液氮保存,供RT-PCR法测定使用。
石蜡切片脱蜡,Harriss苏木精染色,伊红复染,脱水,透明,封片,进行瘤体HE染色病理检查。
2.6 瘤体免疫组化染色检查和Survivin蛋白表达量的测定石蜡切片脱蜡水化,修复抗原,正常非免疫动物血清孵育,分别加入一抗(Survivin抗体)、二抗孵育;DAB显色,脱水,透明,封片,进行SP染色检查。
用磷酸盐缓冲液代替一抗作阴性对照,以试剂盒中所附已知阳性切片为阳性对照。阴性(-)为没有或仅有弱的染色,或阳性细胞率<10%;阳性(+)为>10%的细胞呈阳性染色。结果分析采用ipp 6.0图像处理软件对蛋白表达进行半定量。光镜下放大400倍,每张切片随机选取至少5个视野拍照,测量其阳性表达区域的累积吸光度值为Survivin蛋白表达量。
2.7 RT-PCR法测定瘤体Survivin mRNA相对表达量Trizol法提取组织RNA,加入Invitrogen公司M-MuLV反转录酶1 mL,混匀,37 ℃孵育50 min,70 ℃加热灭活15 min。用DEPC水(无核酸酶污染)将反应体系稀释到50 μL,取1 μL进行PCR扩增反应。合成Survivin引物:上游引物5'AAG GAC CACCGCATCTCT3',下游引物5'CAAGTCTGG CTCGTTCTCA3',引物溶解为20 μmol/L。96孔反应板上,使用PCR Core reagent kit,总体积为15 μL,三管平行样。按下列体系加样:cDNA模板0.5 μL,ddH2O 5 μL,2×Applied Biosystems PCR master mix buffer 7.5 μL,正向引物(20 μmol/L)0.5 μL,反向引物(20 μmol/L)0.5 μL。使用Applied Biosystems 7300 Real-Time PCR System实时数据采集模 式,循环反应参数为95 ℃ 10 min;然后95 ℃ 15s,60 ℃ 40 s,循环40次。选择GAPDH作为内参对照,每次做Real Time PCR都要走内对照和目标基因,首先计算目标基因与内对照基因CT的差(ΔCT),然后比较对照组、苦参碱组之间Survivin基因的ΔCT差异,即不同组的表达差异。
2.8 统计学处理计量数据以x±s表示,采用SPSS 18.0统计软件进行数据处理,采用单因素方差分析。
3 结果 3.1 对瘤体体积的影响治疗前,各组裸鼠瘤体体积比较差异无统计学意义。治疗后,与对照组比较,苦参碱50、75 mg/kg组裸鼠瘤体体积显著减小(P<0.01),见表 1。可见,苦参碱抗裸鼠人肝癌细胞HepG2荷瘤模型的移植瘤的有效质剂量为50 mg/kg,并且苦参碱50、75 mg/kg的瘤体积抑制率分别为42.0%、43.7%。
| 表 1 苦参碱对荷瘤裸鼠瘤体体积的影响(x±s,n = 10 ) Table 1 Effect of matirine on volume of implanted tumor of nude mice (x±s,n = 10) |
以时间为横坐标,瘤体体积为纵坐标,绘制肿瘤生长曲线,见图 1。可见苦参碱组裸鼠瘤体生长速度较对照组减慢,给药2周后明显。
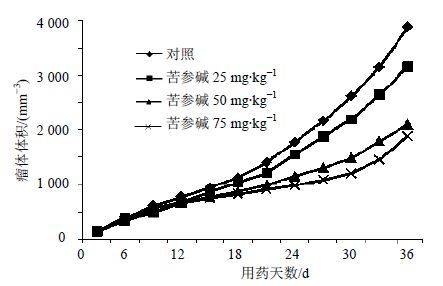
|
图 1 各组荷瘤裸鼠的肿瘤生长曲线 Fig. 1 Growth curves of mice implanted tumor |
3.2 瘤体病理观察
肉眼观察可见瘤体包膜完整,白色,切面呈鱼肉状或豆腐渣样,可见出血、坏死;苦参碱组瘤体体积小于对照组,且出血、坏死较对照组少,剂量越大越明显。镜下观察可见肝癌细胞成团分布,胞浆嗜碱性,胞浆少,核大,染色质致密,可见较多核分裂相。苦参碱组的肝癌细胞分布较对照组稀疏,且剂量越大越明显。见图 2。
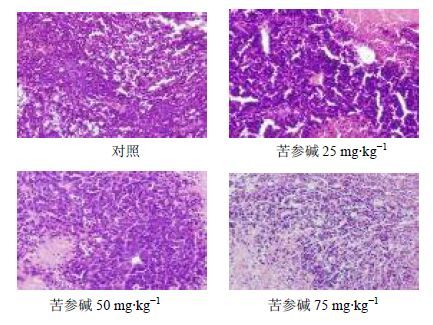
|
图 2 裸鼠瘤体病理切片(HE染色) Fig. 2 Pathological section of implanted tumor in nude mice (HE staining) |
3.3 瘤体免疫组化染色观察
阳性反应产物呈棕黄色细颗粒状,为胞质着色。对照组和苦参碱25 mg/kg组有较多Survivin表达于细胞质,苦参碱50、75 mg/kg组仅有少量Survivin表达于细胞质,见图 3。
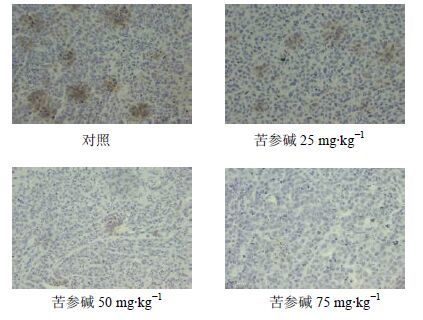
|
图 3 Survivin在裸鼠瘤体的表达(SP染色) Fig. 3 Expression of Survivin in implanted tumor in nude mice (SP staining) |
3.4 对Survivin蛋白表达量的影响
与对照组比较,苦参碱50、75 mg/kg组裸鼠Survivin蛋白表达量显著减小(P<0.01),见表 2。这与苦参碱对肿瘤生长的抑制作用的大体观察结果
| 表 2 苦参碱对Survivin蛋白表达量的影响(x±s,n = 10 ) Table 2 Effect of matirine on expression of Survivin (x±s,n = 10) |
是一致的,即苦参碱下调裸鼠HepG2细胞移植瘤的Survivin表达的有效质量浓度为50 mg/kg。
3.5 对Survivin mRNA相对表达量的影响与对照组比较,苦参碱50、75 mg/kg组裸鼠Survivin mRNA相对表达量显著减小(P<0.01),见表 3、图 4。这与苦参碱对裸鼠HepG2细胞移植瘤瘤体Survivin蛋白的调节作用结果是一致的,即苦参碱下调裸鼠HepG2细胞移植瘤的Survivin mRNA表达的有效质量浓度为50 mg/kg。
| 表 3 苦参碱对裸鼠Survivin mRNA相对表达量的影响(x±s,n = 10 ) Table 3 Effect of matirine on relative expression of Survivin mRNA(x± s,n = 10) |
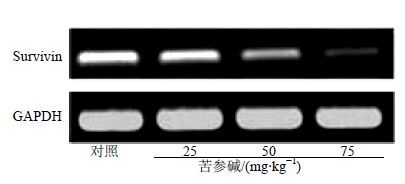
|
图 4 苦参碱对裸鼠Survivin mRNA相对表达量的影响 Fig. 4 Effect of matirine on relative expression of Survivin mRNA |
4 讨论
原发性肝癌通常由慢性病毒性肝炎、非酒精性脂肪性肝病、酒精性肝病、胆汁淤积性肝病及药物性肝病等引起。其治疗方法主要依靠手术切除,但肝癌早期诊断困难,发现时多已经有转移,失去手术机会。目前为止仍然没有公开发表的证据显示系统性化疗能够改善任何类型的原发性肝癌的整体生存率,迄今肝癌化疗没有标准方案。一些中草药治疗肝癌有肯定的疗效且毒副作用小,近年来越来越引起关注。苦参碱是豆科植物苦参、苦豆子及广豆根等中的活性成分,是苦参碱类生物碱的代表。大量体内外研究表明,苦参碱具有抗肝癌的作用,其机制可能与调节细胞凋亡相关因子、癌基因及抑癌基因、端粒酶及免疫功能等有关。本研究结果表明苦参碱对人肝癌细胞HepG2移植瘤裸鼠的瘤体生长具有抑制作用,苦参碱50、75 mg/kg组裸鼠移植瘤瘤体体积明显小于对照组,瘤体积抑制率分别达42.0%、43.7%。各组裸鼠病理改变提示苦参碱组瘤细胞分布较对照组稀疏,瘤细胞数量少,且前期的体外细胞实验表明苦参碱可以诱导HepG2细胞凋亡[12],因此推测苦参碱可能通过诱导移植瘤瘤体中肝癌细胞HepG2的凋亡,从而抑制移植瘤的生长。前期动物实验提示苦参碱对大鼠原发性肝癌有防治作用,其机制可能与下调IAP家族成员之一Survivin的表达有关[13],因此本研究观察苦参碱对人肝癌细胞HepG2移植瘤Survivin蛋白及mRNA表达的影响,以进一步证明苦参碱对Survivin的调节作用,从而探讨苦参碱抗肝癌的机制。
细胞凋亡在控制细胞增殖中起关键性的作用,是抑制肿瘤发展的关键[14]。对凋亡过程的了解为新的特异性的诱导癌细胞系死亡的靶向治疗提供了基础,这些新的药物作用靶点包括内源性途径如肿瘤坏死因子相关的凋亡诱导序列受体1和Bcl-2家族途径和蛋白控制凋亡体系,如P53、核因子κB及PI3-激酶途径等。Survivin是1997年发现的IAP家族成员之一,定位于人染色体17q25,编码相对分子质量为16 500的蛋白质,具有调节细胞分裂和抑制细胞凋亡的双重作用[15]。在终末分化组织中不表达或低表达,而在人类多种肿瘤组织中高表达[16];与肿瘤进展、预后、复发及耐药密切相关[9]。凋亡在肝癌细胞的生长及分化的各个阶段中起着重要作用,增殖凋亡比的失调通常是由细胞凋亡的调节紊乱引起的[17]。大量研究显示Survivin与肝癌细胞的生成、增殖及凋亡有明显相关,Survivin在肝癌中高表达[18],与肝癌的分化程度相关[19]。Survivin与肝癌预后相关可作为肝癌切除术后的预后预测因子。肝癌切除术患者Survivin mRNA阳性表达者术后复发率高于阴性表达者[20]。研究显示Survivin主要通过抑制凋亡核心蛋白caspase3和caspase7,影响它们在细胞微管的聚合、解聚,使肿瘤细胞逃逸G2/M检测关卡而获得恶性增殖潜能。Survivin可以依赖细胞增殖信号介导进入核内,与细胞周期调节子CDK4结合,激活CDK2/CyclinE,并使Rb磷酸化。磷酸化的Rb失去了对细胞生长的抑制作用,导致细胞的异常增殖。Survivin/CDK4复合物使p21从p21/CDK4复合物中释放出来,并作用于procaspase-3,形成procaspase-3/p21复合物,抑制procaspase-3活化为caspase-3,实现Survivin的抗凋亡作用。Survivin还能够直接作用于caspase,阻止由caspase激活剂或凋亡诱导剂诱导的细胞内相关自杀酶的积累,从而阻断细胞的凋亡过程。
本研究中免疫组化染色证实Survivin在裸鼠人肝癌细胞HepG2移植瘤瘤体中高表达,而苦参碱可以下调Survivin的表达,有效剂量为50 mg/kg。RT-PCR法测定结果也显示苦参碱可以下调Survivin mRNA的表达,有效剂量为50 mg/kg,这与苦参碱对裸鼠人肝癌细胞HepG2移植瘤瘤体生长的抑制作用的实验结果是一致的。
已经有实验研究显示以Survivin为靶向的基因治疗可以降低肿瘤内Survivin的表达,促进肿瘤细胞凋亡,促进肿瘤血管形成过程中内皮细胞的凋亡,并能逆转肿瘤耐药性等[21-22],因此有理由期待可以在基因及蛋白水平下调Survivin表达的苦参碱将会惠及广大肝癌患者。
综上所述,苦参碱具有抑制人肝癌细胞HepG2荷瘤裸鼠的瘤体生长的作用,其机制可能为在转录和翻译水平抑制裸鼠移植瘤瘤体细胞即HepG2细胞Survivin的表达,诱导肝癌细胞的凋亡。
| [1] |
Parkin D M, Bray F, Ferlay J, et al. Estimating the world cancer burden: Globocan 2000[J].
Int J Cancer,2001, 94 (2) : 153-156.
( 0) 0)
|
| [2] |
Jemal A, Bray F, Center M, et al. Global cancer statistics[J].
CA Cancer J Clin,2011, 61 (2) : 69-90.
( 0) 0)
|
| [3] |
Marrero J A. Current Treatment Approaches in HCC[J].
Clin Adv Hematol Oncol,2013 (4) : 15-18.
( 0) 0)
|
| [4] |
雷娜, 樊慧婷, 李杰, 等. 苦参碱和氧化苦参碱对人肝癌细胞株SMMC-7721凋亡的影响[J].
国际中医中药杂志,2014, 36 (11) : 1017-1020.
( 0) 0)
|
| [5] |
范悦, 王世明, 石青青. 苦参碱对肝癌细胞增殖及其细胞自噬的影响[J].
中国当代医药,2013, 20 (7) : 11-13.
( 0) 0)
|
| [6] |
孟凡, 张自翔, 谢军, 等. 苦参碱对人肝癌细胞HepG2凋亡和PEG10表达的影响[J].
实用医学杂志,2014, 30 (10) : 1523-1526.
( 0) 0)
|
| [7] |
劳溢权. 原发性肝癌肝动脉栓塞化疗后苦参碱注射液护肝治疗的临床观察[J].
中药材,2005, 28 (7) : 637-638.
( 0) 0)
|
| [8] |
梁建新, 曾文铤, 朱科伦, 等. 苦参碱联合介入化疗栓塞治疗中晚期肝癌疗效观察[J].
广州医药,2005, 36 (3) : 45-47.
( 0) 0)
|
| [9] |
Jin Y, Chen J, Feng Z, et al. The expression of Survivin and NF-κB associated with prognostically worse clinicopathologic variables in hepatocellular carcinoma[J].
Tumour Biol,2014, 35 (10) : 9905-9910.
( 0) 0)
|
| [10] |
谷旭, 王夏青, 任万华, 等. NPRL2、Survivin在肝细胞肝癌中的表达及其临床意义[J].
山东大学学报: 医学版,2015, 53 (6) : 68-72.
( 0) 0)
|
| [11] |
Li G, Chang H, Zhai Y P, et al. Targeted silencing of inhibitors of Apoptosis proteins with siRNAs: a potential anti-cancer strategy for hepatocellular carcinoma[J].
Asian Pac J Cancer Prev,2013, 14 (9) : 4943-4952.
( 0) 0)
|
| [12] |
朱丹丹, 姚树坤, 闫建国, 等. 苦参碱对人类肝癌细胞HepG2增殖、周期及凋亡的影响[J].
肿瘤研究与临床,2010, 22 (11) : 745-747.
( 0) 0)
|
| [13] |
朱丹丹, 姚树坤, 闫建国, 等. 苦参碱对大鼠原发性肝癌的防治作用及其机制研究[J].
中华肿瘤防治杂志,2010, 17 (4) : 241-244.
( 0) 0)
|
| [14] |
Ghobrial I M, Witzig T E, Adjei A A. Targeting apoptosis pathways in cancer therapy[J].
CA Cancer J Clin,2005, 55 (3) : 178-194.
( 0) 0)
|
| [15] |
Ouhtit A, Matrougui K, Bengrine A, et al. Survivin is not only a death encounter but also a survival protein for invading tumor cells[J].
Front Biosci,2007 (12) : 1260-1270.
( 0) 0)
|
| [16] |
Kanwar J R, Kamalapuram S K, Kanwar R K, et al. Survivin signaling in clinical oncology: a multifaceted dragon[J].
Med Res Rev,2013, 33 (4) : 765-789.
( 0) 0)
|
| [17] |
Zhang R, Wang T, Li KN, et al. A survivin double point mutant has potent inhibitory effect on the growth of hepatocellular cancer cells[J].
Cancer Biol Ther,2008, 7 (4) : 547-554.
( 0) 0)
|
| [18] |
张永臣, 叶伟, 文剑, 等. 肝细胞癌中抑制细胞凋亡相关基因的差异表达[J].
南京医科大学学报: 自然科学版,2009, 29 (9) : 1224-1228.
( 0) 0)
|
| [19] |
Sun Y, Lin R, Dai J, et al. Suppression of tumor growth using antisense oligonucleotide against Survivin in an orthotopic transplant model of human hepatocellular carcinoma in nude mice[J].
Oligonucleotides,2006, 16 (4) : 365-374.
( 0) 0)
|
| [20] |
Ye C P, Qiu C Z, Huang Z X, et al. Relationship between survivin expression and recurrence, and prognosis in hepatocellular carcinoma[J].
World J Gastroenterol,2007, 13 (46) : 6264-6268.
( 0) 0)
|
| [21] |
Yang J H, Zhang Y C, Qian H Q. Survivin antisense oligodeoxynucleotide inhibits growth of gastric cancer cells[J].
World J Gastroenterol,2004, 10 (8) : 1121-1124.
( 0) 0)
|
| [22] |
Ansell S M, Arendt B K, Grote D M, et al. Inhibition of survivin expression suppresses the growth of aggressive non hodgkings lymphoma[J].
Leukemia,2004, 18 (3) : 616-623.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


