2. 天津泰普药品科技发展有限公司, 天津 300193;
3. 天津药物研究院 医药信息中心, 天津 300193;
4. 天士力控股集团有限公司, 天津 300410
2. Tianjin Taipu Pharmaceutical Science & Technology Development Co., Ltd., Tianjin 300193, China;
3. Center of Drug Informatics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
4. Tasly Holding Group Co., Ltd., Tianjin 300410, China
通用名:roxadustat
别名:ASP1517;FG-4592
化学名:N-(4-羟基-1-甲基-苯氧基异喹啉-3-羰基)甘氨酸
CAS:808118-40-3
分子式:C19H16N2O5
相对分子质量:352.3407
结构见图 1
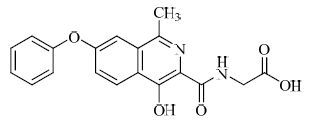
|
图 1 roxadustat 的结构 Fig. 1 Structure of roxadustat |
原研公司:FibroGen Inc
药理分类:低氧诱导因子脯氨酰羟化酶抑制剂
适应症:肾性贫血
目前阶段:Ⅲ期临床
给药途径:口服
2 相关背景糖尿病和高血压会导致慢性肾病的发生,并逐渐发展为肾衰竭。随着慢性肾病的发展,贫血的发生率也随之不断升高,并且由此导致血红蛋白浓度低于正常值。由于血红蛋白下降,贫血患者血液输氧能力也降低,从而出现包括疲劳、体力不支、呼吸急促和心绞痛等在内的一系列症状。贫血成为慢性肾病的重要并发症之一,降低了慢性肾病患者的生活质量,包括认知功能障碍、睡眠障碍、心血管并发症和较高的死亡率等[1]。
肾性贫血的病因可能是多种多样的,但是究其主因,仍旧是肾脏合成红细胞生成素绝对或相对不足。因此,现今的治疗药物也以红细胞生成刺激剂为主。红细胞生成刺激剂的使用使患者病情得到控制,治疗费用也大大下降[2]。随着人们对红细胞生成刺激剂制剂研究的深入,对目前临床应用的红细胞生成刺激剂制剂也存在许多担忧,因为其可能导致红细胞生成素浓度高于正常生理循环的需求,从而引发不良心血管反应甚至是死亡。近几年开始探索新型的红细胞生成刺激剂制剂。
roxadustat是一种新型的口服低氧诱导因子脯氨酰羟化酶抑制剂。低氧诱导因子是一种胞浆转录因子,能够通过刺激红细胞生成等途径诱导低氧条件下的自然生理学反应。实验证明roxadustat可以诱导红细胞生成,而且是一种稳定的低氧诱导因子。因此,无论是尚未接受透析的慢性肾病患者或是需要透析治疗的末期肾病患者,都能使用Roxadustat治疗贫血,且不需要静脉补铁。现有临床数据表明,低氧诱导因子脯氨酰羟化酶抑制剂诱导的内源性红细胞生成素升高是适度且一过性的,耐受性良好,到目前为止没有发现心血管事件风险升高。这也表明roxadustat具有独特的药理学和临床性质,能够为肾性贫血患者提供更加安全便利的治疗。
2014年FibroGen公司以1.1类新药向中国申报开展roxadustat临床试验,中文名为可博美胶囊,现已在我国开展Ⅲ期临床研究,预计可于2017年获得新药上市的许可,这是非常罕见的首创新药选择首先在中国上市。
3 合成路线[3]4-苯氧基苯二甲酸和甘氨酸在215 ℃发生环化反应生成邻苯二甲酰亚胺类中间体1。化合物1和甲醇在硫酸中回流发生酯化反应生成甲酯中间体 2,后续在97 ℃正丁醇溶液中,金属钠作用下进行重排,经快速色谱法纯化得到异喹啉-2-羧酸酯(3)。化合物3在碳酸氢钠/乙腈溶液中与三溴氧磷反应生成丁基8-溴-3-羟基-6-苯氧基异喹啉-2-羧酸酯(4)。化合物4在水/乙醇中回流,经碱性氢氧化钠水解反应生成羧酸化合物中间体5。在−78 ℃四氢呋喃溶液中,中间体5与丁基锂和碘甲烷反应后再与苄基溴/碳酸钾在丙酮溶液中回流反应,得到2-甲基异喹啉衍生物6。中间体6在氢氧化钾的甲醇溶液中发生酯水解反应生成化合物7。化合物7在二氯甲烷溶液中经氯甲酸异丁酯和三乙胺活化后与苄基甘氨酸盐酸盐缩合反应,生成苄基酯中间体8。最后,中间体8在醋酸乙酯/甲醇溶液中经氢气、Pd/C脱苄基,生成目标化合物roxadustat,合成路线见图 2。
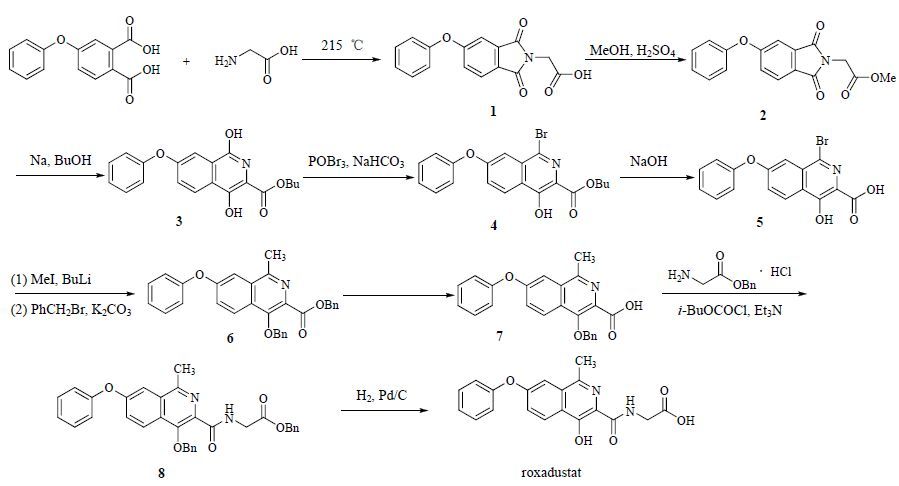
|
图 2 roxadustat 的合成路线 Fig. 2 Synthetic route of roxadustat |
低氧诱导因子可以调节多种基因转录,如刺激细胞生成、形成新生血管、铁代谢等。低氧诱导因子在组织氧浓度绝对或相对不足时启动,结合低氧反应元件的靶基因,使细胞可以适应氧的变化,进而激活红细胞生成素,刺激红细胞生成。通常情况下,脯氨酰羟化酶结构域可以羟化低氧诱导因子,使其与von Hippel-Lindau蛋白结合,改善慢性肾病贫血。roxadustat通过抑制低氧诱导因子的降解,使机体在不缺氧的前提下继续转录出相关基因,下调铁调素水平、升高红细胞生成素、增强红细胞生成素受体及转铁蛋白受体活性、升高转铁蛋白和铜蓝蛋白水平等,进而发挥治疗贫血的作用。由于roxadustat并未明显升高红细胞生成素水平,有效避免了红细胞生成刺激剂使用中出现的不良反应,但又同时降低了血清铁调素、改善铁代谢、抗炎、调节血脂代谢、降低血压,对贫血的治疗效果良好[4]。
红细胞生成素的转录和生成直接受到肾脏中的HIF-2α蛋白控制,红细胞生成素生成增加会提高血中血红细胞和血红蛋白的浓度。此外,已经通过哺乳动物实验证实了脯氨酸羟化酶抑制剂通过稳定HIF-2α蛋白和增加红细胞生成素生成介导促红细胞生成作用。roxadustat已经被证实能够有效升高恒河猴和有肾脏或无肾脏的透析患者体内eEPO浓度[5]。
4.2 药动学[6, 7, 8, 9]通过一项针对血液透析患者和慢性肾病患者的Ⅰb期剂量升高临床试验确定了roxadustat的药效学、药动学、安全性和疗效。血液透析患者按照3∶1的随机比分为roxadustat组(1 mg/kg)和安慰剂组(2 mg/kg)。结果表明两组血中的红细胞生成素水平均在给药后4 h升高,峰浓度中位数分别为99.6、267.5 mU/mL(给药后8~12 h检测),在24~48 h后降到基线值。血液透析患者组的roxadustat消除率为3%~5%,不会对治疗产生不利影响。在慢性肾病患者群体中,两组患者随机接受roxadustat(1~4 mg/kg)治疗4周,数据表明roxadustat治疗能够被良好耐受并提高慢性肾病贫血患者的血红蛋白水平。血中红细胞生成素水平的峰值发生在给药后8~12 h。
根据来自中国健康受试者的研究数据,在试验中按照体质量在0.6~3 mg/kg内调整roxadustat剂量,发现药效数据为线性,且血红细胞和血红蛋白的升高较缓慢,roxadustat是安全的且能被良好耐受。在1 mg/kg剂量组中,roxadustat能够被迅速吸收,达峰时间为1.8 h,峰浓度为4.6~5.9 μg/mL,半衰期为8.35~12.3 h。
5 临床研究 5.1 I期临床2013年9月在保加利亚开展了一项开放性、非随机、单剂量的Ⅰ期临床试验,受试者为中度肝损伤患者和肝功能正常的健康人,对roxadustat的药动学、安全性和耐受性进行了评估,12月试验完成。
2011年3月在中国开展了一项Ⅰ期研究并在同年11月完成试验。研究数据在2013年6月公布。结果表明roxadustat能够诱导红细胞生成素水平呈指数幂线性特征,且在给药后约8~12 h达到峰值。药物按体质量调整剂量给药后,血红蛋白水平上升缓慢,但仍大致为线性。总的来说,roxadustat是安全的且耐受良好。中国境内的Ⅰ期研究在2015年3月全部完成。该研究表明中国受试者的roxadustat药动学参数与白色人种和日本患者数据相似;对内源性红细胞生成素的刺激也与白色人种和日本患者类似,且受试者能够良好耐受roxadustat的同时也没有出现安全性问题。
2009年8月在日本开展了Ⅰ期研究,2011年3月完成全部3项研究。2005年11月开展了一项单剂量、剂量递增的Ⅰ期贫血临床试验。提交的中期结果表明roxadustat能够在单剂量口服给药后使内源性红细胞生成素水平升高8倍,且没有出现严重不良事件。
在2011年4月提交的数据表明,roxadustat的药动学和药效学特征不会受到血液透析的影响。
5.2 Ⅱ期临床通过开展多个临床研究确定roxadustat的疗效和其对慢性肾病和/或血液透析患者由于肾衰竭导致红细胞生成素生成显著降低后的贫血、铁活化、血压和糖尿病的影响。对于贫血的3~4期慢性肾病患者来说,roxadustat能够通过短暂且适度的升高红细胞生成素水平来升高血红蛋白水平。在一项Ⅱ期研究中,117名受试者随机分配到roxadustat 0.7、1.0、1.5、2.0 mg/kg治疗组中,每周给药2或3次,持续4周。口服roxadustat并持续4周的给药方式能够被良好耐受,并在低于ESA文献值1~2个数量级的eEPO观测峰值时发现具有剂量相关性的血红蛋白水平校正。这些结论说明这可能是一种唯一的能够安全升高并保持血红蛋白水平并且避免在红细胞生成刺激剂治疗中常见的血栓形成或高血压反应的作用方式[10]。
在另一项研究中,96名在12周之前没有接受过红细胞生成刺激剂治疗的患者被随机分配到4个治疗组中,根据体质量调整剂量或固定口服roxadustat的剂量。患者每周服药3次,持续16或24周。试验中不允许患者静脉补铁。roxadustat给药4周后,所有治疗组患者血红蛋白对比基线水平均升高,共获得33名患者数据。对比基线数据,铁调素平均水平下降36%。roxadustat能够被慢性肾病患者良好耐受,且在未静脉补铁条件下能够改善贫血症状[11]。血液透析患者的Ⅱ期研究获得了相似的结论。共有48名受试者,要求患者停用红细胞生成素至少5 d,其中36名患者接受roxadustat(1.0、1.5、2.0 mg/kg)治疗,12名患者接受红细胞生成素治疗(采用随机化前剂量),患者每周给药3次,持续6周。不允许患者静脉补铁、输注血红细胞或使用红细胞生成刺激剂(除非随机化到红细胞生成素组)。在未静脉补铁条件下,roxadustat能够保持正常的血红蛋白水平,并产生与红细胞生成素组相比明显的、有剂量相关性的铁调素水平下降[12]。
roxadustat的初步Ⅱ期临床研究数据表明,血液透析患者通过口服补铁、静脉补铁或不补铁配合每周3次的roxadustat治疗后,平均血红蛋白水平升高不受患者基线铁水平和补铁方式的影响。上述发现表明roxadustat可以预防缺铁性红细胞生成,因此能够避免潜在的与静脉补铁相关的风险[13]。
还研究了患有终末期肾病的中国受试者血液透析治疗组患者是否能使用roxadustat取代红细胞生成素α。患者被随机分配到3个设计了稳定剂量给药红细胞生成素的治疗组中,要求患者血红蛋白水平保持在9.0~12.0 g/dL。与接受红细胞生成素治疗的受试者相比,接受roxadustat治疗后血红蛋白水平出现剂量相关性升高,血红蛋白水平明显较高且持续,达到了主要终点指标。将首个中国终末期肾病血液透析患者的roxadustat贫血治疗研究结论与美国终末期肾病患者的治疗数据进行了比较。
对于晚期慢性肾病,血脂障碍是造成心血管风险升高的主要原因。血液透析组中的中国终末期肾病受试者的总胆固醇和低密度胆固醇水平在roxadustat治疗后明显低于红细胞生成素组[14]。在一项Ⅱ期血液透析患者研究中得到了相似的结论。该试验中患者口服roxadustat治疗19周,每周给药3次。与接受红细胞生成素α治疗的患者相比,这些患者能在没有进行静脉补铁的条件下保持相应的血红蛋白水平,并降低总胆固醇和血中红细胞生成素水平[14]。
5.3 Ⅲ期临床多个Ⅲ期试验正在包括亚太地区、美国和欧洲在内的世界范围内进行[15, 16]。
5.3.1 稳定透析的终末期肾病贫血患者一项针对接受稳定透析治疗的终末期肾病受试者的随机、开放、阳性对照的Ⅲ期试验在2014年10月启动。该试验对比了roxadustat与红细胞生成素α、达依泊汀α在贫血维持治疗中的疗效和安全性。患者每周给药3次。试验预计在2018年2月完成,目前正在进行中。
另一项随机、开放、阳性对照的Ⅲ期临床试验在2014年10月启动,预计在2017年6月完成。该试验主要针对接受稳定透析的终末期肾病患者,比较了roxadustat和红细胞生成素α进行贫血维持治疗的疗效和安全性。患者每周给药3次。
5.3.2 透析的慢性肾病贫血患者FibroGen公司在2013年3月向国家食品药品监督管理总局申请将在中国进行一项roxadustat治疗慢性肾病贫血患者的研究,用于评估roxadustatt对贫血的透析慢性肾病患者的疗效和安全性。这项Ⅲ期试验是一项随机开放、多中心、阳性对照的研究,计划招募300名患者,每周给药3次,共持续26周,其中一些受试者可持续52周。主要终点为治疗23~27周后血红蛋白相对于基线值的平均变化。该试验于2015年9月启动,现正在进行中。
2014年6月,AstraZeneca公司在美国、欧洲和秘鲁进行了一项关键性的、多中心、随机开放、平行分组、阳性对照的Ⅲ期研究。该试验比较了roxadustat和红细胞生成素α治疗接受透析治疗的慢性肾病贫血患者的疗效和安全性。患者在该试验中每周给药3次。试验目前正在进行中,预期在2017年2月完成。
5.3.3 非透析的慢性贫血患者FibroGen公司在2013年3月向国家食品药品监督管理总局申请将在中国进行一项roxadustat治疗慢性肾病贫血患者的研究,用于评估roxadustat治疗非透析的慢性肾病贫血患者的疗效和安全性。这项Ⅲ期试验是一项随机、双盲、多中心、安慰剂对照的研究,计划招募150名患者,每周给药3次,共持续8周,之后为开放性治疗持续26周,其中一些受试者可持续52周。主要终点为治疗7~9周后血红蛋白相对于基线值的平均变化。该试验于2015年9月启动,现正在进行中。
2014年6月,AstraZeneca公司在美国、保加利亚、韩国和俄罗斯开展了一项Ⅲ期研究。这是一项关键性的、多中心、随机双盲、平行分组、安慰剂对照的临床试验,评估了非透析的慢性肾病患者使用roxadustat治疗贫血的安全性和疗效。患者每周给药3次。目前试验正在进行中,预期在2017年完成。
2013年9月,Astellas和FibroGen公司联合开展了一项随机、开放的Ⅲ期临床试验。这项试验比较了roxadustat和达依泊汀α治疗非透析治疗的慢性肾病患者贫血的效果。患者在试验中每周治疗1次、两次或3次。目前该试验正在进行中,预计在2017年完成。
5.3.4 透析和非透析的慢性肾病贫血患者一项用于证明透析和非透析的慢性肾病患者服药的心血管安全性的Ⅲ期临床研究在2015年5月开展。主要数据将在2016年底获得。
5.3.5 刚开始透析的终末期肾病贫血患者2013年12月,在保加利亚、韩国和俄罗斯开展了一项随机开放的Ⅲ期临床试验。该试验计划评估roxadustat治疗刚刚开始透析的终末期肾病患者贫血的安全性和疗效。试验计划招募大约750名患者并在2016年10月完成。
6 安全性roxadustat的耐受性良好,临床试验中没有出现包括心血管事件在内的严重不良事件。在1个剂量探索试验中出现了1例不良事件(恶心)[6];在药效学/药动学试验中有2名受试者出现了药物相关的突发性不良事件[7];另有1名受试者血压升高[10]。此外,终末期肾病患者报告了其病情特有的轻度或中度不良事件。1名接受红细胞生成素α治疗的受试者和1名接受roxadustat治疗的受试者报告出现了非严重心悸[15]。
7 结语roxadustat是一种口服给药的小分子低氧诱导因子脯氨酰羟化酶抑制剂,目前在美国、日本、中国和欧洲都开展了针对肾性贫血的临床研究。roxadustat作为一种低氧诱导因子稳定剂,其作用具有剂量相关性,对包括红细胞生成、提高红细胞生成素和对铁的利用均有影响,已证明是一种不受血液透析影响的贫血疗法[6]。
通过诱导由低氧诱导因子介导的红细胞生成,roxadustat相比现有贫血疗法具有明显优势。现有疗法主要基于红细胞生成素类似物取代激素、红细胞生成刺激剂制剂以及静脉补铁协同治疗。使用红细胞生成刺激剂制剂会导致红细胞生成素水平较高,随之导致高血压、血栓和心血管事件的发生率增加,从而增加患者的死亡率。相对而言,roxadustat诱导的红细胞生成素升高是短暂且更加符合生理学过程的,能够被患者良好耐受,且更加安全无害,同时能够降低总胆固醇水平,最终将成为慢性肾病患者治疗贫血的最佳选择。
| [1] | Stauffer M E, Fan T. Prevalence of anemia in chronic kidney disease in the United States [J]. PloS One, 2014, 9(1): e84943. |
| [2] | 徐潇漪, 谌贻璞. 新型红细胞生成刺激剂的现状与展望 [J]. 中国血液净化, 2010, 9(9): 467-470. |
| [3] | Arend M P, Flippin L A, Du X, et al. Nitrogen-containing heteroaryl compounds and their use in increasing endogenous erythropoietin [P]. WO: 2004108681, 2004-12-16. |
| [4] | 戴德淑, 任红旗. 慢性肾脏病相关性贫血的治疗新进展 [J]. 第二军医大学学报, 2015, 36(7): 776-781. |
| [5] | Forristal C E, Levesque J P. Targeting the hypoxia- sensing pathway in clinical hematology [J]. Stem Cells Transl Med, 2014, 3(2): 135-140. |
| [6] | Provenzano R, Tumlin J, Zabaneh R, et al. Pharmacokinetics of oral FG-4592 to treat anemia in hemodialysis (Hd) patients (Pts) [J]. Am J Kidney Dis, 2011, 57(4): B80. |
| [7] | Frohna P S, Milwee S, Pinkett J, et al. Preliminary results from a randomized, single-blind, placebo-controlled trial of FG-4592, a novel hypoxia inducible factor prolyl hydroxylase inhibitor, in CKD anemia [C]. San Francisco: Renal Week, 2007. |
| [8] | Chen X, Zheng X, Jiang J, et al. FG4592, a novel inhibitor of the prolyl hydroxylase of hypoxia-inducible factor (HIF-PH) elicited linear-exponential dose-response profile on plasma erythropoietin (EPO) levels [C]. Stockholm: 18th Congr Eur Hematol Assoc (EHA), 2013. |
| [9] | Yu K H, Chou J, Klaus S, et al. Comparable doses of FG-4592 have similar PK/PD in healthy Caucasian and Japanese subjects [J]. Nephrol Dial Transpl, 2013, 28: 362. |
| [10] | Besarab A, Hulter H N, Klaus S, et al. FG-4592, a novel oral HIF prolyl hydroxylase inhibitor, elevates hemoglobin in anemic stage 3/4 CKD patients [C]. Denver: Renal Week, 2010. |
| [11] | Besarab A, Provenzano R, Fishbane S, et al. FG-4592 oral hypoxia-inducible fator prolyl hydroxylase inhibitor corrects anemia in nondialysis CKD patients without IV iron [C]. Philadelphia: 44th Annu Meet Am Soc Nephrol (ASN), 2011. |
| [12] | Provenzano R, Goodkin D, Klaus S, et al. Evaluation of FG-4592, a novel oral hypoxia-inducible factor prolyl hydroxylase inhibitor, to trrat anemia in hemodialysis patients [J]. Am J Kidney Dis, 2011, 57(4): B80. |
| [13] | Besarab A, Chernyavskaya E N, Motylev L, et al. FG-4592, an oral hypoxia-inducible factor prolyl hydroxylase inhibitor, corrects anemia without iron supplementation in incident dialysis patients [C]. San Diego: Kidney Week, 2012. |
| [14] | Provenzano R, Besarab A, Dua S L, et al. FG-4592, a novel oral hypoxia-inducible factor prolyl hydroxylase inhibitor (HIF-PHI), maintains hemoglobin levels and lowers cholesterol in hemodialysis patients: Phase 2 comparison with epoetin alfa [C]. San Diego: Kidney Week, 2012. |
| [15] | Chen N, Mei C, Yu X, et al. A randomized active- controlled phase 2 trial of FG-4592, a novel hypoxia- inducible factor prolyl hydroxylase inhibitor ( HIF-PHI), for anemia therapy in subjects with end stage renal disease (ESRD) on hemodialysis (HD) treatment [C]. Hong Kong: World Congr Nephrol, 2013. |
| [16] | Besarab A, Leong R, Franco M, et al. FG-4592,a novel oral hypoxia inducible factor ( HIF) stabilizer, raises hemoglobin (Hb) in diabetic subjects with anemia of chronic kidney disease (CKD) [C]. Chicago: 73rd Annu Meet Sci Sess Am Diabetes Assoc (ADA), 2013. |
 2016, Vol. 31
2016, Vol. 31


