茉莉酸类化合物是新型植物激素,其结构是一类环戊烷类化合物,分布于各种植物体内,主要代表为茉莉酸、茉莉酸甲酯和顺式茉莉酮,见图 1。茉莉酸类化合物影响植物生命活动的各种过程[1,2],同时还能提高植物的抗性。除了在植物生长发育和胁迫反应中的生理效应外,研究者们发现茉莉酸类化合物具有抗肿瘤活性[3],对哺乳动物癌细胞可产生选择性的细胞毒作用,而对正常细胞无影响,在抗癌新药研发和癌症治疗等领域有着广阔的应用前景。近年来,一些课题组陆续报道了天然的茉莉酸类化合物以及人工合成的茉莉酸类衍生物在体外和体内的抗肿瘤活性。研究表明茉莉酸类化合物可抑制多种人类和小鼠癌细胞的增殖并诱导癌细胞凋亡,包括乳腺癌、前列腺癌、胃癌、肝癌、胰腺癌和淋巴瘤细胞等[4,5,6,7]。在天然的茉莉酸类化合物中,茉莉酸甲酯的抗肿瘤活性最高[8]。与茉莉酸相比,茉莉酸甲酯具有更强的细胞毒性和激活caspase-3的能力,根据两种前列腺癌细胞株对茉莉酸类化合物的灵敏度,茉莉酸类化合物的抗肿瘤活性排序为茉莉酸甲酯>顺式茉莉酮>茉莉酸,推测茉莉酸甲酯的甲基在抗肿瘤活性中起到了关键作用[9]。
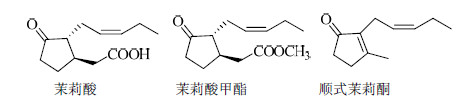 | 图 1 茉莉酸类化合物的化学结构式 Fig.1 Chemical structures of jasmonates |
近年来研究者们积极探索茉莉酸类化合物抗肿瘤活性的分子机制,结果发现其抗肿瘤作用机制包括诱导肿瘤细胞凋亡和再分化、逆转耐药、阻滞肿瘤细胞增殖周期、调节机体免疫功能、抑制肿瘤血管新生、抗侵袭转移、增敏抗肿瘤化疗药物以及改变基因表达失调。
1 诱导肿瘤细胞凋亡茉莉酸类化合物诱导肿瘤细胞凋亡通过两种途径实现,包括线粒体途径的生物能量机制和活性氧(ROS)相关的介导机制。
1.1 生物能量机制众所周知,线粒体是细胞生命活动的关键,线粒体的功能异常将影响细胞的凋亡和坏死。与正常细胞相比,肿瘤细胞的线粒体存在一些差异[10],如膜电位较高、渗透性转变孔复合体(包括电压相关性阴离子通道、腺嘌呤核苷酸转运蛋白和亲环蛋白D)不正常开启,以及通过糖酵解途径而非氧化磷酸化效应提高ATP的产率。Fingrut等[11]给接种了EL-4细胞淋巴瘤的小鼠ig 236 mg/kg茉莉酸甲酯后,发现能延长EL-4淋巴荷瘤小鼠的寿命,并选择性地诱导接种小鼠体内T淋巴瘤细胞凋亡,而对正常的血液淋巴细胞无影响。此外,将慢性淋巴细胞白血病患者循环血中的白血病细胞和正常细胞混合时,茉莉酸甲酯同样表现出对白血病细胞的选择性毒性。实验发现白血病细胞凋亡前ATP含量减少,推测肿瘤细胞线粒体功能受损,使其对茉莉酸甲酯诱导的ATP减少反应更为敏感,并且茉莉酸甲酯可诱导线粒体膜去极化和促凋亡前体蛋白细胞色素C的释放,表明茉莉酸甲酯对线粒体有直接作用,其对肿瘤细胞的选择性源自肿瘤细胞和正常细胞的不同线粒体状态。同时,由于茉莉酸甲酯诱导的肿瘤细胞ATP代谢与糖酵解有关,因此糖酵解抑制剂D-2-脱氧葡萄糖与茉莉酸甲酯有协同作用[12]。茉莉酸甲酯这一直接作用于肿瘤细胞线粒体的促细胞凋亡机制被称为生物能量机制。
1.2 ROS介导机制各种含氧分子如超氧离子、过氧化氢、羟自由基和纯态氧等都具有自然的细胞毒性,因此研究者们探究了ROS参与茉莉酸类化合物诱导细胞凋亡的可能性。Kim等[13]在茉莉酸甲酯诱导A549人肺腺癌细胞死亡的研究中发现N-乙酰基半胱氨酸和过氧化氢酶可抑制茉莉酸甲酯诱导的细胞凋亡,而羟自由基和超氧离子无抑制作用。通过H2O2的生成,茉莉酸甲酯诱导Bcl-2家族的促凋亡成员Bax和Bcl-XS的表达上调,而抗凋亡蛋白Bcl-2和Bcl-XL的表达则保持不变。茉莉酸甲酯可使鼠神经胶质瘤C6细胞内的H2O2、超氧离子以及线粒体ROS含量增加,并且茉莉酸甲酯可通过热休克因子Ⅰ诱导热休克蛋白的表达上调,该作用可被特异性的抑制剂如羟自由基和H2O2抑制[14]。此外,茉莉酸类化合物可诱导HL-60细胞和KG1a细胞产生大量的ROS[15],而茉莉酸甲酯能诱导生成大量的线粒体超氧化物(MSO),MSO的产生可导致细胞活力的减弱,揭示了茉莉酸甲酯抗肿瘤作用强于茉莉酸的原因。
2 诱导肿瘤细胞再分化近年来诱导肿瘤细胞再分化是癌症学界的研究热点之一,“再分化”是指使未分化的肿瘤细胞“正常化”。研究证明茉莉酸类化合物能够诱导肿瘤细胞的再分化。
Ishii等[4]用0.1~0.4 mmol/L茉莉酸甲酯处理各种人类肿瘤细胞系,发现白血病细胞相对于固态肿瘤细胞对茉莉酸甲酯更加敏感,其中HL-60细胞最为敏感。研究发现茉莉酸甲酯可诱导HL-60细胞产生分化的标志物,包括:(1)NBT的减少,这是单核细胞分化的典型标志;(2)HL-60细胞同时表达单核细胞特异性表面抗原CD14和粒细胞特异性抗原CD15,表明在形态学上HL-60向粒细胞分化并带有单核细胞颗粒特性;(3)茉莉酸甲酯诱导单核细胞分化标志物α-醋酸萘酯酶的活性。此外,已知的粒细胞和单核细胞分化诱导剂全反式维甲酸和1α,25-二羟基维生素D3可协同茉莉酸甲酯诱导HL-60细胞的分化。为了研究茉莉酸甲酯诱导HL-60细胞分化所涉及的信号通路,Fingrut等[12]测定了细胞cAMP及其类似物的水平,发现cAMP、PI3K、PKC、PKA和G蛋白未参与茉莉酸甲酯诱导的HL-60细胞分化。然而茉莉酸甲酯可激活分裂原活化蛋白激酶激酶(MAPK),MAPK抑制剂PD98059可抑制茉莉酸甲酯诱导的细胞分化,因此MAPK信号通路很可能促进茉莉酸甲酯诱导的再分化。Ishii等[16]还发现茉莉酸甲酯可激活HL-60细胞的转录因子C/EBP δ蛋白,并且茉莉酸甲酯诱导钙结合蛋白S100P的mRNA表达上调[17],同时抑制肿瘤的生长,这与细胞分裂素诱导人类白血病细胞分化的机制类似。
3 对耐药肿瘤的作用茉莉酸类化合物还可诱导耐药性细胞株死亡,细胞耐药性是由P-糖蛋白(P-gp)的过度表达或p53基因突变造成的[18]。Fingrut等[12]发现p53突变的B淋巴瘤细胞可抵抗辐射药物新抑癌素和博莱霉素,但其对茉莉酸甲酯的敏感性与野生型p53细胞类似。博莱霉素和新抑癌素诱导野生型细胞p53表达上调,而茉莉酸甲酯无此作用;茉莉酸甲酯诱导野生型p53细胞凋亡,对突变型p53细胞则诱导其死亡[19]。因此茉莉酸类化合物可通过诱导非凋亡机制的细胞死亡来避免由p53突变引起的耐药性。
Flescher等[20]发现,对秋水仙碱、阿霉素和长春新碱抵抗的黑色素瘤细胞,无论其P-gp是高表达还是低表达,对茉莉酸甲酯的敏感性都相似。抑制P-gp可增强细胞对化疗药物的敏感性,但对茉莉酸甲酯的敏感性不变,暗示茉莉酸类化合物不是P-gp的底物,从而可避免由P-gp表达引起的细胞耐药性。
此外由于茉莉酸类化合物可直接作用于肿瘤细胞的线粒体[21],其可避免前线粒体区抗凋亡基因的突变而导致的耐药性。
4 阻滞肿瘤细胞增殖周期细胞周期阻滞与细胞凋亡往往彼此关联,茉莉酸类化合物具有阻滞细胞周期的作用。茉莉酸甲酯可抑制NSCLC非小细胞肺癌细胞株和SH-SY5Y神经母细胞瘤细胞株的长期增殖并诱导G2/M期阻滞[22]。在其他多个神经母细胞瘤细胞株中,茉莉酸甲酯通过下调PCNA的表达使SK-N-SH和BE(2)-C细胞发生G0/G1期阻滞[23,24]。对于MDA-MB-435和MCF-7乳腺癌细胞,茉莉酸甲酯通过上调TNFR1、MAPK和caspase-8的表达,导致细胞发生G0/G1期和S期阻滞并伴随着凋亡[25]。此外,茉莉酸类化合物还可诱导宫颈癌HeLa细胞的凋亡和G2/M期阻滞并使其DNA损伤[26]。
5 调节机体免疫功能免疫细胞的激活、人体免疫功能的提高与肿瘤的预防和治疗关系密切。最近的报道指出茉莉酸类化合物具有抗炎活性,能够调节机体免疫功能。Dang等[27]发现茉莉酸甲酯具有与前列腺素化合物相当的抗炎活性,并且茉莉酸甲酯结构类似物α-haloenones的抗炎活性优于天然的前列腺素。α-haloenones可通过下调NF-κB的活性,抑制被脂多糖激活的小鼠巨噬细胞RAW264.7释放促炎介质如NO、白细胞介素IL-6和肿瘤坏死因子TNF-α,从而起到抗炎作用并增强抗肿瘤活性。
6 抑制肿瘤血管生成新生血管形成是肿瘤的生成、浸润和转移的重要病理过程之一,血管内皮细胞的活化、增殖及小管形成是肿瘤新生血管形成的关键步骤。体外实验表明,1~10 mmol/L茉莉酸甲酯可显著抑制人脐静脉内皮细胞的生长,而1 μmol/L茉莉酸甲酯对细胞生长没有显著抑制作用。在体内实验中,1~10 mmol/L茉莉酸甲酯可显著抑制鸡胚绒毛尿囊膜毛细血管的生长,降低血管密度[28]。当其浓度小于100 μmol/L时,则导致血管的不规则生长,形成大量的不正常毛细血管并伴随着血管内皮生长因子的减少,这些新生毛细血管更容易渗漏,结构排列紊乱。
7 抑制肿瘤侵袭转移茉莉酸类化合物还被证明具有抗转移活性,茉莉酸甲酯可抑制荷瘤小鼠黑色素瘤的转移。在低毒性浓度(小于1 mmol/L)下,茉莉酸甲酯不诱导细胞凋亡也不消耗ATP,却能成功使小鼠B16黑色素瘤细胞的活力减弱;接种B16-F10肺黑色素瘤细胞的小鼠每天iv 40或75 mg/kg茉莉酸甲酯,结果对小鼠肺黑色素瘤的生长有显著的抑制作用[29]。茉莉酸甲酯对于高转移性的耐药细胞株B16-F10有同B16细胞相似的抑制作用,表明其对B16细胞转移的抑制作用是通过耐药途径实现[29]。茉莉酸类化合物除了对肿瘤细胞直接作用致其死亡外,还能通过抑制肿瘤细胞的转移来防止肿瘤的侵袭。
8 协同作用研究表明,茉莉酸类化合物可与其他抗肿瘤药物产生协同作用。事实上,许多肿瘤化疗方案采用多种药物联合治疗[30]。相对于使用单种药物,利用药物之间的协同作用使化疗药物的IC50值降低,从而减少药物的使用剂量,可避免高剂量导致的副作用,甚至可以克服肿瘤细胞对单一药物的抵抗性和防止新的耐药肿瘤细胞产生[31]。
茉莉酸甲酯和紫苏醇联用可明显增强顺铂对乳腺癌细胞的杀伤力[32]。卡莫司汀在单独使用时对胰腺癌细胞无作用,茉莉酸甲酯可协同卡莫司汀诱导细胞死亡[33],推测卡莫司汀使线粒体对茉莉酸甲酯的摄动更加敏感,导致细胞毒性急剧增加。无细胞毒性浓度的茉莉酸甲酯协同肿瘤坏死因子相关凋亡诱导配体(TRAIL)可增强caspase酶活性,从而提高由TRAIL诱导的直肠癌细胞凋亡[34]。茉莉酸甲酯通过下调IAP家族成员之一survivin基因诱导TRAIL敏感性,研究还表明茉莉酸甲酯可抑制survivin的转录从而下调mRNA和蛋白水平,影响Wnt/TCF通路[34]。茉莉酸甲酯的衍生物J7通过ROS介导机制增强由TRAIL诱导的人肝癌细胞凋亡[35]。
IAP拮抗剂SmacN7与茉莉酸甲酯有协同作用,可显著增强其诱导的细胞毒性[36]。茉莉酸甲酯增强细胞凋亡的作用机制是通过caspase-9依赖和caspase-9独立途径。这些研究结果表明,抑制IAP可促进茉莉酸甲酯诱导的细胞毒性,并可能发展以茉莉酸类化合物为基础的化疗[37]。
9 基因表达失调茉莉酸类化合物还能改变基因表达,基因表达异常可能是由茉莉酸类化合物诱导细胞死亡效应直接导致,也可能是和该效应相伴而生。如在人乳腺癌细胞中,茉莉酸甲酯诱导的细胞凋亡与膜流动性下降、肿瘤坏死因子受体表达增强及caspases-8激活均有关联,表明茉莉酸类化合物激活了外在的凋亡通路[25]。研究中可能检测到表达有变化的基因主要是抗凋亡蛋白质IAP家族、Bcl-2或Bax。
10 结 语天然的茉莉酸类化合物及其合成衍生物不仅能诱导肿瘤细胞凋亡,同时也发挥了其他抗肿瘤作用,具有作为抗肿瘤药物的潜力。
已有研究表明茉莉酸类化合物对植物细胞和癌细胞的影响有一些相似点,包括诱导细胞的凋亡[38]、抑制细胞增殖并诱导细胞周期停滞[39]、激活MAPK[40]、产生ROS[41]、提高热休克蛋白(HSP)的表达[42]等。这暗示更多地分析茉莉酸类化合物在植物细胞中的效应,可能有助于更深入地了解该类化合物的抗肿瘤行为,通过结构-功能分析来确定其靶向作用分子并合成更多具有高治疗指数的茉莉酸类衍生物。
茉莉酸类化合物的化学结构不同于现有的抗癌药物,其抗肿瘤活性与选择性暗示其具有低的毒副作用,将其作为化疗药物则需通过临床和临床前实验实现,包括体内毒性和安全性评估,药动学稳定性评价,制剂及给药途径的开发等。茉莉酸类化合物中的新抗癌药物为癌症的治疗带来了新希望,会吸引越来越多的科学家参与到茉莉酸类化合物的抗癌研究中。
| [1] | Sembdner G, Parthier B. The biochemistry and the physiological and molecular actions of jasmonates[J]. Annu Rev Plant Physiol Plant Mol Biol, 1993, 44:569-589. |
| [2] | Creelman R A, Mullet J E. Biosythesis and action of jasmonates in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 1997, 48:355-381. |
| [3] | Flescher E. Jasmonates in cancer therapy[J]. Cancer Lett, 2007, 245(1/2):1-10. |
| [4] | Ishii Y, Kiyota H, Sakai S, et al. Induction of differentiation of human myeloid leukemia cells by jasmonates, plant hormones[J]. Leukemia, 2004, 18(8):1413-1419. |
| [5] | 董秋菊, 张建福, 韩红霞, 等. 茉莉酸甲酯对胃癌SGC7901细胞生长抑制机制探讨[J]. 中华肿瘤防治杂志, 2013, 20(9):641-645. |
| [6] | 汪长发. 茉莉酸甲酯对肝癌的抑制作用及其机理研究[D]. 长沙:中南大学, 2013. |
| [7] | 王月诚, 王斌, 涂艳华, 等. 茉莉酸甲酯对人胰腺癌细胞株HS766T抑制作用的研究[J]. 临床消化病杂志, 2014, 26(6):356-360. |
| [8] | Raviv Z, Cohen S, Reischer-Pelech D. The anti-cancer activities of jasmonates[J]. Cancer Chemother Pharmacol, 2013, 71(2):275-285. |
| [9] | Flescher E. Jasmonates:a new family of anti-cancer agents[J]. Anticancer Drug, 2005, 16(9):911-916. |
| [10] | Costantini P, Jacotot E, Decaudin D, et al. Mitochondrion as a novel target of anticancer chemotherapy[J]. J Natl Cancer Inst, 2000, 92(13):1042-1053. |
| [11] | Fingrut O, Flescher E. Plant stress hormones suppress the proliferation and induce apoptosis in human cancer cells[J]. Leukemia, 2002, 16(4):608-616. |
| [12] | Fingrut O, Reischer D, Rotem R, et al. Jasmonates induce nonapoptotic death in high-resistance mutant p53-expressing B-lymphoma cells[J]. Br J Pharmacol, 2005, 146(6):800-808. |
| [13] | Kim J H, Lee S Y, Oh S Y, et al. Methyl jasmonate induces apoptosis through induction of Bax/Bcl-X-s and activation of caspase-3 via ROS production in A549 cells[J]. Oncol Rep, 2004, 12(6):1233-1238. |
| [14] | Oh S Y, Kim J H, Park M J, et al. Induction of heat shock protein 72 in C6 glioma cells by methyl jasmonate through ROS-dependent heat shock factor 1 activation[J]. Int J Mol Med, 2005, 16(5):833-839. |
| [15] | Davies N J, Hayden R E, Simpson P J, et al. AKR1C isoforms represent a novel cellular target for jasmonates alongside their mitochondrial-mediated effects[J]. Cancer Res, 2009, 69(11):4769-4775. |
| [16] | Ishii Y, Kasukabe T, Honma Y. Induction of CCAAT/enhancer binding protein-delta by cytokinins, but not by retinoic acid, during granulocytic differentiation of human myeloid leukaemia cells[J]. Br J Haematol, 2005, 128(4):540-547. |
| [17] | Ishii Y, Kasukabe T, Honma Y. Immediate up-regulation of the calcium-binding protein S100P and its involvement in the cytokinin-induced differentiation of human myeloid leukemia cells[J]. Biochim Biophys Acta, 2005, 1745(2):156-165. |
| [18] | Willis A C, Chen X. The promise and obstacle of p53 as a cancer therapeutic agent[J]. Curr Mol Med, 2002, 2(4):329-345. |
| [19] | Yeruva L V, Elegbede J A, Toy B J, et al. The apoptosisinducing activity of natural plant products involved regulation of events downstream of the p53 pathway[J]. Cancer Res, 2005, 65(9 Supplement):1389. |
| [20] | Flescher E, Reischer D, Fingrut O, et al. Jasmonates can overcome drug resistance induced by p53 mutations and P-glycoprotein expression[J]. EJC Suppl, 2005, 3(2):428-428. |
| [21] | Rotem R, Heyfets A, Fingrut O, et al. Jasmonates:Novel anticancer agents acting directly and selectively on human cancer cell mitochondria[J]. Cancer Res, 2005, 65(5):1984-1993. |
| [22] | Yeruva L, Pierre K J, Carper S W, et al. Jasmonates induce apoptosis and cell cycle arrest in non-small cell lung cancer lines[J]. Exp Lung Res, 2006, 32(10):499-516. |
| [23] | Tong Q S, Jiang G S, Zheng L D, et al. Methyl jasmonate downregulates expression of proliferating cell nuclear antigen and induces apoptasis in human neuroblastoma cell lines[J]. Anticancer Drugs, 2008, 19(6):573-581. |
| [24] | Tong Q S, Jiang G S, Zheng L D, et al. Natural jasmonates of different structures suppress the growth of human neuroblastoma cell line SH-SY5Y and its mechanisms[J]. Acta Pharmacol Sin, 2008, 29(7):861-869. |
| [25] | Yeruva L, Elegbede J A, Carper S W. Methyl jasmonate decreases membrane fluidity and induces apoptosis through tumor necrosis factor receptor 1 in breast cancer cells[J]. Anticancer Drugs, 2008, 19(8):766-776. |
| [26] | Zhao J, Kang S, Zhang X, et al. Apoptotic activity of a new jasmonate analogue is associated with its induction of DNA damage[J]. Oncol Rep, 2010, 24(3):771-777. |
| [27] | Dang H T, Lee H J, Yoo E S, et al. New jasmonate analogues as potential anti-inflammatory agents[J]. Bioorg Med Chem, 2008, 16(24):10228-10235. |
| [28] | Pereira Lopes J E, Barbosa M R, Stella C N, et al. In vivo anti-angiogenic effects further support the promise of the antineoplasic activity of methyl jasmonate[J]. Braz J Biol, 2010, 70(2):443-449. |
| [29] | Reischer D, Heyfets A, Shimony S, et al. Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma[J]. Br J Pharmacol, 2007, 150(6):738-749. |
| [30] | Frei E, BasJr R C, Kufe D W, et al. Principles of Dose, Schedule, and Combination Chemotherapy[M]. Hamilton:BC Decker, 2003:817-837. |
| [31] | Takimoto C, Coia L R, J H W, et al. Principles of Oncologic Pharmacotherapy. A Multidisciplinary Approach[M]. Manhasset:CMP Healthcare Media, 2005:23-42. |
| [32] | Yeruva L, Hall C, Elegbede J A, et al. Perillyl alcohol and methyl jasmonate sensitize cancer cells to cisplatin[J]. Anticancer Drugs, 2010, 21(1):1-9. |
| [33] | Cai S, Xu Y, Cooper R J, et al. Mitochondrial targeting of human O6-methylguanine DNA methyltransferase protects against cell killing by chemotherapeutic alkylating agents[J]. Cancer Res, 2005, 65(8):3319-3327. |
| [34] | Raviv Z, Zilberberg A, Cohen S, et al. Methyl jasmonate down-regulates survivin expression and sensitizes colon carcinoma cells towards TRAIL-induced cytotoxicity[J]. Br J Pharmacol, 2011, 164(5):1433-1444. |
| [35] | Park C, Jin C, Hwang H J, et al. J7, a methyl jasmonate derivative, enhances TRAIL-mediated apoptosis through up-regulation of reactive oxygen species generation in human hepatoma HepG2 cells[J]. Toxicol in Vitro, 2012, 26(1):86-93. |
| [36] | Jiang G, Zhao J, Xiao X, et al. An N-terminal Smac peptide sensitizes human prostate carcinoma cells to methyl jasmonate-induced apoptosis[J]. Cancer Lett, 2011, 302(1):37-46. |
| [37] | Xiao X Y, Jiang G S, Wang L, et al. Predominant enhancement of apoptosis induced by methyl jasmonate in bladder cancer cells:therapeutic effect of the Antpconjugated Smac peptide[J]. Anticancer Drugs, 2011, 22(9):853-863. |
| [38] | Asai T, Stone J M, Heard J E, et al. Fumonisin B1-induced cell death in Arabidopsis protoplasts requires jasmonate-, ethylene-, and salicylate-dependent signaling pathways[J]. Plant Cell, 2000, 12(10):1823-1836. |
| [39] | Naill M C, Roberts S C. Cell cycle analysis of Taxus suspension cultures at the single cell level as an indicator of culture heterogeneity[J]. Biotechnol Bioeng, 2005, 90(4):491-500. |
| [40] | Rotem R, Fingrut O, Moskovitz J, et al. The anticancer plant stress-protein methyl jasmonate induces activation of stress-regulated c-Jun N-terminal kinase and p38 protein kinase in human lymphoid cells[J]. Leukemia, 2003, 17(11):2230-2234. |
| [41] | Danon A, Miersch O, Felix G, et al. Concurrent activation of cell death-regulating signaling pathways by singlet oxygen in Arabidopsis thaliana[J]. Plant J, 2005, 41(1):68-80. |
| [42] | Hamilton Iii E W, Coleman J S. Heat-shock proteins are induced in unstressed leaves of Nicotiana attenuata (Solanaceae) when distant leaves are stressed[J]. Am J Bot, 2001, 88(5):950-955. |
 2016, Vol. 31
2016, Vol. 31


