2. 天津医科大学, 天津 300070;
3. 天津中医药大学, 天津 300193
2. Tianjin Medical University, Tianjin 300070, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
通用名:奥贝胆酸
别名:6-乙基鹅去氧胆酸、INT-747、DSP-1747
化学名:6α-乙基-3α,7α-二羟基-5β-去氧胆酸- 24-酸
CAS:459789-99-2
分子式:C26H44O4
相对分子质量:420.63
结构见图 1
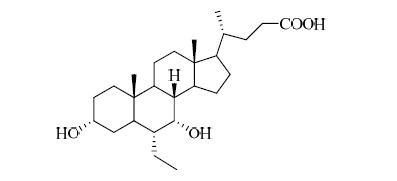 | 图 1 奥贝胆酸的结构 Fig.1 Structure of obeticholic acid |
原研公司:Intercept制药公司
药理分类:法尼醇X受体激动剂
适应症:原发性胆汁性肝硬化、非酒精性脂肪肝
目前阶段:Ⅲ期临床
给药途径:口服
2 相关背景原发性胆汁性肝硬化(PBC)是一种常见的自身免疫性肝胆疾病,主要发生于40岁以上的中年女性,发病率为0.1%[1]。PBC与胆汁淤积有关,主要由胆汁摄取、合成或分泌障碍引起,也可因胆道梗阻形成,并逐步发展为肝内小胆管炎症损伤,最终导致硬化[2]。PBC的发病机制尚不清楚,大部分学者认为其主要是遗传和环境因素所导致[3]。最新指南提出,高碱性磷酸酶水平和抗线粒体抗体阳性即可确诊为PBC,使得PBC的早期诊断率明显提高,患者往往伴有瘙痒、疲劳等临床症状。
目前,熊去氧胆酸是FDA唯一批准用于治疗PBC的药物,它能够有效改善肝脏异常生化指标的水平,并降低肝纤维化和肝硬化的发病率[4]。熊去氧胆酸主要在转录后调节肝胆转运体功能,通过上调胆汁酸转运体的表达和抗凋亡的作用,保护肝细胞和胆管细胞的功能。PBC患者及时恰当的每日服用熊去氧胆酸(13~15 mg/kg)可以明显提高生存率,但熊去氧胆酸与法尼醇X受体激动剂的亲和力较低,临床上40%~50%患者对熊去氧胆酸的治疗效果并不明显[5],因此,尚急需另一种能够替代的新型药物。
奥贝胆酸由美国Intercept制药公司研发,其化合物专利于2001年在美国申请,专利号为US7138390,目前尚未在中国申请化合物专利。奥贝胆酸是20年来首个研发用于治疗胆汁淤积性肝病的药物,针对熊去氧胆酸没有充分应答或不能耐受的患者。
3 合成路线[5]奥贝胆酸的合成从廉价、易得的鹅去氧胆酸开始,以CHCl3/Cl2CH2为介质,鹅去氧胆酸的7α-OH在室温下被PCC试剂选择性氧化成7-羰基,生成化合物1;在同样的介质CHCl3/Cl2CH2中,化合物1在催化剂对甲苯磺酸(p-TsOH)的作用下与3,4-二氢-2H吡喃反应生成化合物2;化合物2在正丁基锂(n-BuLi)和烯醇化结构LDA/HMPA的作用下被碘乙烷(Et-I)烷基化作用产生6-乙基,再在对甲苯磺酸吡啶(PPTS)的作用下生成化合物3;硼氢化钠(NaBH4)从背面立体选择性还原化合物3生成化合物6-乙基鹅去氧胆酸,即奥贝胆酸。其合成路线见图 2。
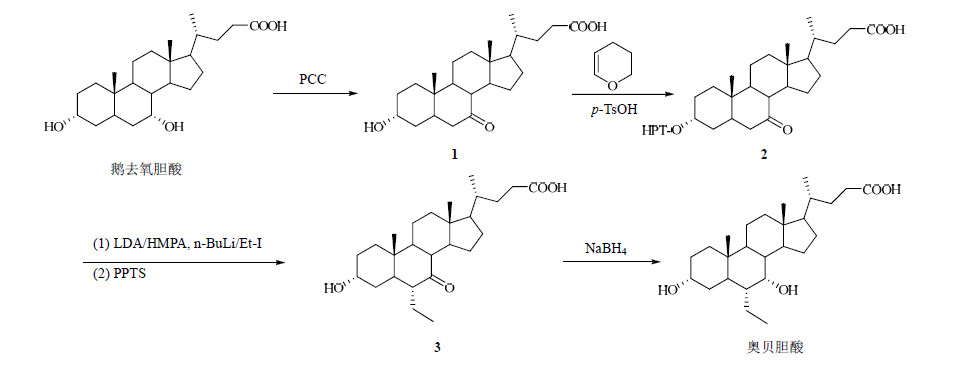 | 图 2 奥贝胆酸的合成路线 Fig.2 Synthetic route of obeticholic acid |
PBC是由胆管发育不良或胆汁酸代谢紊乱导致的慢性胆汁淤积,使细胞膜脂质溶解,通透性改变,细胞内容物流出,最终进展为肝纤维化和肝硬化的一种疾病。目前,临床上治疗PBC的药物主要是熊去氧胆酸,其主要通过细胞内信号分子丝裂原活化蛋白激酶(MAPK)途径刺激肝胆分泌[6],并且保护上皮细胞免受胆汁酸的破坏[7]。胆汁酸肠肝循环是体内胆汁酸维持稳定的重要生理过程,其在体内是被动转运,因此胆汁酸转运体是调控胆汁肠肝循环的关键;胆汁酸转运体主要分为Na+依赖性牛磺胆汁酸盐协同转运多肽(NTCP)和非Na+依赖性的有机阴离子转运多肽(OATP),其中90%胆汁酸经过NTCP转运[8]。
法尼醇X受体是一种核激素受体,广泛分布于胆汁酸肠肝循环的组织中,奥贝胆酸通过活化法尼醇X受体,间接抑制胆汁酸生物合成的限速酶CYP7A1的基因表达;同时胆汁淤积也可激活法尼醇X受体,通过诱导小异源二聚体(SHP)抑制肝脏核受体的活性,进而减少视黄醇X受体和糖皮质激素受体的表达,并下调NTCP的表达,抑制胆汁酸的摄取[9];阻塞性胆汁淤积患者肝脏成纤维细胞生长因子19(FGF-19)的表达上调,并伴有血清FGF19水平升高[10],法尼醇X受体也能够诱导FGF-19的分泌,抑制肝细胞生成胆汁酸。因此,法尼醇X受体激动剂奥贝胆酸可以通过多种机制直接调节胆汁酸相关基因来影响胆汁酸的合成、分泌、转运和吸收[11],用于治疗PBC和非酒精性脂肪肝。
5 临床研究 5.1 Ⅰ期临床一项单中心、随机开放性的Ⅰ期临床试验NCT01933503共招募了24名18~55岁健康志愿者,随机分为3组,分别口服奥贝胆酸5、10、25 mg/d,连续给药14 d。主要用于评估奥贝胆酸在体内的药动学、安全性及耐受性,但本次试验并没对外公布相关结果[13]。
5.2 Ⅱ期临床Hirschfield等[14]进行了一项双盲、安慰剂对照的Ⅱ期临床试验。研究选择年龄为18~75岁的165名确诊至少6个月的PBC患者(95%为女性),试验前患者的高碱性磷酸酶水平均高于正常水平的1.5~10倍。患者随机分为奥贝胆酸10、25、50 mg组和安慰剂对照组,每日口服1次,试验周期为3个月,整个试验期间患者仍然继续服用熊去氧胆酸。于试验开始的第1、15、29、57、85天测量相关指标包括,血清指标:碱性磷酸酶(ALP)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(GGT)、C反应蛋白、成纤维细胞生长因子19(FGF19)和免疫球蛋白M(IgM)含量;健康评估指标:不良反应、瘙痒等发病率;临床检测:脂类及心电图等。结果显示奥贝胆酸10、25、50 mg组ALP水平分别降低了24%、25%、21%,安慰剂组仅3%,差异具有统计学意义(P<0.001)。其中69%奥贝胆酸受试者ALP水平下降了20%以上,而对照组仅8%;奥贝胆酸各组的ALT、AST分别降低21%~35%、9%~21%,对照组并没有测量该指标;奥贝胆酸各组GGT降低48%~63%,对照组仅降低7%;奥贝胆酸10、25、50 mg组C反应蛋白分别降低21%、42%、33%,而对照组增加10%;奥贝胆酸10、25、50 mg组IgM分别降低14%、21%、18%,而对照组增加19%。奥贝胆酸10、25、50 mg组FGF19水平和对照组相比显著增加(P<0.05)。
84%对照组患者发生过不良反应,96%奥贝胆酸组有过不良反应;除了瘙痒常见不良反应外,和对照组相比,奥贝胆酸组也常见恶心的症状。瘙痒是最主要的不良反应,奥贝胆酸10、25、50 mg组发生率分别为47%、87%、80%,对照组为50%,仅奥贝胆酸10 mg组与对照组相比无统计学意义;奥贝胆酸10、25、50 mg组严重瘙痒发生率分别为16%、24%、37%。服用奥贝胆酸期间,各治疗组总胆固醇平均为218~239 mg/dL,低密度脂蛋白(LDL)平均为123~133 mg/dL,高密度脂蛋白(HDL)平均为65~70 mg/dL,仅三酰甘油降低为113~119 mg/dL。试验过程中,4%患者发生严重的不良反应,其中对照组1名患者发生呼吸困难,奥贝胆酸25 mg组有1名(术前存在非恶性涎腺肿瘤),50 mg组有5名。总体来看,共27名患者中断了本次试验,其中23名由于不良反应,1名由于结合胆红素过高,1名由于AST/ALT过高。
一项多中心、双盲、安慰剂对照及平行对照的实验随机选择283名非酒精性脂肪肝患者,口服奥贝胆酸25 mg/d或安慰剂12周,其中141名患者服用奥贝胆酸,142名使用安慰剂对照主要用于评价奥贝胆酸对非酒精性脂肪肝的效果。第36周时,测得奥贝胆酸组ALT与AST的浓度降低,与对照组相比差异具有统计学意义(P<0.05);GGT降低,但是ALP的浓度稍微升高,当停止服用奥贝胆酸后,ALP的浓度发生逆转,并且实验结束时,测得两组ALP的浓度并无显著差异。72周后,奥贝胆酸组45%患者活体组织切片检查显示肝脏组织明显改善,而安慰剂组仅21%,两组比较差异具有统计学意义(P<0.001)。除了瘙痒之外,两组常见的不良反应一样,奥贝胆酸组患者瘙痒发生率为23%,对照组6%。奥贝胆酸组30例患者发生严重的不良反应,对照组21例,但是85%的不良反应与治疗无关。最终试验表明奥贝胆酸能够改善非酒精性脂肪肝患者的组织学特征,但其长期的效果及安全性仍需要进一步验证[12]。
5.3 Ⅲ期临床一项国际、双盲、安慰剂对照的Ⅲ期临床试验,选择曾使用熊去氧胆酸治疗但效果并不理想的PBC患者(使用熊去氧胆酸固定剂量,ALP>1.67×ULN或胆红素<2×ULN)。随机分为安慰剂对照组、奥贝胆酸5、10 mg剂量组,试验周期为12个月,试验过程中患者继续服用熊去氧胆酸。根据试验要求,6个月后奥贝胆酸的剂量可从5 mg/d提高到10 mg/d。主要终点指标为:ALP降低≥15%且达到全球PBC研究组ALP/胆红素标准[15]。
近期,被称为POISE的试验公布了Ⅲ期临床的研究结果[16]。患者经过12个月的奥贝胆酸治疗后,ALP降低≥15%,ULN至少降低1.67倍;血清胆红素也达到正常水平。POISE主要终点达标情况:对照组仅10%,10 mg奥贝胆酸组47%(P<0.001),5~10 mg奥贝胆酸组46%(P<0.001)。对照组ALP较基线平均下降5%,而10、5~10 mg奥贝胆酸组分别降低39%、33% 。此外,两个治疗组其他肝功能参数如GGT、ALT、AST均达到次要终点指标水平(P<0.001)。试验过程中,治疗组HDL水平轻度降低,三酰甘油轻度升高,LDL并无明显变化。
POISE试验结果对PBC的治疗意义重大,期望通过相应生化指标的改变,改善PBC的临床结局。研究结果证明奥贝胆酸对熊去氧胆酸不能充分耐受的患者效果良好,可以明显改善生化指标,但仍需要更多的临床试验来充分验证奥贝胆酸的确切疗效。
6 安全性临床试验过程中,奥贝胆酸组并未出现严重的不良反应,常见的不良反应包括瘙痒、恶心,但是当服用奥贝胆酸<10 mg时,瘙痒的发生率明显降低,或可以服用一些阻断药来缓解瘙痒的症状。
一项为期12个月共纳入78名PBC患者的开放性试验中[14],78%患者服用奥贝胆酸满1年,96%患者从奥贝胆酸10 mg/d开始服用,并根据个体ALP的水平提高或降低使用量,同时患者也可以选择其他的阻断药如抗阻胺药或BA螯合剂,试验过程中奥贝胆酸剂量范围3~60 mg。该试验主要用于评价服用低剂量奥贝胆酸时瘙痒的发生率。在本次开放性试验中,尽管报道称瘙痒发生率为87%,但并未发生严重瘙痒,其中约24%患者中断本次试验。
在上述POISE试验中[16],报道最常见的不良反应仍是瘙痒,对照组发生率为38%,10 mg奥贝胆酸组发生率为68%,5~10 mg奥贝胆酸组发生率为56%,整个试验过程中8名患者无法忍受瘙痒而终止试验:其中对照组0人,10 mg奥贝胆酸组7人,5~10 mg奥贝胆酸组1人。
7 结 语近年来,PBC和非酒精性脂肪肝等肝病的发病率逐渐升高并趋向低龄化,目前,FDA批准的药物熊去氧胆酸的临床治疗效果并不十分理想,急需一种用于对熊去氧胆酸应答不佳的新药上市。Ⅱ、Ⅲ期临床试验的研究表明,新型法尼醇X受体激动剂奥贝胆酸的临床疗效表现良好,可能会成为未来治疗PBC和非酒精性脂肪肝的首选药物,同时,也期待奥贝胆酸能够尽快上市并给肝病患者带来更好的益处。
| [1] | Lindor K D, Gershwin M E, Poupon R, et al. Primary biliary cirrhosis[J]. Hepatology, 2009, 50(1):291-308. |
| [2] | Parés A. Old and novel therapies for primary biliary cirrhosis[J]. Semin Liver Dis, 2014, 34(3):341-351. |
| [3] | Selmi C, Mayo M J, Bach N, et al. Primary biliary cirrhosis in monozygotic and dizygotic twins:genetics, epigenetics, and environment[J]. Gastroenterology, 2004, 127(2):485-492. |
| [4] | Rudic J S, Poropat G, Krstic M N, et al. Ursodeoxycholic acid for primary biliary cirrhosis[DB/OL]. (2015-12-23)[2016-03-15]. http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD000551.pub3/abstract. |
| [5] | Yu D, Mattern D L, Forman B M. An improved synthesis of 6alpha-ethylchenodeoxycholic acid (6ECDCA), a potent and selective agonist for the Farnesoid X Receptor (FXR)[J]. Steroids, 2012, 77(13):1335-1338. |
| [6] | Gohlke H, Schmitz B, Sommerfeld A, et al. α5β1-integrins are sensors for tauroursodeoxycholic acid in hepatocytes[J]. Hepatology, 2013, 57(3):1117-1129. |
| [7] | Beuers U. Drug insight:mechanisms and sites of action of ursodeoxycholic acid in cholestasis[J]. Nat Clin Pract Gastroenterol Hepatol, 2006, 3(6):318-328. |
| [8] | Kullak-Ublick G A, Stieger B, Meier P J. Enterohepatic bile salt transporters in normal physiology and liver disease[J]. Gastroenterology, 2004, 126(1):322-342. |
| [9] | Keitel V, Burdelski M, Warskulat U, et al. Expression and localization of hepatobiliary transport proteins in progressive familial intrahepatic cholestasis[J]. Hepatology, 2005, 41(5):1160-1172. |
| [10] | Schaap F G, van der Gaag N A, Gouma D J, et al. High expression of the bile salt-homeostatic hormone fibroblast growth factor 19 in the liver of patients with extrahepatic cholestasis[J]. Hepatology, 2009, 49(4):1228-1235. |
| [11] | Schaap F G, Trauner M, Jansen P L. Bile acid receptors as targets for drug development[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(1):55-67. |
| [12] | Neuschwander-Tetri B A, Loomba R, Sanyal A J, et al. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT):a multicentre, randomised, placebo-controlled trial[J]. Lancet, 2015, 385(9972):956-965. |
| [13] | Clinical Trials gov. Single dose and multiple dose trial to assess pharmacokinetics of obeticholic acid (OCA).[DB/OL]. (2013-8-28)[2016-03-15]. https://clinicaltrials.gov/ct2/show/NCT01933503?term=obeticholic+acid&rank=13. |
| [14] | Hirschfield G M, Mason A, Luketic V, et al. Efficacy of obeticholic acid in patients with primary biliary cirrhosis and inadequate response to ursodeoxycholic acid[J]. Gastroenterology, 2015, 148(4):751-761. |
| [15] | Nevens F, Andreone P, Mazzella G, et al. O168 the First primary biliary cirrhosis (Pbc) phase 3 trial in two decades-an international study of the fxr agonist obeticholic acid in Pbc patients[J]. J Hepatol, 2014, 60(1):S525-S526. |
| [16] | Czul F, Levy C. Novel Therapies on Primary Biliary Cirrhosis[J]. Clin liver Dis, 2016, 20(1):113-130. |
 2016, Vol. 31
2016, Vol. 31


