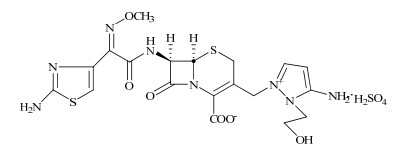
硫酸头孢噻利化学名为(-)5-氨基-2-[[(6R, 7R)-7-[(Z)-2-(2-氨基-4-噻唑基)-2-(甲氧亚氨基)乙酰胺基]-2-羧基-8-氧代-5-硫杂-1-氮杂双环[4, 2, 0]辛-2-烯-3-基]甲基]-1-(2-羟乙基)-1氢-吡唑鎓羧酸内盐单硫酸盐(图 1),是日本藤泽制药有限公司研制开发的第4代注射用头孢类抗生素,它对革兰阳性菌和革兰阴性菌均有很好的活性,特别对甲氧西林耐药的金黄色葡萄球菌、绿脓杆菌具有很好的抗菌活性,并具有较好的耐酶性。目前已在日本等国上市。由于硫酸头孢噻利的生产工艺复杂,药物本身性质不够稳定,因而产品中较易引入杂质。这些杂质的存在,不仅使药效降低,抗菌活性减弱,甚至引起严重的过敏反应。硫酸头孢噻利E型异构体就是其中重要杂质之一,它是由7位侧链上的甲氧亚胺基顺反异构化形成,化学名为(-)5-氨基-基)乙酰胺基]-2-羧基-8-氧代-5-硫杂-1-氮杂双环2-[[(6R, 7R)-7-[(E)-2-(2-氨基-4-噻唑基)-2-(甲氧亚氨[4, 2, 0]辛-2-烯-3-基]甲基]-1-(2-羟乙基)-1氢-吡唑鎓羧酸内盐单硫酸盐。目前对该杂质研究的报道很少[1]。本实验采用定向合成的方法[2-4],获得纯度较高的硫酸头孢噻利E型异构体固体。合成路线见图 2。
|
图 1 硫酸头孢噻利的化学结构 Fig. 1 Structure of cefoselis sulfate |
|
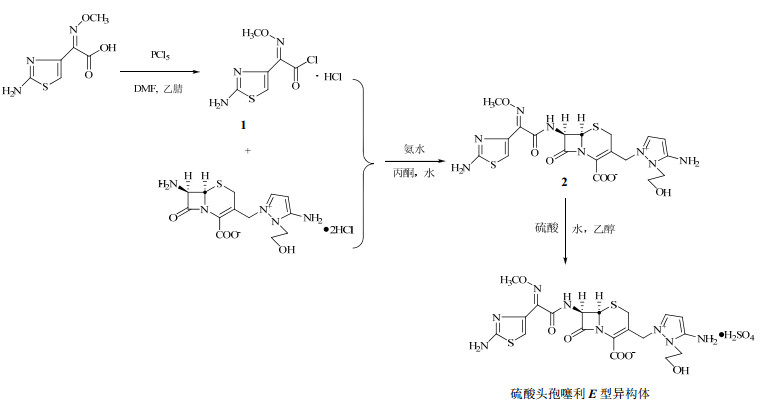
图 2 硫酸头孢噻利E型异构体的合成路线 Fig. 2 Synthetic route of E-isomer of cefoselis sulfate |
1 仪器与试剂
德国Bruker AV400型核磁共振仪;美国CoMetro 6000型高效液相色谱仪;美国Agilent G6300液质联用仪。氨噻肟酸(浙江普洛得邦制药有限公司,质量分数99.6%),7-氨基-3-[3-氨基-2-(2-羟乙基)吡唑甲基]-3-头孢烯-4-羧基盐酸盐(自制,质量分数98.5%)。其他试剂均为分析纯。
2 方法与结果 2.1 (E)-2-(2-氨基噻唑-4-基)-2-甲氧亚氨基乙酰氯盐酸盐(化合物1)的制备将氨噻肟酸(40 g)、氟化钾(0.4 g)、乙腈(200 mL)和DMF(0.5 mL)加到反应瓶中,搅拌放热。分份加入五氯化磷(50 g),降至室温,析出固体。滤过,用60 mL正己烷洗涤滤饼。真空干燥,得19 g棕红色固体化合物,收率37.3%。1H-NMR(CH3COOH-d4)进行表征,氨基噻唑环上的-CH δ7.56,与文献报道[2]一致,为(E)-2-(2-氨基噻唑-4-基)-2-甲氧亚氨基乙酰氯盐酸盐构型。
2.2 (-)5-氨基-2-[[(6R, 7R)-7-[(E)-2-(2-氨基-4-噻唑基)-2-(甲氧亚氨基)乙酰胺基]-2-羧基-8-氧代-5-硫杂-1-氮杂双环[4, 2, 0]辛-2-烯-3-基]甲基]-1-(2-羟乙基)-1氢-吡唑鎓羧酸内盐(化合物2)的制备将7-氨基-3-[3-氨基-2-(2-羟乙基)吡唑甲基]-3-头孢烯-4-羧基盐酸盐(15.0 g)、蒸馏水(45 mL)、丙酮(125 mL)加入到反应瓶中,搅拌。于10 ℃以下滴加氨水调至pH 6.5~7.0。加入化合物1(15 g),用氨水调至pH 6.5~7.0,升至室温反应4 h。加入活性炭脱色,滤过,滤液用醋酸乙酯100 mL萃取2次。分得水层滴入到丙酮(1 500 mL)中析出油状物,倾掉上清液,再加入丙酮200 mL进行分散。滤过,用丙酮洗固体,真空干燥,得棕黄色固体31 g。
将上述固体用DMF(93 mL)溶解,滴入到丙酮(1600 mL)中,析出黄色固体,滤过,得18 g浅棕黄色固体化合物2,总收率94.7%。
2.3 (-)5-氨基-2-[[(6R, 7R)-7-[(E)-2-(2-氨基-4-噻唑基)-2-(甲氧亚氨基)乙酰胺基]-2-羧基-8-氧代-5-硫杂-1-氮杂双环[4, 2, 0]辛-2-烯-3-基]甲基]-1-(2-羟乙基)-1氢-吡唑鎓羧酸内盐单硫酸盐的制备将化合物2(16 g)、纯净水(60 mL)加入到反应瓶中,搅拌,滤过不溶物。将滤液降温至0 ℃,滴加3 mol/L硫酸调至pH 2~2.5,加乙醇(13 mL)析出油状物,滤过。滤液用醋酸乙酯120 mL提取2次。向水层中滴加乙醇(10 mL),搅拌至析出油状物。滤过,将滤液滴入到1500 mL丙酮中,析出固体。滤过,用丙酮洗,真空干燥,得到粗品4.4 g,收率23.1%,HPLC面积归一化法测定质量分数87%。
取上述所得粗品(4.2 g)、纯净水(17 mL)加到反应瓶中,室温搅拌溶清。滴加乙醇(4.5 mL),降温至-5 ℃,析出油状物,倾出上清液。加入纯净水10 mL溶清,将其滴加到800 mL丙酮中析出。滤过,真空干燥,得浅黄色固体1.9 g。
将上述固体用纯净水(10 mL)搅拌,溶解,于0 ℃用3 mol/L硫酸调pH 1.0~1.5。滴加乙醇(20 mL)析油,分得上清液。室温下,向上清液中滴加乙醇(30 mL)析出黄色固体,滤过,用乙醇洗涤,真空干燥,得到0.67 g黄色固体化合物,精制收率为16.0%,HPLC面积归一化法测得质量分数为94%。
MS m/z:523.2 [M+H]+,与头孢噻利相对分子质量相同。1H-NMR(400 MHz,DMSO-d6)δ:3.20~3.34(2H,CH2),3.60(2H,CH2),3.95(3H,CH3),4.08~4.35(2H,CH2),5.10~5.17(2H,CH2),5.26~5.30(1H,CH),5.80~5.83(1H,CH),5.88~5.89(1H,CH),7.04(1H,CH),7.29(2H,NH2),7.35(2H,NH2),7.98~7.99(1H,CH),9.41~9.43(1H,NH)。硫酸头孢噻利的氨基噻唑环上的-CH氢质子δ 6.72,在其E异构体中则为δ 7.04,与文献报道[2-3]中头孢吡肟与其E异构体的1H-NMR数据,以及文献报道[5]的2-(2-氨基噻唑-4-基)-2-甲氧亚氨基乙酸盐酸盐顺反异构体1H-NMR数据的特征规律一致,因此鉴定该化合物为硫酸头孢噻利E型异构体。
3 讨论硫酸头孢噻利E型异构体为硫酸头孢噻利降解杂质(硫酸头孢噻利在紫外光照24 h,该杂质由0.01%增大至4.59%),因此本实验进行了硫酸头孢噻利E型异构体的定向合成,得到了质量较好(质量分数94%)的目标化合物固体,经MS和1H-NMR检测证明该物质结构正确。
本实验的目标化合物固体可以再经进一步纯化,作为对照品用于硫酸头孢噻利的质量研究工作中。在该杂质制备过程中,由于头孢类化合物稳定性差,因此要严格控制反应温度。本实验制备了硫酸头孢噻利E型异构体,为硫酸头孢噻利的杂质研究提供了参考。
| [1] |
蒋煜, 张哲峰, 王虹.
β-内酰胺类抗生素异构体杂质研究和质控进展[J]. 中国抗生素杂志, 2010, 35(8) : 561–566.
( 0) 0)
|
| [2] |
于沛, 贺焕华, 黄克难.
头孢吡肟E-异构体的合成与含量测定[J]. 药物分析杂志, 2008, 28(4) : 613–615.
( 0) 0)
|
| [3] |
Lim G M F, Rouble J M. Preparation of a cephalosporin antibiotic using the syn-isomer of a thiazolyl intermediate[P]. US:5594130, 1997-01-14.
( 0) 0)
|
| [4] |
薛峰, 居沈贵, 姚虎卿.
硫酸头孢噻利合成工艺研究[J]. 中国新药杂志, 2005, 14(3) : 322–324.
( 0) 0)
|
| [5] |
程青芳, 王启发, 许兴友, 等.
Z-2-(2-氨基噻唑-4-基)-2-甲氧亚氨基乙酰氯盐酸盐的制备[J]. 高校化学工程学报, 2006, 20(1) : 100–103.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

