2. 中国药科大学 天然药物活性组分与药效国家重点实验室, 江苏 南京 210009
2. State Key Laboratory of Natural Medicine Active Constituent and Effect, China Pharmaceutical University, Nanjing 210009, China
鸢尾醛型三萜主要存在于鸢尾科植物中,结构类型主要有单环、双环、螺环等,是由角鲨烯代谢的一类特殊的三萜类化合物[1],存在形式有游离鸢尾醛型三萜及其相关的脂肪酸类、脂类、苷类、豆蔻酸盐类,并且大多数游离的鸢尾醛型三萜极性较小(苷类、盐类等除外)。自1982年首次报道鸢尾醛型三萜以来[2],随着对天然产物化学研究的不断深入,迄今已发现80多个此类成分。近30年来,一些学者对其生物学活性也进行了深层次的研究与分析,结果表明鸢尾醛型三萜具有一定的抗疟、抗真菌、抗肿瘤、保护神经系统等多方面的生物活性,开始逐步受到生物医药界的重视。此外鸢尾醛型三萜主要存在于鸢尾科植物中,可作为其特征性化学成分,在植物化学分类学方面也具有重要意义。为促进鸢尾醛型三萜的开发和利用,本文对鸢尾醛型三萜在植物界的分布情况及其生物活性的研究进展做一概述。
1 分 布鸢尾醛型三萜主要存在于鸢尾科植物中,迄今已从该科多种植物中分离得到该类化合物,如德国鸢尾Iris germanica L.、黄菖蒲I. pseudacorus L.、射干Belamcanda chinensis (L.) DC等。通过研究进一步发现该类化合物主要分布于鸢尾科的鸢尾属和射干属,进一步说明了两个属之间具有很近的亲缘关系。此外,鸢尾醛型三萜在鸢尾科植物中的种类及含量不仅与物种本身有关,同时还受环境、遗传等因素的影响。Marner等[3]研究显示,黄菖蒲的不同生长部位,如根、根状茎、叶子中均含有鸢尾醛型三萜,并且根状茎及叶里含量显示出明显的季节性变化。Hasegawa等[4]研究也表明,在不同地区生长的长葶鸢尾I. delavayi Mich.中的鸢尾醛型三萜的种类及其含量存在显著差异性。
2 结构类型鸢尾醛型三萜主要分为单环、双环、螺环等结构类型,单环鸢尾醛型三萜在鸢尾科中分布较广泛,如在德国鸢尾、射干、鸢尾I. tectorum Maxim.等植物中均有分布,双环鸢尾醛型三萜主要存在于德国鸢尾中,而螺环主要集中在射干、鸢尾等植物。此外,鸢尾醛型三萜还具有较为复杂的空间结构,存在多对差向异构体。
2.1 单环型单环鸢尾醛型三萜主要分布在鸢尾科鸢尾属植物中。其中鸢尾醛(1)是鸢尾醛族的基本结构[5],其他鸢尾醛型三萜由其衍生而来,自Jaenicke等[6]从鸢尾属植物中分离得到化合物1以来,饰冠鸢尾I. cristata Ait.[7]、西伯利亚鸢尾I. sibirica L.[8]等多种植物中也分离得到了该化合物。16-hydroxyiridal(2)是化合物1在C-16位上被羟基取代的衍生物,在自然界中的分布较为相似,常与化合物1同时出现。
Littek等[9]从怪味鸢尾I. foetidissima L.中,不仅分离出化合物1、2,还首次分出两个新颖的单环鸢尾醛型三萜类化合物(6R,10S,11S)-16,17-didehydroiridal(3)和(6R,10S,11S)-16,17-didehydro-26-hydroxyiridal(4)。Abe等[10]从射干中不仅分离出了化合物2,还首次分离出了化合物2在C-16处的乙酰化产物16-O-acetyl-isoiridogermanal(5),并分得到两个单环鸢尾醛型三萜的酯类6、7。
在研究鸢尾醛型三萜的过程中,还陆续从鸢尾属的多种植物中,分离得到了10个醚类单环鸢尾醛型三萜[1, 11, 12, 13, 14],即化合物8~17。
在鸢尾属的变色鸢尾I. versicolor L.和密苏里鸢尾I. missouriensis Nutt.的混合提取物中,首次分离得到16,26-dihydroxyiridal(18)[12]。2015年,Zhang等[14]从鸢尾的根状茎中首次分离得到6个单环鸢尾醛型三萜19~24,其中化合物19和22,20和23,21和24均属于在C-22位的差向异构体。
此外,Marner等[15]从埃及的琴瓣鸢尾I. spuria L.中首次得到了7个单环鸢尾醛型三萜的糖类,分别是化合物25~31。在变色鸢尾的根状茎[8, 16]中,分得化合物32~34。在西伯利亚鸢尾的根状茎[8, 17]中分离出化合物35~37。在鸢尾属的变种植物黄褐鸢尾I. variegata L.中分得了化合物38~40[7, 18, 19]。
Takahashi等[20]首次在射干中得到单环iridobelamal A(41)。Ito等[21]也在射干中,不仅分得了化合物2、42,并且,首次发现并分离得到了在C-3位置具有长烷基侧链的3-O-decanoyl-16-O-acetyl-isoiridogermanal(43),3-O-tetradecanoyl-16-O-acetyl-isoiridogermanal(44)。单环鸢尾醛型三萜在植物中的分布见表 1,结构见图 1。
| 表 1 单环鸢尾醛型三萜在植物中的分布 Table 1 Distribution of monocyclic iridal-type triterpenoids in plants |
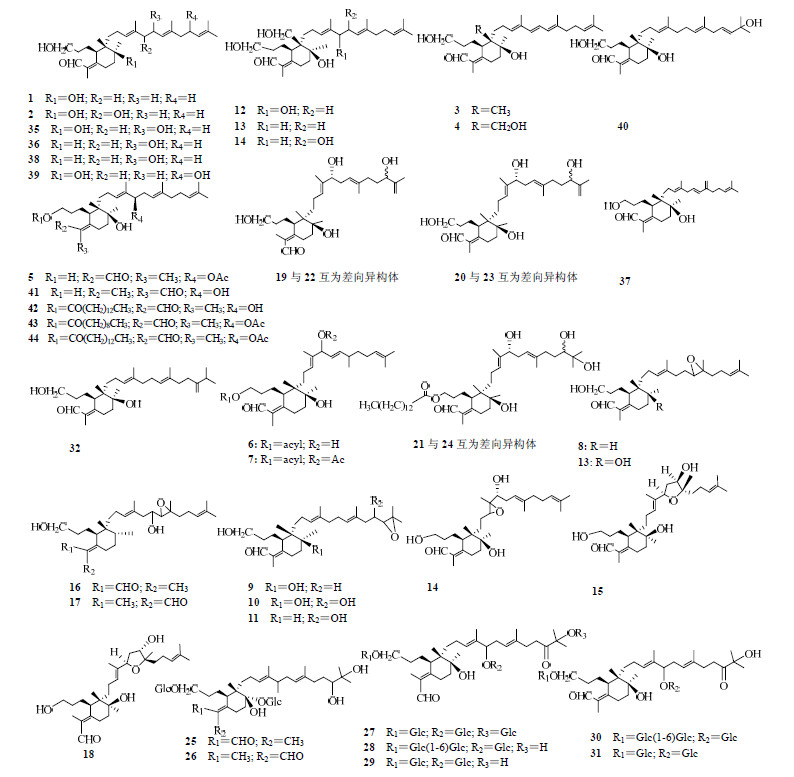 | 图 1 单环鸢尾醛型三萜的结构 Fig.1 Structures of monocyclic iridal-type triterpenoids |
迄今为止,只发现10个双环型鸢尾醛型三萜,其中在德国鸢尾分布有9个[25,26],分别是化合物45~53。另外一个是2,23-hexahydro-22-methyl-3- O,7:18,23-di-cycloiridal(54)[9]。双环鸢尾醛型三萜在植物中的分布见表 2,结构见图 2。
| 表 2 双环鸢尾醛型三萜在植物中的分布 Table 2 Distribution of bicyclic iridal-type triterpenoids in plants |
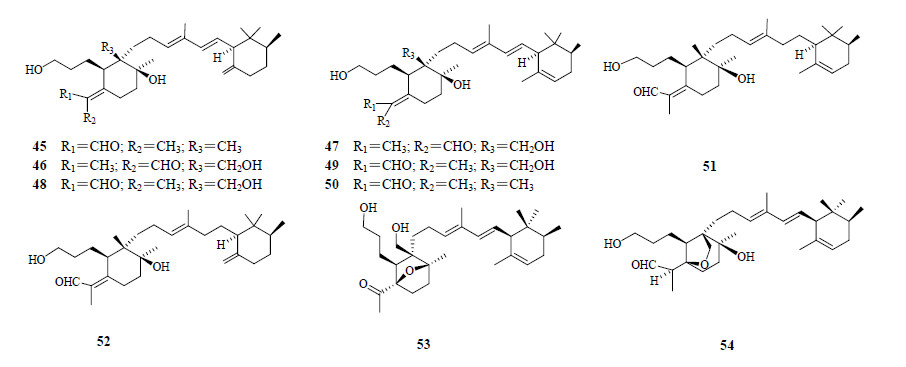 | 图 2 双环鸢尾醛型三萜的结构 Fig.2 Structures of bicyclic iridal-type triterpenoids |
螺环型鸢尾醛型三萜类化合物迄今只发现了24个,即化合物55~78。主要分布在鸢尾属的德国鸢尾和射干属的射干中。螺环鸢尾醛型三萜在植物中的分布见表 3,结构见图 3。
| 表 3 螺环鸢尾醛型三萜在植物中的分布 Table 3 Distribution of spirocyclic iridal-type triterpenoids in plants |
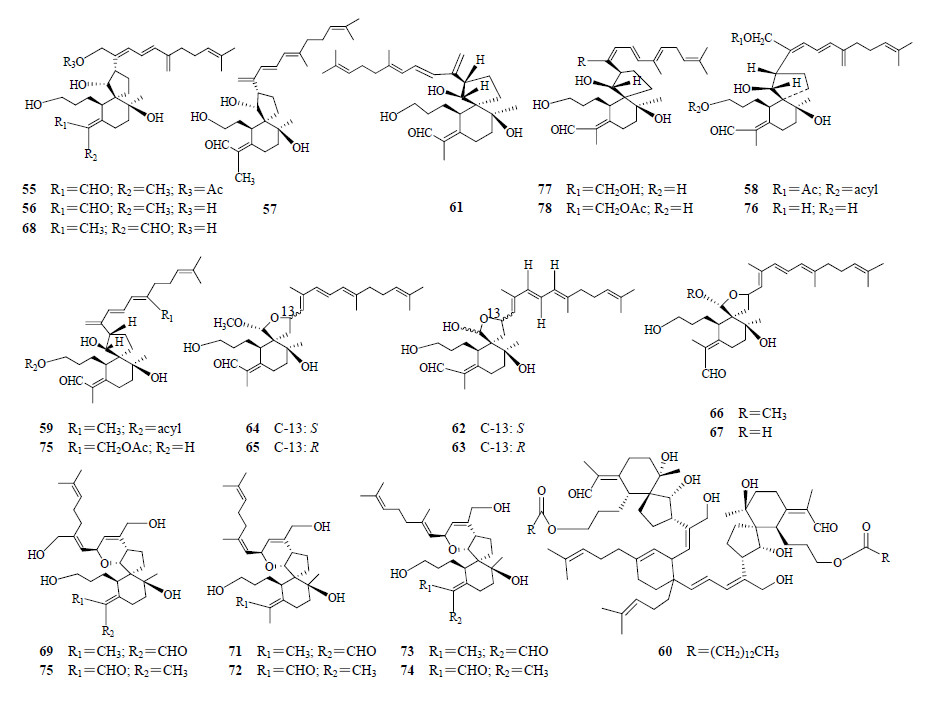 | 图 3 螺环鸢尾醛型三萜的结构 Fig.3 Structures of spirocyclic iridal-type triterpenoids |
Ito等[21]从射干中,首次分离得到了3个醚类桥环鸢尾醛型三萜anhydrobelachinal(79)、epianhydrobelachinal(80)、isoanhydrobelachinal(81)。其他鸢尾醛型三萜的结构见图 4。
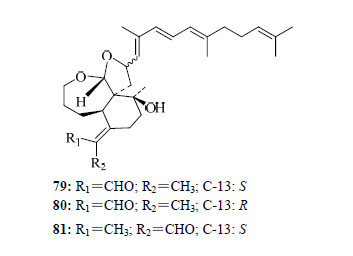 | 图 4 其他鸢尾醛型三萜的结构 Fig.4 Structures of other iridal-type triterpenoids |
鸢尾醛型三萜是一类特殊的三萜化合物,具有多种生物学活性,如抗肿瘤、保护神经系统、抗疟、咽喉黏膜刺激作用、作为细胞膜的重要组成成分等作用,以下对鸢尾醛型三萜的生物活性进行概述。
3.1 细胞毒性Bonfils等[23]从德国鸢尾的根状茎中分离得到6个鸢尾醛型三萜,并作用于两种人类肿瘤细胞菌株A2780、K562(一种对药物敏感、一种耐药),结果显示所得的鸢尾醛型三萜的IC50值都在0.1~5.3μg/mL,其中,29-acetoxyspiroiridal(75)表现出比阿霉素更好的细胞毒性;与阿霉素、紫杉醇相比,鸢尾醛型三萜不易受多重药物耐药性影响。这是首次报道鸢尾醛型三萜对A2780和K562癌细胞株具有较强毒性。
此外,Fang等[31]从鸢尾根状茎的提取物中分离纯化出4个鸢尾型三萜(iritectols A、B,isoiridogermanal,iridobelamal A),通过磺酰罗丹明B(SRB)法来测定这些化合物对人类肿瘤细胞的毒性。结果表明iritectol B、isoiridogermanal、iridobelamal A有着相似的细胞毒性效应,且在对抗COR-L23细胞上,iritectol B显示出剂量相关性效应,在体外也能诱导改变COR-L23细胞的凋亡,在浓度为100 μmol/L时,细胞凋亡率达到33%。
3.2 鱼毒活性研究表明,尽管大多数单环鸢尾醛型三萜是没有鱼毒活性的,但16-O-acetyl-isoiridogermanal却表现出了中等强度的鱼毒活性,且其经乙酰化后鱼毒活性会变强[21, 32]。然而,具有高级脂肪酸的单环及螺环结构的鸢尾醛型三萜的C-3位羟基酯化后,会降低毒性,实验中16-O-acetyl-isoiridogermanal、belachinal、spiroiridal这3个化合物表现出了不同强度的鱼毒活性。另外,Okuda等[33]根据此前的鱼毒活性研究方法,对部分鸢尾醛型三萜的鱼毒活性进行了研究,结果显示双环鸢尾醛型三萜的iriflorental、iripallidal、γ-irigermanal在不低于1 μg/mL的浓度下表现出不同强度的鱼毒活性,而单环鸢尾醛型三萜却显示无活性[24]。这些都表明鸢尾醛型三萜鱼毒活性的强弱、有无,可能与其自身的几何结构有关。
3.3 细胞膜的组成成分针对鸢尾醛型三萜对于细胞膜的影响,Bonfils等[34]用cycloiridals与胆固醇分别对细胞膜的流动性进行了具体研究。在cycloiridals存在的情况下,通过红细胞沉降率实验(ESR)测得双豆蔻酰-卵磷脂的化学参数发生改变,表明它们是脂质膜不可分割的整体,找到了cycloiridals作为细胞膜成分的证据。也有相关学者研究[35]并报道了白色念珠菌细胞在受皂苷物质损伤后,分别用加了麦角固醇和cycloiridals的悬浮培养液进行培养,观察受皂苷物质损伤的白色念珠菌细胞的磷酸盐流失的现象。实验结果表明皂苷可以沉淀麦角固醇,但不能沉淀cydoiridals。在cydoiridals存在的条件下,磷酸盐泄露的现象得以抑制,原因可能是cycloiridals作为细胞膜成分之一,导致了磷酸盐在细胞内膜不相容,保护组织免于氧化损伤及其他有害影响,对细胞膜起到保护作用。
另外,Maguire等[36]分别对未受感染及受疟感染的红细胞用鸢尾醛型三萜进行处理,实验结果显示,鸢尾醛型三萜作为植物的次生代谢产物,可改变脂质成分及参与胆固醇交换,增强细胞膜的流动性和渗透性,对细胞有结构学上的作用。
3.4 咽喉黏膜刺激作用射干是东亚的地区特征性植物,它的干燥根状茎已运用于咽喉不适症状,然而,值得一提的是它的新鲜根状茎却会刺激咽喉黏膜。Abe等[10]从射干中分离得到(+)-(6R,l0S,11S,14S,26R)-26-hydroxy- 15-methylidenespiroirid-16-enal、iso-iridogermanal、16-O-acetyl-isoiridogermanal、belamcandal及其二乙酰衍生物这5个鸢尾醛型三萜,将射干甲醇提取物及上述成分溶解在环己烷中(大约2 mg/mL),之后,将滤纸条(1 cm×5 cm)浸泡在上述溶液中,取出,风干,放置在舌头上,并在嘴里保持一段时间,发现甲醇提取物及belamcandal对咽喉黏膜有刺激性。
3.5 神经系统保护作用Zhang等[30]从鸢尾中分离得到6个带有3,6-2H吡喃结构的新型鸢尾型三萜类化合物spirioridotectals A~F。同时,对这6个化合物进行了体外生物活性实验,以神经生长因子作为阳性对照,采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法即MTT法进行评测。实验结果表明,化合物spirioridotectals A、B、F具有潜在的神经保护性能,可以阻止因血清剥夺而引发PC12细胞的损害。
3.6 抗疟作用Benoit-Vical等[37]从德国鸢尾的变种植物中分离得到iridal,用抵抗氯醛(疟虫特效药)的恶性疟原虫做实验。实验结果表明,在体外对人类疟原虫的IC50是1.8~26.0 μg/mL,具有抗疟活性。
3.7 灭螺作用Song等[29]从射干中分离出鸢尾型三萜的二聚体dibelamcandal A,将其作用于螺体内,一段时间后,观察螺的存活率。实验结果显示dibelamcandal A具有较强的灭螺活性,可用于农药生产的开发利用。
4 结 语鸢尾醛型三萜除具有上述诸多的生物活性外,同时也是鸢尾酮的前体。鸢尾酮由于拥有迷人的紫罗兰香味而成功广泛地应用到香水工业中,且一般天然鸢尾酮在不同来源的鸢尾油中是以对映体形式存在的,它们由不同鸢尾科植物的根状茎中所含的cydoiridals氧化降解所形成[38,39],所以开发利用鸢尾醛型三萜具有广阔的市场前景和重要的产业价值。
此外,鸢尾醛型三萜虽具有抗肿瘤、抗疟等多种生物学活性,对癌症、疟疾、炎症、血管等疾病的治疗与预防有极大的意义,但是鸢尾醛型三萜的疾病治疗机制尚未明确,其安全性、有效性及相应的毒理实验较少,仍需进一步深入的研究,以便更好地开发和利用该资源。
| [1] | Bonfils J P, Marner F J, Sauvaire Y. An epoxidized iridal from Iris germanica var “Rococo”[J]. Phytochemistry, 1998, 48(4): 751-753. |
| [2] | Marner F J, Krick W, Gellrich B, et al. Irigermanal and iridogermanal: two new triterpenoids from rhizomes of Iris germanica L.[J]. J Org Chem, 1982, 47: 2531-2536. |
| [3] | Marner F J, Kerp B. Composition of iridals, unusual triterpenoids from sword-lilies, and the seasonal dependence of their content in various parts of different Iris species[J]. Z Naturforsch, 1992, 47c: 21-25. |
| [4] | Hasegawa Y, Gong X, Kuroda C. Chemical diversity of iridal-type triterpenes in Iris delavayi collected in Yunnan Province of China[J]. Nat Prod Commun, 2011, 6(6): 789-792. |
| [5] | Jaenicke L, Marner F J. The irones and their origin[J]. Pure Appl Chem, 1990, 62(7): 1365-1368. |
| [6] | Jaenicke L, Marner F J. The irones and their precursors[J]. Chem Org Nut Prod, 1986, 50: 1-25. |
| [7] | Krick W, Marner F J, Jaenicke L. Isolation and structure determination of the precursors of α- and γ-irone and homologous compounds from Iris pallida and Iris florentina[J]. Z Naturforsch, 1983, 38c: 179-184. |
| [8] | Marner F J, Longerich I. Isolation and structure determination of new iridals from Iris sibirica and Iris versicolor[J]. Eur J Org Chem, 1992(3): 269-272. |
| [9] | Littek A, Marner F J. Structure determination of new iridals from Iris pallida and Iris foetidissima[J]. Helv Chim Acta, 1991, 74(8): 2035-2042. |
| [10] | Abe F, Chen R F, Yamauchi T. Iridals from Belamcanda chinensis and Iris japonica[J]. Phytochemistry, 1991, 30(10): 3379-3382. |
| [11] | Taillet L, Bonfils J P, Marner F J, et al. Isolation and structure determination of three epoxidized iridals from Iris cristata[J]. Phytochemistry, 1999, 52(8): 1597-1600. |
| [12] | Lamshöft M, Schmickler H, Marner F J. Determination of the absolute configuration of hydroxyiridals by chiroptical and NMR spectroscopic methods[J]. Eur J Org Chem, 2003, 2003(4): 727-733. |
| [13] | Fang R, Houghton P J, Luo C, et al. Isolation and structure determination of triterpenes from Iris tectorum[J]. Phytochemistry, 2007, 68(9): 1242-1247. |
| [14] | Zhang C L, Wang Y, Liu Y F, et al. Cytotoxic iridal-type triterpenoids from Iris tectorum[J]. Tetrahedron, 2015, 71(34): 5579-5583. |
| [15] | Marner F J, Singab A N B, Al-Azizi M M, et al. Iridal glycosides from Iris spuria (Zeal), cultivated in Egypt[J]. Phytochemistry, 2002, 60(3): 301-307. |
| [16] | Krick W, Marner F J, Jaenicke L. Isolation and structural determination of a new methylated triterpenoid from rhizomes of Iris versicolor L[J]. Z Naturforsch, 1983, 38c: 689-692. |
| [17] | Marner F J, Simic K, Scholz B, et al. Isolation and structure determination of a new iridal from Iris sibirica[J]. J Nat Prod, 1995, 58(2): 299-301. |
| [18] | Marner F J. Iridals and cycloiridals, products of an unusual squalene metabolism in sword lilies (Iridaceae)[J]. Curr Org Chem, 1997, 1(2): 153-186. |
| [19] | Lamshöft M, Marner F J. Analysis of the iridals in rhizome extracts of Iris variegata Linn[J]. Nat Prod Res, 2005, 19(1): 57-60. |
| [20] | Takahashi K, Hoshino Y, Suzuki S, et al. Iridals from Iris tectorum and Belamcanda chinensis[J]. Phytochemistry, 2000, 53(8): 925-929. |
| [21] | Ito H, Onoue S, Miyake Y, et al. Iridal-type triterpenoids with ichthyotoxic activity from Belamcanda chinensis [J]. J Nat Prod, 1999, 62(1): 89-93. |
| [22] | Ritzdorf I, Bartels M, Kerp B, et al. Identification of 10-desoxyiridal as an intermediate in the biosynthesis of iridals[J]. Phytochemistry, 1999, 50(6): 995-1003. |
| [23] | Bonfils J P, Pinguet F, Culine S, et al. Cytotoxicity of iridals, triterpenoids from Iris, on human tumor cell lines A2780 and K562[J]. Planta Med, 2001, 67(1): 79-81. |
| [24] | Miyake Y, Ito H, Yoshida T. Identification of iridals as piscicidal components of iridaceous plants and their conformations associated with CD spectra[J]. Can J Chem, 1997, 75(6): 734-741. |
| [25] | Ito H, Miyake Y, Yoshida T. New piscicidal triterpenes from Iris germanica[J]. Chem Pharm Bull, 1995, 43(7): 1260-1262. |
| [26] | Potterat O, Herzog C, Raith M, et al. Irigermanone, a noriridal with unprecedented methylketone function, from Iris germanica[J]. Helv Chim Acta, 2014, 97(1): 32-38. |
| [27] | Takahashi K, Suzuki S, Hano Y, et al. Protein kinase C activation by iridal type triterpenoids[J]. Biol Pharm Bull, 2002, 25(4): 432-436. |
| [28] | Marner F J, Karimi-Nejad Y, Jaenicke L. Structure determination of a new spirobicyclic triterpenoid from Iris foetidissima[J]. Helv Chim Acta, 1990, 73(2): 433-438. |
| [29] | Song Z J, Xu X M, Deng W L, et al. A new dimeric iridal triterpenoid from Belamcanda chinensis with significant molluscicide activity[J]. Org Lett, 2011, 13(3): 462-465. |
| [30] | Zhang C L, Wang Y, Liu Y F, et al. Iridal-Type triterpenoids with neuroprotective activities from Iris tectorum [J]. J Nat Prod , 2014, 77(2): 411-415. |
| [31] | Fang R, Houghton P J, Hylands P J. Cytotoxic effects of compounds from Iris tectorum on human cancer cell lines[J]. J Ethnopharmacol, 2008, 118(2): 257-263. |
| [32] | 常海涛, 史玉俊. 射干中具有毒鱼活性的鸢尾醛型三萜类化合物[J]. 中草药, 2000, 31(2): 155. |
| [33] | Okuda T, Yoshida T, Koike S, et al. New diterpene esters from Aleurites fordii fruits[J]. Phytochemistry, 1975, 14(2): 509. |
| [34] | Bonfils J P, Sauvaire Y, Maurin L. Evidence of cycloiridals as membrane constituents: effects on fluidity patterns compared to those of cholesterol[J]. Planta, 1996, 200(3): 353-357. |
| [35] | Leconte O, Bonfils J P, Sauvaire Y. Protective effect of iridals from saponin injury in Candida albicans cells[J]. Phytochemistry, 1997, 44(4): 575-579. |
| [36] | Maguire P A, Sherman I W. Phospholipid composition, cholesterol content and cholesterol exchange in plasmodium falciparum-infected red cells[J]. Mol Biochem Parasitol, 1990, 38(1): 105-112. |
| [37] | Benoit-Vical F, Imbert C, Bonfils J P, et al. Antiplasmodial and antifungal activities of iridal, a plant triterpenoid[J]. Phytochemistry, 2003, 62(5): 747-751. |
| [38] | Bicchi C, Rubiolo P, Rovida C. Analysis of constituents of Iris rhizomes. Part II. Simultaneous SFE of irones and iridals from Iris pallida L. rhizomes[J]. Flavour Frag J, 1993, 8(5): 261-267. |
| [39] | Marner F J, Jaenicke L. The absolute-configuration of iridals and cycloiridals of different origin[J]. Helv Chim Acta, 1989, 72(2): 287-294. |
 2016, Vol. 31
2016, Vol. 31


