2. 浙江中医药大学 第三临床医学院, 浙江 杭州 310009
2. The Third Clinical College, Zhejiang Chinese Medical University, Hangzhou 310009, China
酮咯酸是具有强效镇痛活性的非甾体类药物。为了改善酮咯酸的水溶性,满足注射与口服的要求,使酮咯酸在体液及胃肠道内快速起效,通常将其制备成酮咯酸氨丁三醇盐,其结构见图 1。
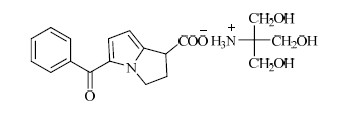 | 图 1 酮咯酸氨丁三醇的结构 Fig.1 Structure of ketorolac tromethamine |
酮咯酸氨丁三醇的注射剂(30 mg/次)和口服制剂(10 mg/次)可用于缓解中度至剧烈的术后疼痛、肿痛及其他炎症引起的疼痛。此外,其亦可缓解急性肾绞痛、胆绞痛、牙痛、创伤痛、癌症内脏痛,以及需用吗啡或哌替啶才能缓解的各种疼痛[1]。临床治疗还证明酮咯酸能有效缓解急性痛风性关节炎引起的疼痛[2]。
酮咯酸的主要药理作用是通过抑制前列腺素的合成从而实现镇痛、抗炎、退热以及抑制血小板凝集作用。通过进一步研究发现酮咯酸能提高大鼠脑内5-羟色胺的量[3],而且其镇痛活性能被阿片类受体拮抗剂纳洛酮和5-羟色胺拮抗剂所抑制[4],提示酮咯酸虽然不直接作用于阿片类受体,但能对阿片类受体起调节作用[5]。酮咯酸的镇痛活性是阿司匹林的800倍、吲哚美辛的60倍、吗啡的0.4倍,抗炎活性约为吲哚美辛的2~3倍[6]。另有研究表明S(+)构型酮咯酸的抗炎镇痛活性是外消旋体的2倍,可见其生物活性主要取决于S(+)构型[7]。
酮咯酸在人体内的药动学性质如下:血浆有效治疗浓度为0.3~5 μg/L,表观分布系数为0.021~0.037 L/(h∙kg),消除半衰期为4~6 h,口服和肌肉注射的达峰时间分别为30~40、45~50 min,90%通过尿液排泄,其中60%以原形药的形式排出[5, 8]。说明酮咯酸具有起效浓度低,镇痛活性高的优点。但传统的注射与口服给药方式存在消除速率过快,镇痛时间短等缺点。
目前,在中国上市的酮咯酸制剂有片剂、胶囊、注射剂和滴眼剂。为了克服酮咯酸口服制剂给药频繁的缺陷,采用多种制剂技术将酮咯酸制备成口服缓释微囊、渗透泵片、胃漂浮片、脉冲释药系统等实现了酮咯酸的长效镇痛作用。酮咯酸氨丁三醇口服制剂存在非甾体类药物所共有的胃肠道副作用且在治疗局部疼痛方面针对性不强,因此开发经皮肤、眼、鼻腔、口腔黏膜等多种给药途径的新型酮咯酸局部制剂,可治疗皮下软组织、关节、口腔等部位的疼痛。新型的酮咯酸制剂围绕着长效和局部针对性的镇痛目的而展开,从而满足临床上的不同镇痛需求。
1 经皮给药新型剂型经皮给药制剂是酮咯酸剂型研究与开发的热点和重点之一。酮咯酸经皮给药制剂具有起效时间长、血药浓度稳定、胃肠道不良反应小、局部疗效显著、患者使用方便等优点,适用于缓解局部炎症性疼痛和局部关节炎引起的慢性疼痛。
药物的经皮渗透性很大程度上受到药物理化性质如相对分子质量、熔点、油水分配系数及热力学活度等的影响。酮咯酸氨丁三醇的酸度系数pKa为4.29,油水分配系数为-0.56[9],在水性环境下生物利用度高。但是经皮给药制剂要求药物具有一定的亲脂性,为增加酮咯酸的透皮效果,可采用前体药物技术将其制备成亲脂性更强的前药,并通过透皮促渗剂和物理方法快速渗透角质层并起效。
1.1 前体药物技术酮咯酸的羧酸基可以与氨基或脂肪醇生成酰胺或酯,改善其脂溶性。Doh等[10]以不同脂肪醇对酮咯酸进行化学修饰,结果发现脂肪链越长,酮咯酸前药的脂溶性越强,油水分配系数接近于3时药物的渗透性最好,过长的脂肪链反而会降低药物的经皮渗透。酮咯酸乙酯和酮咯酸丙酯油水分配系数在3左右,且在皮肤组织匀浆和血清中的降解迅速。其透皮速率分别是酮咯酸的10.5、12.1倍。而酮咯酸哌嗪酯前药酮咯酸4-(4-甲基-1-哌嗪基)丁基酯也具有较优的透皮性能。酮咯酸及其前药在弱酸性条件下有较好的透皮性能[11]。
皮肤耐受性也是前药研究的重点考察因素,Liu等[12]证明低脂肪链的酮咯酸酯类前药对皮肤无不良反应。
1.2 透皮促渗剂促渗剂协助药物经过致密的表皮一般通过以下3种方式[13,14,15]:(1)通过打乱角质层的紧密结构降低渗透阻力;(2)调节药物在皮肤与基质中的分配系数;(3)促进溶剂携带药物跨越皮肤屏障。
环糊精在经皮制剂中一方面能增溶药物,另一方面能与角质层中游离的脂类相互作用从而提高药物的经皮渗透量。Nagarsenker等[16]制备了酮咯酸-羟丙基β-环糊精包合物,以离体豚鼠皮肤考察其透皮性能,发现酮咯酸包合物>酮咯酸溶液>酮咯酸氨丁三醇溶液。酮咯酸包合物凝胶经皮给药与酮咯酸氨丁三醇溶液口服给药治疗角叉菜胶诱导小鼠足趾肿胀度的药效实验中发现在给药2.5 h内口服组的药效略优于透皮给药组,2.5 h后透皮制剂组的抗炎效果更好。
刘晓阳等[17]制备了酮咯酸氨丁三醇凝胶剂,该凝胶剂透皮的最适宜pH值为6。氮酮和丙二醇联合应用使酮咯酸氨丁三醇的渗透能力更好。膝关节局部使用酮咯酸凝胶剂后,药物在滑膜液内分布较为集中,滑膜液中药物浓度几乎是血药浓度的50%。日本学者以羟丙基甲基纤维素为凝胶基质制备酮咯酸水凝胶贴剂,结果发现含氧萜类如桉叶油对亲水药物有促渗作用,而不含氧萜类如柠檬烯则对疏水性药物有较好的促渗作用。促渗剂桉叶油用量增多,酮咯酸水凝胶贴剂透皮速率提高,时滞减小。此外Amrish等[18]以磨料凝胶破坏皮肤角质层后,酮咯酸的累积透皮量进一步提高,说明角质层是酮咯酸透皮的主要屏障。
药物在基质中的溶解度也对药物的透皮存在一定的影响。药物在基质中的溶解度过大或过小都不利于药物的透皮。通过调节药物在基质与皮肤中的分配系数,可以促进药物从基质中释放并被皮肤吸收。Cho等[19]考察了酮咯酸氨丁三醇在15种分散介质中的溶解度、基质/皮肤中的分配系数和透皮性能,结果显示促进酮咯酸透皮的最佳分散介质组合为丙二醇单月桂酸酯-卡必醇(6∶4)。Choi等[20]以上述研究为基础,制备了酮咯酸橡胶膏贴剂。大鼠药动学试验表明,透皮制剂组的药时曲线面积略小于口服制剂组。但透皮制剂组的血药浓度更为稳定持久,能有效避免酮咯酸的半衰期短及口服不良反应等缺陷。
1.3 物理方法促渗药械结合促进药物的经皮吸收已经广泛应用于临床治疗。常用的医疗器械辅助药物透皮的方法有低频超声、离子导入和微针等。
低频超声辅助给药一方面能引起皮肤角质层脂质双分子层的振动,造成角质层脂质结构排列的无序化,形成脂质区域水性通道[21]。另一方面也促进药物分子的微振动。Yang等[22]应用超声透皮仪辅助酮咯酸氨丁三醇透皮给药,并进行大鼠的镇痛与抗炎药效学评价。超声辅助给药能明显提高大鼠对机械刺激、电刺激、热刺激的阈值,对大鼠肿胀度抑制率达30%,药效明显优于无超声辅助给药组。
由于酮咯酸在水中的解离度良好,离子导入法对酮咯酸透皮进入局部组织具有良好的促进作用。Tiwari等[23]研究发现电流密度、离子强度、脉冲电流的通断比和频率对酮咯酸的透皮产生显著的影响。而且离子导入与柠檬烯的乙醇溶液联合应用显著提高了酮咯酸的经皮渗透量。Gratieri等[24]进一步研究了应用离子导入后酮咯酸在局部组织内的分布。离子导入法能有效提高局部肌肉组织的药物浓度。离子导入同侧的肌肉中酮咯酸的浓度是对侧肌肉的5.26倍,透皮给药组的酮咯酸在肌肉/血液中的浓度比大于口服给药。离子导入有别于药物被动扩散吸收的传统经皮制剂,能主动的将药物送入皮肤深层,使得药物经皮途径的吸收更为快速。
通过动物药效试验证明酮咯酸经皮制剂能有效缓解多种致炎因子引起的局部炎症、肿胀与疼痛,说明其用于治疗皮下组织与局部关节疼痛具有良好的可行性。同时临床上也有酮咯酸缓解骨关节炎疼痛的应用。
2 口服给药新型剂型虽然口服酮咯酸氨丁三醇的生物利用度达80%以上,但酮咯酸在体内半衰期短且口服给药频繁,血药浓度波动大。因此制备长效稳定的口服制剂能减少给药次数,延长镇痛时间,减小药物胃肠道副作用。
2.1 口服缓释控释制剂海藻酸钠羧基和壳聚糖氨基之间的静电相互作用可形成聚电解质膜,所制备的微胶囊具有良好的生物相容性和机械强度,是一个优良的缓释给药系统[25]。酮咯酸氨丁三醇海藻酸钠-壳聚糖微囊在人工胃液和蒸馏水中的释药行为符合Higuchi方程[26]。酮咯酸纳米粒口服给药后血药浓度更为平缓,持续时间显著延长[27]。为了进一步优化酮咯酸氨丁三醇的释放行为,Sayed等[28]制备了酮咯酸氨丁三醇渗透泵片,该片能保持12 h的稳定释放,优化了药物在体内的释放行为,达到控释目的。
2.2 胃漂浮制剂胃漂浮片在胃内滞留时间长达7~8 h并逐渐释放药物,适用于半衰期短的药物。Abou等[29]通过将酮咯酸氨丁三醇制备成为漂浮片,来减少给药次数,延长止痛时间。所制备的漂浮片能持续漂浮8 h以上,其释放曲线符合Higuchi方程。药效试验证明酮咯酸氨丁三醇胃漂浮片与上市片剂相比,能有效延长镇痛时间。
2.3 脉冲式和自调式释药系统脉冲式和自调式释药系统是根据疾病与人体的时辰生物学特点,利用制剂技术,使药物的释放时间与疾病发生的节律相一致,从而达到优化治疗效果、降低药物不良反应的目的[30]。Vemula[31]以定时释放材料羟丙基甲基纤维素k100m作为内包衣,以pH值敏感材料尤特奇S100作为外包衣制备成双层包衣小片。其在胃液与小肠液中难以释放,而在结肠释放完全。在服药后12 h达到最高血药浓度。实现了酮咯酸的定时定位给药,有效缓解可预见性的疼痛。
3 眼部给药新型剂型酮咯酸氨丁三醇具有良好的眼部镇痛效果。王秀莹等[32]进行了100例应用酮咯酸氨丁三醇与芬太尼治疗眼科手术后镇痛疗效的对比考察,发现酮咯酸氨丁三醇安全有效,且在眼科手术中镇痛效果优于芬太尼。近年来,眼用冲洗液Omidria等多种含酮咯酸氨丁三醇的眼部给药制剂陆续上市。
眼部给药的特点包括给药剂量小、持续时间短、生物利用度低等。为了延长给药时间,提高其生物利用度,酮咯酸眼部给药新剂型如胶体给药系统、凝胶给药系统[33]和眼内插入剂[30]等不断被开发。由于人眼结膜囊暂时可容纳30 μL的溶液,所以应用胶束增溶酮咯酸,可提高酮咯酸的给药剂量。
3.1 胶体给药系统胶体给药系统主要包括纳米粒、微乳/纳米乳、纳米混悬液以及脂质体,具有提高药物生物利用度、控制药物释放、实现药物靶向等作用。Gupta等[34]制备了含30%酮咯酸的聚合物胶束,粒径和包封率分别为35 nm、80%。该胶束系统在8 h内释放度达60%,生物利用度是酮咯酸纳米粒混悬液的2倍以上。药效试验表明酮咯酸胶束系统的镇痛效果更为长久。
3.2 眼内插入剂眼内插入剂也称眼用膜剂,其特点是药物以膜为载体,药膜在眼结膜囊内被泪液逐渐溶解,由于药液黏度大,既不易溢出,也减少了从鼻泪管中流出的损失。因此能使药物在眼结膜囊中维持较久的有效治疗浓度,解决了滴眼液眼部药物利用度低的问题[35]。Jethava等[36]制备了酮咯酸氨丁三醇眼内插入剂,在12 h内药物稳定释放,释放度达98.62%,质量合格且没有眼部刺激性。
酮咯酸眼部新型制剂能延长药物滞留时间,控制药物释放,减少用药次数,从而提高了患者顺应性。
4 经鼻给药新型剂型2010年5月,美国FDA批准酮咯酸氨丁三醇酯鼻内喷雾剂Sprix用于治疗阿片水平的重度疼痛,其生物利用度达60%~70%,且有良好的用药安全性[37]。将镇痛药物开发成经鼻给药制剂具有以下优点[38]:(1)鼻黏膜的表面积大,结构疏松亲水,还含有大量微血管,能使药物迅速且大量的被吸收进体循环;(2)鼻内的基底膜对药物的透过没有代谢,无首关效应;(3)在某些情况下药物能穿透血脑屏障;(4)患者可根据疼痛程度自主给药,顺应性好,同时鼻部给药可降低药物过量的风险。
为了延长酮咯酸在鼻腔内的给药时间,Li等[39]制备了酮咯酸氨丁三醇的卡拉胶-泊洛沙姆复合温敏凝胶。此凝胶在室温下呈液态,可在鼻腔内温度(33 ℃)剌激下顺利发生凝胶化,从而使鼻内平均滞留时间显著延长至8.8 h,起效迅速,生物利用度达68.8%。
由于鼻分泌液中含有丰富阳离子,Li等[40]以离子敏感材料脱乙酰结冷胶制备酮咯酸氨丁三醇温敏和离子敏感型原位凝胶。以环糊精类衍生物包合增加药物的生物利用度。采用醋酸扭体法和甩尾法显示该凝胶的镇痛性能与市售Sprix鼻喷剂没有显著性区别,使用安全无副作用。
5 口腔黏膜给药新型剂型酮咯酸氨丁三醇在水性环境中溶解性好,易被黏膜吸收。市售30 mg酮咯酸氨丁三醇舌下含片在人体内起效迅速(tmax=0.94 h),镇痛效果良好(Cmax=3.44 μg/mL),24 h药时曲线面积为11.80 μg/(mL·h)[4]。该药动学行为说明酮咯酸氨丁三醇舌下含片可作为酮咯酸口服给药的替代剂型。
口腔贴膜剂相比于其他口腔给药剂型给药时间更长,加入镇痛药物后可用于发挥口腔局部或全身的镇痛作用。Alanazi等[41]以10%聚维酮作为成膜剂,以卡波姆和羟丙基甲基纤维素作为黏附材料制备了含酮咯酸氨丁三醇5 mg/cm2的口腔贴膜剂。体外释放度和在体实验表明6 h时内该口腔贴膜剂释放度达85%~90%,口腔药物浓度在治疗浓度以上。
局部应用酮咯酸能有效治疗口腔局部疼痛[42],口腔黏膜给药剂型的开发可为口腔疼痛临床治疗提供了新的选择。
6 结 语酮咯酸没有阿片类镇痛药物的诸多副作用。酮咯酸氨丁三醇注射剂常与阿片类药物联合使用,用于治疗剧烈疼痛,但是其本身的镇痛效能也不容忽视。随着制剂种类的不断丰富,酮咯酸在治疗局部疼痛、慢性疼痛、风湿炎症疼痛方面也在不断的探索和评价。
传统的酮咯酸氨丁三醇口服与注射制剂存在给药频繁、非甾体类药物所共有的胃肠道副作用、顺应性差等缺陷。酮咯酸的缓控释口服制剂和脉冲给药系统可以实现长效镇痛和提前镇痛的效果。酮咯酸经皮肤、眼部、鼻腔、口腔等多种给药途径的局部给药制剂的开发,扩大了适应症范围,丰富了患者在局部镇痛制剂的选择。近年来,国内外先后有滴眼剂与喷鼻剂上市。通过新给药途径和新制剂种类的开发等工作,使得酮咯酸的给药方式更加多样、药效更为显著与持久、药物安全性更高,从而有效缓解疼痛患者的痛苦。
| [1] | 张生茂, 方 华. 酮咯酸氨丁三醇用于术后镇痛研究进展[J]. 内蒙古医学杂志, 2015, 47(1): 49-51. |
| [2] | Shrestha M, Chiu M J, Martin R L, et al. Treatment of acute gouty arthritis with intramuscular ketorolac tromethamine[J]. Am J Emerg Med, 1994, 12(4): 454-455. |
| [3] | Aly S, Mahmoud M F, Hassan S H M, et al. Evaluation of the analgesic activity and safety of ketorolac in whole body fractionated gamma irradiated animals[J]. Fut J Pharm Sci, 2015, 1(1): 8-15. |
| [4] | Martínez A L, González-Trujano M E, Chávez M, et al. Hesperidin produces antinociceptive response and synergistic interaction with ketorolac in an arthritic gout-type pain in rats[J]. Pharmacol Biochem Behav, 2011, 97(4): 683-689. |
| [5] | Galán-Herrera J F, Poo J L, Maya-Barrios J A, et al. Bioavailability of two sublingual formulations of ketorolac tromethamine 30 mg: a randomized, open-label, single-dose, two-period crossover comparison in healthy Mexican adult volunteers[J]. Clin Ther, 2008, 30(9): 1667-1674. |
| [6] | Buckley M M T, Brogden R N. Ketorolac, a review of its pharmacodynamic and pharmacokinetic properties and therapeutic potential[J]. Drug Evaluat, 1990, 39(1): 86-109. |
| [7] | Roy S D, Chatterjee D J, Manoukian E, et al. Permeability of pure enantiomers of ketorolac through human cadaver skin[J]. J Pharm Sci, 1995, 84(8): 987-990. |
| [8] | 于金贵, 应诗达. 非类固醇类镇痛药—酮咯酸[J]. 国际麻醉学与复苏杂志, 1993, 14(4): 236-239. |
| [9] | Sanderson H, Thomsen M. Comparative analysis of pharmaceuticals versus industrial chemicals acute aquatic toxicity classification according to the United Nations classification system for chemicals. Assessment of the (Q) SAR predictability of pharmaceuticals acute aquatic toxicity and their predominant acute toxic mode-of-action[J]. Toxicol Lett, 2009, 187(2): 84-93. |
| [10] | Doh H J, Cho W J, Yong C S, et al. Synthesis and evaluation of ketorolac ester prodrugs for transdermal delivery[J]. J Pharm Sci, 2003, 92(5): 1008-1017. |
| [11] | Qandil A, Al-Nabulsi S, Al-Taani B, et al. Synthesis of piperazinylalkyl ester prodrugs of ketorolac and their in vitro evaluation for transdermal delivery[J]. Drug Dev Ind Pharm, 2008, 34(10): 1054-1063. |
| [12] | Liu K S, Hsieh P W, Aljuffali I A, et al. Impact of ester promoieties on transdermal delivery of ketorolac[J]. J Pharm Sci, 2014, 103(3): 974-986. |
| [13] | Williams A C, Barry B W. Penetration enhancers[J]. Adv Drug Delivery Rev, 2004, 56(5): 603-618. |
| [14] | Alexander A, Dwivedi S, Ajazuddin, et al. Approaches for breaking the barriers of drug permeation through transdermal drug delivery[J]. J Control Release, 2012, 164(1): 26-40. |
| [15] | Goh C F, Lane M E. Formulation of diclofenac for dermal delivery[J]. Int J Pharm, 2014, 473(1/2): 607-616. |
| [16] | Nagarsenker M S, Amin L, Date A A. Potential of cyclodextrin complexation and liposomes in topical delivery of ketorolac: in vitro and in vivo evaluation[J]. AAPS PharmSciTech, 2008, 9(4): 1165-1170. |
| [17] | 刘晓阳, 刘锡联, 曹丰亮, 等. 酮咯酸氨丁三醇凝胶剂体外经皮渗透研究[J]. 中国医院药学杂志, 2007, 27(1): 56-58. |
| [18] | Amrish C, Kumar S P. Transdermal delivery of ketorolac[J]. Yakugaku Zasshi, 2009, 129(3): 373-379. |
| [19] | Cho Y A, Gwak H S. Transdermal delivery of ketorolac tromethamine: effects of vehicles and penetration enhancers[J]. Drug Dev Ind Pharm, 2004, 30(6): 557-564. |
| [20] | Choi J S, Cho Y A, Chun I K, et al. Formulation and evaluation of ketorolac transdermal systems[J]. Drug Deliv, 2007, 14(2): 69-74. |
| [21] | 谢 菡, 葛卫红, 于 峰. 超声介导镇痛药物透皮吸收研究进展[J]. 现代生物医学进展, 2012, 12(9): 1760- 1762. |
| [22] | Yang J H, Kim T Y, Lee J H, et al. Anti-hyperalgesic and anti-inflammatory effects of ketorolac tromethamine gel using pulsed ultrasound in inflamed rats[J]. Arch Pharm Res, 2008, 31(4): 511-517. |
| [23] | Tiwari S B, Udupa N. Investigation into the potential of iontophoresis facilitated delivery of ketorolac[J]. Int J Pharm, 2003, 260(1): 93-103. |
| [24] | Gratieri T, Pujol-Bello E, Gelfuso G M, et al. Iontophoretic transport kinetics of ketorolac in vitro and in vivo: demonstrating local enhanced topical drug delivery to muscle[J]. Eur J Pharm Biopharm, 2014, 86(2): 219-226. |
| [25] | 何荣军, 杨 爽, 孙培龙, 等. 海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J]. 食品与机械, 2010, 26(2): 166-169, 173. |
| [26] | 陶昱斐, 姚 瑶, 丁燕飞, 等. 酮咯酸氨丁三醇海藻酸钠-壳聚糖微囊的制备[J]. 中国医药工业杂志, 2006, 37(6): 401-403. |
| [27] | Radwan M A, AlQuadeib B T, Aloudah N M, et al. Pharmacokinetics of ketorolac loaded to polyethylcyanoacrylate nanoparticles using UPLC MS/MS for its determination in rats[J]. Int J Pharm, 2010, 397(1/2): 173-178. |
| [28] | Sayed O M, Adel A Ali. Development and characterization of ketorolac tromethamine osmotic pump tablets[J]. J Drug Deliv Sci Tec, 2013, 23(3): 275-281. |
| [29] | Abou El Ela Ael S, Hassan M A, El-Maraghy D A. Ketorolac tromethamine floating beads for oral application: characterization and in vitro/in vivo evaluation[J]. Saudi Pharm J, 2014, 22(4): 349-359. |
| [30] | Ashutosh P. Pulsatile Drug-delivery Systems [M]. Berlin: Lap Lambert Academic Publishing, 2011. |
| [31] | Vemula S K. Formulation and pharmacokinetics of colon-specific double-compression coated mini-tablets: chronopharmaceutical delivery of ketorolac tromethamine[J]. Int J Pharm, 2015, 491(1/2): 35-41. |
| [32] | 王秀莹, 于金玲, 孙万里, 等. 酮咯酸氨丁三醇用于眼科术后镇痛50例疗效观察[J]. 山东医药, 2008, 48(24): 95-96. |
| [33] | 尤 楠, 孟 涛, 刘晨芳. 酮咯酸氨丁三醇眼用凝胶剂的制备工艺与质量控制[J]. 食品与药品, 2010, 12(7): 229-232. |
| [34] | Gupta A K, Madan S, Majumdar D K, et al. Ketorolac entrapped in polymeric micelles: preparation, characterisation and ocular anti-inflammatory studies[J]. Int J Pharm, 2000, 209(1/2): 1-14. |
| [35] | 杨金华. 浅谈眼用膜剂的优势和前景[J]. 中外健康文摘, 2013(21): 53. |
| [36] | Jethava J K, Jethava G K. Design, formulation, and evaluation of novel sustain release bioadhesive in-situ gelling ocular inserts of ketorolac tromethamine[J]. Int J Pharm Investig, 2014, 4(4): 226-232. |
| [37] | Bacon R, Newman S, Rankin L, et al. Pulmonary and nasal deposition of ketorolac tromethamine solution (SPRIX) following intranasal administration[J]. Int J Pharm, 2012, 431(1/2): 39-44. |
| [38] | Ugwoke M I, Agu R U, Verbeke N, et al. Nasal mucoadhesive drug delivery: background, applications, trends and future perspectives[J]. Adv Drug Deliv Rev, 2005, 57(11): 1640-1665. |
| [39] | Li C, Li C, Liu Z, et al. Enhancement in bioavailability of ketorolac tromethamine via intranasal in situ hydrogel based on poloxamer 407 and carrageenan[J]. Int J Pharm, 2014, 474(1/2): 123-133. |
| [40] | Li X, Du L, Chen X, et al. Nasal delivery of analgesic ketorolac tromethamine thermo-and ion-sensitive in situ hydrogels[J]. Int J Pharm, 2015, 489(1/2): 252-260. |
| [41] | Alanazi F K, Abdel Rahman A A, Mahrous G M, et al. Formulation and physicochemical characterisation of buccoadhesive films containing ketorolac[J]. J Drug Deliv Sci Tec, 2007, 17(3): 183-192. |
| [42] | 田 薇, 宋必卫, 何 艳, 等. 酮咯酸口腔局部镇痛作用的实验和临床研究[J]. 中国药理学通报, 2000, 16(4): 466-468. |
 2016, Vol. 31
2016, Vol. 31


