2. 天津药物研究院 医药信息中心, 天津 300193
2. Drug Informatics Center, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
通用名:ribociclib
别名:LEE-011
化学名:7-环戊基-N,N-二甲基-2-((5-(哌嗪-1-yl)吡啶-2-yl)氨基)-7H-吡咯并[2,3-d]嘧啶-6-甲酰胺
CAS:1211441-98-3
分子式:C23H30N8O
相对分子质量:434.54
结构见图 1
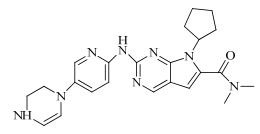 | 图 1 ribociclib的结构式 Fig.1 Structure of ribociclib |
原研公司:诺华公司
药理分类:细胞周期蛋白依赖性激酶抑制剂
适应症:黑色素瘤、脂肪肉瘤、成胶质细胞瘤、非小细胞性肺癌、转移性乳癌、畸胎瘤
目前阶段:III期临床
给药途径:口服
2 相关背景乳腺癌是发生在乳腺上皮组织的恶性肿瘤,99%发生于女性患者,男性仅占1%。由于乳腺癌细胞丧失了正常细胞的特性,细胞之间连接松散,容易脱落,但癌细胞一旦脱落,游离的癌细胞可以随血液或淋巴液播散全身,形成转移,危及生命。目前乳腺癌已成为威胁女性健康的常见肿瘤。全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势。美国8名妇女一生中就会有1人罹患乳腺癌。我国不是乳腺癌的高发国家,但近年乳腺癌发病率正以每年3%~4%的增长率急剧上升,高出高发国家1%~2%。2010年中国人口协会发布的《中国乳腺疾病调查报告》显示,2003—2009年我国城市乳腺癌患者死亡率增长了38.91%。国家癌症中心和中国疾病预防控制中心2012年公布的2009年乳腺癌发病数据显示:我国肿瘤登记地区乳腺癌发病率位居女性恶性肿瘤的首位,全国女性乳腺癌发病率合计为42.55/10万,其中城市为51.91/10万,农村为23.12/10万。乳腺癌成为当前社会的重大公共卫生问题,也已成为当今危害女性健康的第一“杀手”。
细胞周期蛋白依赖性激酶(CDK)不同成员(CDK 1~13)与不同细胞周期蛋白(cyclin)结合,形成活性复合物,促进细胞周期转变,调控细胞转录,启动DNA合成。CDK4/6与cyclin D形成的复合物磷酸化视网膜母细胞瘤蛋白,促进细胞增殖,使细胞周期由G1期向S1期转变[1, 2]。CDK4/6抑制剂将细胞周期阻滞于G1期,从而起到抑制肿瘤增殖的作用[3]。palbociclib、ribociclib和abemaciclib是处于不同研发阶段的3种选择性细胞周期蛋白依赖性激酶4/6抑制剂[4]。其中辉瑞公司的palbociclib已经在今年2月凭借一项II期研究的无进展生存期数据获得了FDA的加速批准,用作乳腺癌的一线治疗。
3 合成路线[5, 6]嘧啶化合物5-溴-2,4-二氯嘧啶和环戊胺经芳香亲核取代反应得到化合物1,通过Sonogashira偶联反应,得到化合物2,随后在碱性条件下环化,得到化合物3。化合物3在MnO2以及NaCN的条件下经过中间体,与二甲胺反应得到化合物4。哌嗪和2-硝基-5-氯吡啶经过芳香亲核取代反应得到化合物5,随后Boc保护氨基,氢化还原硝基得到化合物6。将化合物4和化合物6通过Buchwald-Hartwig胺化反应得到化合物7,在HCl存在下脱除Boc保护基,得到化合物8,将其转化为琥珀酸盐即得到目标化合物ribociclib。
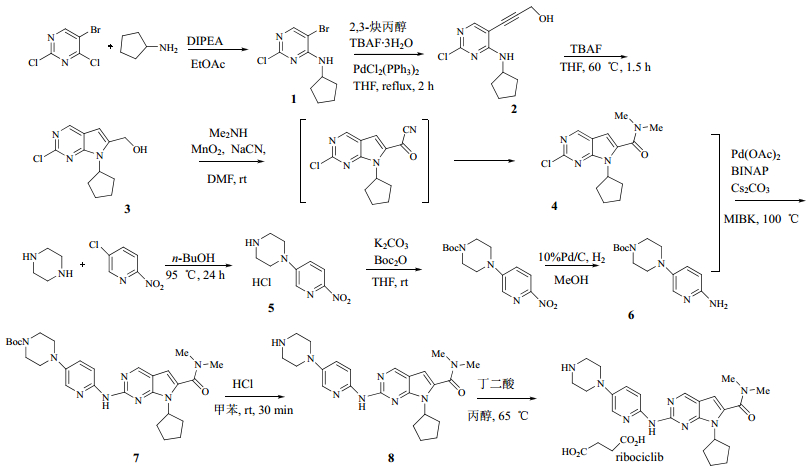 | 图 2 ribociclib的合成路线 Fig.2 Synthetic route of ribociclib |
ribociclib属于高度特异性周期蛋白依赖性激酶4/6双重抑制剂,可靶向抑制D1/CDK4、D3/CDK6细胞周期,具有潜在的抗肿瘤活性。体外试验表明,ribociclib能够显著抑制17种神经母细胞瘤细胞系中12种的生长,平均IC50为307 nmol/L。小鼠每天灌胃给予ribociclib 200 mg/kg,可以显著延迟小鼠体内BE2C、1643细胞的生长,但不影响体质量的变化
5 临床研究 5.1 乳腺癌 5.1.1 I期临床2014年11月,向我国提交了转移性乳腺癌临床试验的申请。
5.1.2 II期临床2013年10月开展了II期、随机、术前药效学研究(NCT01919229、CLEE011A2201、2013-002588-24、MONALEESA-1),评估ribociclib联合来曲唑和来曲唑组治疗原发性乳腺癌的疗效(n=120)。该研究已在2015年2月完成。
2013年9月,在美国、澳大利亚、欧洲和中国香港开展了一项开放、随机、平行设计的Ib/II期试验(NCT01857193、CLEE011X2106),用于评估ribociclib联合依维莫司、依西美坦治疗绝经后妇女(n=185)ER+/HER2−局部晚期或转移性乳腺癌的安全性和有效性,预计在2016年6月完成。Ib期部分试验数据显示,在平稳阶段(第一周期,第15天),ribociclib和依维莫司在各自给药剂量范围内被快速吸收,平均tmax分别为2、1 h。13例可评估患者中,1例出现局部反应,7例病情稳定。进一步的临床数据表明,40位可评价的患者中,1例未确认完成反应、4例部分反应和14例病情稳定,9名患者既没有完全反应也没有病情进展[7]。
2013年10月,一项开放、随机、平行设计、多中心、剂量确定、安全性/有效性、Ib/II期试验(NCT01872260、CLEE011X2107)在美国、澳大利亚、欧洲、中国香港和以色列开展,用于评估ribociclib、BYL-719联合来曲唑治疗ER+/HER2−局部晚期或转移性乳腺癌(n=290),预计将于2016年4月完成。Ib期研究了最大耐受剂量(MTD)的剂量递增。初期的试验结果表明ribociclib联合来曲唑组患者中1例局部反应、2例病情稳定;BYL-719联合来曲唑组患者中2例病情稳定,3例没有完全反应、疾病也没有进展。ribociclib组患者中有1例局部反应,2例病情稳定,1例既无完全反应也无病情进展,2例病情进展。2014年12月公布的进一步的数据显示,ribociclib联合来曲唑组出现2例剂量限制毒性报告,确定了II期推荐剂量为ribociclib 600 mg/d+来曲唑2.5 mg/d;BYL-719联合来曲唑组未见剂量限制毒性报告,确定的II期推荐剂量为BYL-719 300 mg/d+来曲唑2.5 mg/d;ribociclib组出现1例剂量限制毒性报告,剂量递增试验正在进行,未确定推荐剂量[8]。
5.1.3 III期临床2014年11月,在美国等十几个国家和地区开始了一项随机、双盲、安慰剂对照的III期临床研究(NCT02278120、CLEE011E2301、MONALEESA-7),评估ribociclib或安慰剂联合他莫昔芬、戈舍瑞林以及非类固醇类芳香酶抑制剂联合戈舍瑞林治疗绝经前妇女ER+/HER2−晚期乳腺癌(n=660)的疗效。研究主要考察无进展生存期。试验预计将于2018年2月完成。另一项随机、双盲、安慰剂对照的III期临床研究(NCT01958021、CLEE011A2301、2013-003084-61、MONALEESA-2)于2013年12月进行,考察ribociclib联合来曲唑治疗绝经后妇女(n=500)初次ER+/HER2−晚期或转移性乳腺癌[9]。试验预计将于2016年11月完成。
5.2 黑色素瘤 5.2.1 I期临床2010年12月,在美国进行了多中心、开放、剂量递增的ribociclib的I期临床试验(NCT01237236、CLEE011X2101、EudraCT 2009- 017017-30)治疗晚期实体肿瘤患者或淋巴瘤(预期n=60)。同时也在法国、荷兰的医学中心招募病例进行试验。在2013年4月完成了试验[10]。78例患者数据表明ribociclib是安全的,口服最大耐受量为900 mg/d,治疗4、6个疗程的病情稳定率分别为26%、14%。出现的不良反应主要为常见的3、4级不良反应,包括中性粒细胞减少症(19%)、淋巴细胞减少(14%)和白血球减少症(12%)。2014年9月公布的I期临床数据表明,未成年人使用ribociclib的风险与成人类似[11]。2013年5月,一项ribociclib用于恶性杆状瘤和神经细胞瘤治疗的多中心、开放、I期临床试验(NCT01747876、CLEE011X2102、EudraCT 2012-004228-40)在欧洲、美国、澳大利亚和加拿大开展。2014年9月,完成的临床数据表明,未成年人每天使用ribociclib 350 mg/m2的风险与成人患者600 mg/m2的风险类似[12]。
5.2.2 I/II期临床2013年6月,一项非随机、开放、Ib/II期试验(NCT01781572、CMEK162X2114)在美国、澳大利亚和欧洲开展,研究ribociclib联合binimetinib治疗NRAS突变黑色素瘤患者(预估n=58)的安全性和有效性。2014年6月公布了结果,确立ribociclib的最大耐受量为200 mg(1次/d,连续给药3周,停药1周),binimetinib的最大耐受量为45 mg(2次/d,连续给药)[13]。2013年7月,ribociclib联合LGX-818治疗BRAF突变黑色素瘤患者(n=150)安全性和有效性的随机、开放、Ib/II期试验(NCT01777776、CLEE011X2105)在美国、澳大利亚、巴西、加拿大、欧洲和我国台湾展开,并于2015年12月完成。2014年9月宣布的试验数据表明,与LGX-818组比较,ribociclib联合LGX-818(200 mg/300 mg、300 mg/200 mg)组中LGX-818风险分别增加了1.5、2~3倍,而ribociclib的风险无变化、降低50%。9例可评价的患者反应中,2例部分应答(11例无效,1例预治疗)和6例病情稳定。进一步的剂量递增试验正在进行[14]。
5.3 非小细胞肺癌一项开放、非随机性、平行设计、I/II期试验(NCT02292550、CLEE011X2110C)2015年2月在美国、法国、西班牙和我国台湾开始,用于评价ribociclib联合色瑞替尼治疗非小细胞肺癌(预估n=170),试验将于2017年2月完成。
5.4 畸胎瘤2014年12月在美国、法国、西班牙开展一项随机、盲法、安慰剂对照的II期试验(NCT02300987、CLEE011X2201、2014-000428-12),用于评估ribociclib治疗复发/难治性畸胎瘤(预估n=42)。预计试验将在2018年11月完成。
5.5 脂肪肉瘤一项非盲、单组设计、I/II期临床研究(NCT02343172、CHDM201X2103C)于2015年2月在美国、西班牙、法国、新加坡、加拿大、德国、我国台湾开展,用于评估HDM-201联合ribociclib用于治疗脂肪肉瘤(预估n=59)的安全性和有效性。研究预计将在2017年8月完成。2015年2月,撤回了在美国的试验,但仍开始在其他国家对脂肪肉瘤患者(预估n=86)进行治疗评估。2015年3月,多中心试验在加拿大开始,估计试验将于2017年9月完成。
5.6 胶质母细胞瘤非盲、单组设计、I期试验(NCT02345824、D13223)于2015年2月在美国进行,用于ribociclib对复发性胶质母细胞瘤或间变性神经胶质瘤患者(n=120)的疗效评估。试验预计将于2016年7月完成。
6 结语作为细胞周期蛋白依赖性激酶(CDK)4/6双重抑制剂,ribociclib联合来曲唑治疗绝经后妇女ER+/HER2−晚期或转移性乳腺癌的治疗方面效果较好,同时在I、II期临床对黑色素瘤、非小细胞肺癌、畸胎瘤、脂肪肉瘤和胶质母细胞瘤的治疗也表现出较好的效果,能否可以像palbociclib一样获得FDA的加速批准也未可知。另外相关临床研究多为ribociclib联合相关药物的治疗研究,那么ribociclib单用效果的评估工作有待进一步跟踪观察。总之ribociclib的临床效果明显,有望成为一个新的乳腺癌治疗的一线用药。
| [1] | Toogood P L, Harvey P J, Repine J T, et al. Discovery of a potent and selective inhibitor of cyclin-dependent kinase 4/6 [J]. J Med Chem, 2005, 48(7): 2388-2406. |
| [2] | VanderWel S N, Harvey P J, McNamara D J, et al. Pyrido[2,3-d]pyrimidin-7-ones as specific inhibitors of cyclin-dependent kinase 4 [J]. J Med Chem, 2005, 48(7): 2371-2387. |
| [3] | VanArsdale T, Boshoff C, Arndt K T, et al. Molecular pathways: targeting the cyclin D-CDK4/6 axis for cancer treatment [J]. Clin Cancer Res, 2015, 21(13): 2905-2910. |
| [4] | 崔艳丽, 金玉洁, 田 苗, 等. 周期蛋白依赖性激酶4/6抑制剂palbociclib [J]. 现代药物与临床, 2014, 29(10): 1178-1182. |
| [5] | Gilbert B, Christopfer T B, Clinton A B, et al. Pyrrolopyrimidine compounds as CDK inhibitors [P]. WO: 2010/020675 A1, 2009-08-20. |
| [6] | Calienni J V, Chen G, Gong B, et al. Salt(s) of 7-cyclopentyl-2-(5-piperazin-1-yl-pyridin-2-ylamino)-7H- pyrrolo[2,3-d]pyrimidine-6-carboxylic acid dimethylamide and processes of making thereof [P]. US: 2012/0115878 A1, 2012-05-10. |
| [7] | Bardia A, Chavez-MacGregor C, Modi S, et al. 500 Triple blockade with LEE011, everolimus, and exemestane in women with ER+/HER2- advanced/metastatic breast cancer: results from a Phase Ib clinical trial [J]. Eur J Cancer, 2014, 50(S 6): 163. |
| [8] | Juric D, Hamilton E, Estévez L G, et al. Phase Ib/II study of LEE011 and BYL719 and letrozole in ER+, HER2- breast cancer: safety, preliminary efficacy and molecular analysis [J]. Cancer Res, 2015, 75(9 Suppl): 19-24. |
| [9] | Novartis. Novartis emphasizes new focused portfolio at its first Meet Novartis Management investor day [EB/OL]. (2014-06-18). [2015-07-11]. https://www.novartis.com/news/media-releases/novartis-emphasizes-new-focused-portfolio- its-first-meet-novartis-management |
| [10] | Infante J R, Shapiro G I, Witteveen P O, et al. Phase 1 multicenter, open label, dose-escalation study of LEE011, an oral inhibitor of cyclin-dependent kinase 4/6, in patients with advanced solid tumors or lymphomas [J]. Mol Cancer Ther, 2013, 12(11 Suppl): A276. |
| [11] | Novartis. LEE011 [EB/OL]. (2013-12-05). [2015-07-11]. http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/OncologicDrugs AdvisoryCommittee/UCM373175.pdf. |
| [12] | Geoerger B, Bourdeaut F, Dubois S G, et al. Phase i study of LEE011 (CDK4/6 inhibitor) in patients with malignant rhabdoid tumors, neuroblastoma, and cyclin D-CDK4/6 pathway-activated tumors [J]. Ann Oncol, 2014, 25(suppl 4): iv151-iv152. |
| [13] | Sosman J A. A phase 1b/2 study of LEE011 in combination with binimetinib (MEK162) in patients with NRAS-mutant melanoma: early encouraging clinical activity [J]. J Clin Oncol, 2014(suppl): 9009. |
| [14] | Taylor M, Sosman J A, Gonzalez R, et al. Phase Ib/II study of LEE011 (CDK4/6 inhibitor) and LGX818 (BRAF inhibitor) in BRAF-mutant melanoma [J]. Ann Oncol, 2014, 25(suppl 4): iv374-iv393. |
 2015, Vol. 30
2015, Vol. 30


