在欧美等西方国家中前列腺癌是引起男性死亡的重要原因之一,并且在包括中国在内的亚洲国家中前列腺癌的发病率也在不断上升[1]。雄激素阻断疗法是治疗前列腺癌的一线治疗方法,这一方法在早期的临床治疗中取得不错的效果,但是随着患者病情的发展,雄激素阻断疗法不再有效,前列腺癌发展为更为凶险的非雄激素依赖的前列腺癌或去势抵抗性前列腺癌[2]。研究发现,不论是早期的前列腺癌还是后期的非雄激素依赖的前列腺癌或去势抵抗性前列腺癌,雄激素受体都在它们的发生、发展中起着重要作用。降低雄激素受体在肿瘤细胞中的活性就能抑制肿瘤的生长,因此雄激素受体是治疗前列腺癌的重要靶点[3]。雄激素受体是核受体超家族中的一员[4],主要由3个重要的结构域组成。这3个结构域分别是结构多变的氮端结合位点(NTD)、高度保守的DNA结合位点(DBD)和碳端的配体结合位点(LBD)[5]。所有传统的针对雄激素受体的治疗药物,包括最新上市的恩扎鲁胺,都作用于雄激素受体的配体结合位点上的配体结合口袋[6]。然而,随着治疗时间的延长,患者对药物产生耐药性,导致了这类传统治疗药物的治疗效果在下降[7]。为了避免耐药性的产生,研究者们致力于发现雄激素受体上新的药物结合位点。目前认为雄激素受体上潜在的结合位点有配体结合位点末端的第二活性功能区(AF2)、第二活性功能区附近的第三结合功能区(BF3)、氮端结合位点上的第一活性功能区(AF1)和DNA结合位点(DBD)。除雄激素受体配体结合位点外,本文主要对作用于AF1、AF2、BF3和DBD的药物进行综述。
1 作用于配体结合位点的药物
1.1 作用于配体结合口袋的药物
配体结合位点由配体结合口袋和AF2组成。临床上经常使用的雄激素受体拮抗剂直接作用于雄激素受体的配体结合口袋,这类拮抗剂主要包括第一代药物氟他胺、比卡鲁胺、尼鲁米特和第二代药物恩扎鲁胺[8]。氟他胺是最早发现的非甾体类雄激素受体拮抗剂,1989年在美国上市,它的代谢产物羟基氟他胺也具有雄激素受体拮抗活性。氟他胺与羟基氟他胺都已用于前列腺癌的临床治疗,其中氟他胺的IC50值为3.49 μmol/L[9]。比卡鲁胺是一种外周选择性雄激素受体拮抗剂,它的这种性质主要是由于它不易透过血脑屏障。比卡鲁胺1995年在英国和美国上市,但由于其安全性的问题,比卡鲁胺在很多国家已经被禁止使用[10]。尼鲁米特与氟他胺结构相似,1987年在法国上市,目前常与手术或化学去势联合使用。在已经接受去势治疗的前列腺癌患者中联合使用尼鲁米特常出现客观响应率提高、骨骼疼痛和尿频等症状[11]。而长期使用氟他胺或比卡鲁胺则会使患者产生雄激素撤除综合征,这是氟他胺和比卡鲁胺类药物的主要副作用。产生这种综合征的患者在使用雄激素受体拮抗剂时,拮抗剂会产生激动活性[12],前列腺癌发展为去势抵抗性前列腺癌。目前上市的第二代前列腺癌治疗药物恩扎鲁胺是第一个雄激素受体信号传导抑制剂,与传统的雄激素受体治疗药物相比有很好的选择性,并且能避免传统治疗药物在前列腺癌后期所产生的激动活性[13]。作用于雄激素受体配体结合口袋药物的结构见图 1。
 | 图 1 作用于配体结合口袋的药物Fig.1 Drugs targeting ligand-binding pocket |
1.2 作用于AF2的药物
传统的雄激素受体拮抗剂作用于配体结合口袋,但是产生耐药性是传统药物存在的严重问题。为了克服这一问题,设计一种药物作用于配体结合位点上的AF2位点成为一个方向。研究表明,共激活因子在AF2位点上的聚集在受体转录过程中起着关键作用,作用于AF2位点的药物能阻碍雄激素受体与共激活因子蛋白之间的相互作用从而达到治疗
前列腺癌的目的[14]。从目前研究进展来看,与AF2结合的化合物主要是1H-萘嵌间二氮杂苯母核结构。Axerio-Cilies等[15]在Gunther等[16]的工作基础上对400万个可购买的先导化合物进行虚拟筛选和分子对接等操作,得到68个具有潜在活性的化合物。再对这68个化合物进行细胞活性、毒性测定和晶体结构分析后,发现5个具有雄激素受体抑制活性并且选择性地与AF2结合的化合物(1~5)。这5个化合物抑制雄激素受体转录的IC50值的范围在4~36 μmol/L。化合物1~5的结构见图 2。
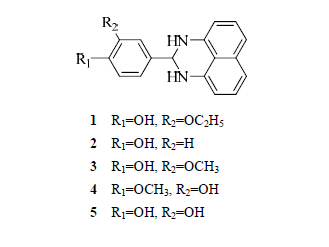 | 图 2 化合物1~5的结构Fig.2 Structures of compounds 1 — 5 |
2 作用于非配体结合位点的药物
2.1 作用于BF3的药物
Gunther等[16]研究发现,在AF2沟槽的附近有一个区域叫第三结合功能区BF3。这个功能区能够影响AF2位点的功能,并且影响FKPB52蛋白(一种雄激素受体激活因子)与受体之间的相互作用[17]。从目前研究进展来看,与BF3结合的化合物主要是哒嗪酮和1H-苯并咪唑母核结构。Ryu等[18]发现化合物6对人前列腺癌细胞LNCap的生存能力具有抑制活性,IC50值为39 μmol/L(同等条件下比卡鲁胺的IC50值为23 μmol/L)。Ryu等对化合物6与雄激素受体对接的结构进行分析,发现其与雄激素受体的BF3区域结合。Ryu等对化合物6进行结构改造,合成了一系列哒嗪酮类化合物7~10,其中化合物7的抑制活性最好(IC50值为11 μmol/L)。这一系列化合物与BF3结合的同时并不影响内源性雄激素与雄激素受体的结合,并且具有很好的代谢活性。化合物6~10的结构见图 3。
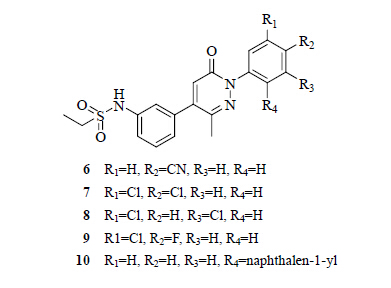 | 图 3 化合物6~10的结构Fig.3 Structures of compounds 6 — 10 |
Munuganti等[19]通过大量的虚拟筛选发现了一些作用于BF3位点并对雄激素受体有抑制作用的化学结构。他们选择了化合物11作为先导化合物进行结构改造与修饰,从而研究母核类型、苯并咪唑环氮上取代基、连接部位类型以及苯环上邻、间、对位上的取代基对雄激素受体转录活性的影响。化合物12是合成的化合物中最有潜力的BF3抑制剂[20],它能明显地降低LNCap细胞中前列腺特异性抗原(PSA)的水平,IC50值为0.21 μmol/L。前列腺癌细胞系MR49F是一种对恩扎鲁胺耐药的细胞系,因此恩扎鲁胺对这种细胞系中的前列腺癌细胞没有抑制作用。而化合物12能明显地降低MR49F细胞中PSA的表达,IC50值为6.02 μmol/L。除此之外,化合物12对LNCap细胞和MR49F细胞的生长都有明显地抑制作用,IC50值分别为0.71、2.01 μmol/L,这对治疗CRPC等更为凶险的前列腺癌具有重要意义。化合物11、12的结构见图 4。
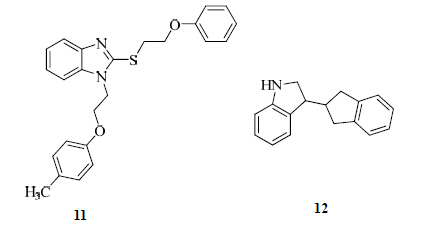 | 图 4 化合物11、12的结构Fig.4 Structures of compounds 11 and 12 |
2.2 作用于AF1的药物
氮端的AF1与雄激素受体的转录活性密切相关,小分子抑制剂作用于氮端活性功能区能够抑制雄激素受体的活性(与配体无关)[21]。从目前研究进展来看,与AF1结合的化合物主要是联苯母核结构。Andersen等[22]设计并合成了化合物EPI-001,它作用于雄激素受体的氮端AF1区域,阻碍了NTD在受体转录中作用的发挥。它抑制了雄激素受体的蛋白-蛋白相互作用和雄激素受体与目标基因上雄激素响应原件之间的相互作用。更为重要的是,EPI-001阻断了雄激素诱发的细胞增值、抑制了CRPC移植瘤的生长,在治疗浓度范围没有引起明显的毒性。化合物EPI-001的结构见图 5。
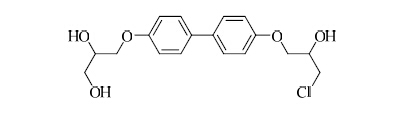 | 图 5 化合物EPI-001的结构Fig.5 Structure of compound EPI-001 |
2.3 作用于DBD的药物
前列腺癌患者对传统的治疗前列腺癌的药物产生耐药性的原因之一是雄激素受体在与药物作用之后产生突变,雄激素受体变成了LBD位点缺失的雄激素受体剪接变异体(ARVs)[23]。不论是全长的雄激素受体还是雄激素受体剪接变异体调节基因转录都要通过受体的DBD与DNA结合[24]。因此,以受体的DBD作为目标位点设计药物,使得药物直接干扰受体与DNA之间的相互作用,是克服传统拮抗剂产生耐药性的有效方法。从目前研究进展来看,与DBD结合的化合物主要是4-噻唑-2-基吗啉母核结构。Li等[25]通过虚拟筛选的方法发现一类与DBD结合的4-(4-苯基噻唑-2-基)吗啉类化合物(13)。Li等通过结构修饰发现:(1)苯环上的结构改变对药物的雄激素受体拮抗活性有着重要影响,当大基团或疏水基团连接在苯环上时,药物的拮抗活性降低甚至消失;(2)噻唑环上有取代基时药物的活性降低;(3)吗啉环能与DBD位点之间形成氢键,如果用其他能与DBD位点之间形成氢键的杂环代替吗啉环,药物的拮抗活性保持。根据上述结论,Li等发现了化合物14,其活性比化合物13提高了两倍,与恩扎鲁胺相比活性基本相当。实验证明化合物14与DBD位点结合,并且对雄激素受体具有选择性,这对治疗因剪接变异体引起的拮抗剂耐受具有重要意义。化合物13、14的结构见图 6。
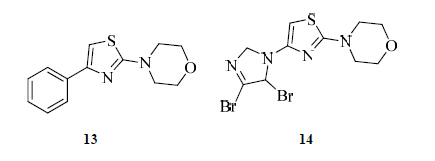 | 图 6 化合物13、14的结构Fig.6 Structures of compounds 13 and 14 |
3 结语
前列腺癌已经成为威胁男性健康的头号杀手之一。已经上市的药物对治疗早期的前列腺癌贡献巨大,但对晚期的、复发的前列腺癌的治疗药物的开发仍需研究者们集中智慧继续努力。近期的研究发现,除雄激素受体配体结合位点外,受体的AF1、AF2、BF3和DBD都是治疗前列腺癌的药物的潜在结合位点,都对开发治疗晚期前列腺癌的药物具有重要意义。相信针对这些结合位点设计的药物将成为治疗前列腺癌的药物中的后起之秀。
| [1] | Siegel R, Naishadham D, Jemal A, et al. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30. |
| [2] | Eder I E, Haag P, Bartsch G, et al. Targeting the androgen receptor in hormone-refractory prostate cancer-new concepts [J]. Future Oncol, 2005, 1(1): 93-101. |
| [3] | Wang Q, Li W, Zhang Y, et al. Androgen receptor regulates a distinct transcription program in androgen-independent prostate cancer [J]. Cell, 2009, 138(2): 245-256. |
| [4] | Rosen J, Day A, Jones T K, et al. Intracellular receptors and signal transducers and activators of transcription factor superfamilies: novel targets for small-molecule drug discovery [J]. J Med Chem, 1995, 38(25): 4855-4874. |
| [5] | Jenster G, van der Korput H A, van Vroonhoven C, et al. Domains of the human androgen receptor involved in steroid binding, transcriptional activation, and subcellular localization [J]. Mol Endocrinol, 1991, 5(10): 1396-1404. |
| [6] | Clegg N J, Wongvipat J, Joseph J D, et al. ARN-509: a novel antiandrogen for prostate cancer treatment [J]. Cancer Res, 2012, 72(6): 1494. |
| [7] | Adamo V, Noto L, Franchina T, et al. Emerging targeted therapies for castration-resistant prostate cancer [J]. Front Endocrinol (Lausanne), 2012, 3: 73. |
| [8] | 王 峰, 方 浩. 非甾体类雄激素受体拮抗剂的研究进展 [J]. 现代药物与临床, 2012, 27(2): 88-93. |
| [9] | Morris J J, Hughes L R, Glen A T, et al. Non-steroidal antiandrogens. Design of novel compounds based on an infrared study of the dominant conformation and hydrogen-bonding properties of a series of anilide antiandrogens [J]. J Med Chem, 1991, 34(1): 447-455. |
| [10] | Furr B J, Tucker H. The preclinical development of bicalutamide: pharmacodynamics and mechanism of action [J]. Urology, 1996, 47(1A Suppl): 13-25. |
| [11] | Harris M G, Coleman S G, Faulds D, et al. Nilutamide. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in prostate cancer [J]. Drugs Aging, 1993, 3(1): 9-25. |
| [12] | Kelly W K,Scher H I. Prostate specific antigen decline after antiandrogen withdrawal: the flutamide withdrawal syndrome [J]. J Urol, 1993, 149(3): 607-609. |
| [13] | Korpal M, Korn J M, Gao X, et al. An F876L mutation in androgen receptor confers genetic and phenotypic resistance to MDV3100 (enzalutamide) [J]. Cancer Discov, 2013, 3(9): 1030-1043. |
| [14] | Chen Y, Sawyers C L, Scher H I, et al. Targeting the androgen receptor pathway in prostate cancer [J]. Curr Opin Pharmacol, 2008, 8(4): 440-448. |
| [15] | Axerio-Cilies P, Lack N A, Nayana M R, et al. Inhibitors of androgen receptor activation function-2 (AF2) site identified through virtual screening [J]. J Med Chem, 2011, 54(18): 6197-6205. |
| [16] | Gunther J R, Parent A A, Katzenellenbogen J A. Alternative inhibition of androgen receptor signaling: peptidomimetic pyrimidines as direct androgen receptor/coactivator disruptors [J]. ACS Chem Biol, 2009, 4(6): 435-440. |
| [17] | De Leon J T, Iwai A, Feau C, et al. Targeting the regulation of androgen receptor signaling by the heat shock protein 90 cochaperone FKBP52 in prostate cancer cells [J]. Proc Natl Acad Sci, 2011, 108(29): 11878-11883. |
| [18] | Ryu B J, Kim N, Kim J T, et al. Discovery of non-LBD inhibitor for androgen receptor by structure-guide design [J]. Bioorg Med Chem Lett, 2013, 23(13): 3887-3890. |
| [19] | Munuganti R S, Hassona M D, Leblanc E, et al. Identification of a potent antiandrogen that targets the BF3 site of the androgen receptor and inhibits enzalutamide-resistant prostate cancer [J]. Chem Biol, 2014, 21(11): 1476-1485. |
| [20] | Lack N A, Axerio-Cilies P, Tavassoli P, et al. Targeting the binding function 3 (BF3) site of the human androgen receptor through virtual screening [J]. J Med Chem, 2011, 54(24): 8563-8573. |
| [21] | Sadar M D. Small molecule inhibitors targeting the "achilles' heel" of androgen receptor activity [J]. Cancer Res, 2011, 71(4): 1208-1213. |
| [22] | Andersen R J, Mawji N R, Wang J, et al. Regression of castrate-recurrent prostate cancer by a small-molecule inhibitor of the amino-terminus domain of the androgen receptor [J]. Cancer Cell, 2010, 17(6): 535-546. |
| [23] | Hu R, Lu C, Mostaghel E A, et al. Distinct transcriptional programs mediated by the ligand-dependent full-length androgen receptor and its splice variants in castration-resistant prostate cancer [J]. Cancer Res, 2012, 72(14): 3457-3462. |
| [24] | van Royen M E, van Cappellen W A, de Vos C, et al. Stepwise androgen receptor dimerization [J]. J Cell Sci, 2012, 125(Pt 8): 1970-1979. |
| [25] | Li H, Ban F, Dalal K, et al. Discovery of small-molecule inhibitors selectively targeting the DNA-binding domain of the human androgen receptor [J]. J Med Chem, 2014, 57(15): 6458-6467. |
 2015, Vol. 30
2015, Vol. 30


