2. 天津市医药科学研究所, 天津 300020
2. Tianjin Institute of Medical Pharmaceutical Science, Tianjin 300020, China
真菌性角膜炎是一种高致盲性眼病,临床表现不典型,潜伏期长,难以及时明确诊断,严重者甚至可能导致角膜穿孔或眼球萎缩、丧失[1]。目前临床上使用的抗真菌滴眼液穿透性差、生物利用度低,导致治疗效果差[2]。由于血-视网膜屏障的阻碍,口服或静脉注射药物有效浓度亦难达到,此外还可能引起全身毒副作用。第二代三唑类抗真菌药伏立康唑的问世为眼科真菌感染性疾病的治疗提供了有力的武器[3]。伏立康唑抗菌谱广,生物利用度高,具有良好的眼部穿透性[4, 5, 6],对于对氟康唑、伊曲康唑耐药的感染也有显著效果[7],且毒性低[8]。现已证实,伏立康唑通过全身及局部多种途径给药,对于常规治疗无效的真菌性角膜炎取得了良好的效果[4]。结膜下注射作为眼科常用的治疗方法之一,操作相对简单,既能使药物快速准确地作用于眼部,又能避免了全身用药的缺点。因此,本实验旨在评估结膜下注射伏立康唑的安全性,并探讨伏立康唑不同给药浓度对兔眼角膜的影响,为伏立康唑治疗真菌性角膜炎的新的给药途径及给予合理的给药剂量提供依据。
1 材料 1.1 动物
新西兰大白兔25只,由天津市医药科学研究所提供,许可证号SCXK(京)2009-0005,体质量1.5~2.0 kg,雌雄不限。实验前行常规眼科检查排除眼部疾患。
1.2 药品
注射用伏立康唑(丽珠集团丽珠制药厂,批号130906,规格0.1 g/瓶),戊巴比妥钠(美国 Sigma 公司,批号127K1005,规格:25 g/瓶),0.5%盐酸丙美卡因(美国 ALCON生产,批号14C21F,规格15 mL∶75mg),0.9%氯化钠注射液(中国大冢制药有限公司,批号3E81D2,规格10 mL∶0.09 g),安尔碘消毒剂(上海利康消毒高科技有限公司,批号20141202,规格60 mL/瓶)。
1.3 仪器
BX-900裂隙灯(眼前节数字照相系统,瑞士Hagg Streit公司),HRT-3活体激光共聚焦显微镜(HeidelbergEngineering公司),Olympus BX50研究型光学显微镜(日本Olympus公司)。
2 方法 2.1 分组与给药健康成年新西兰白兔25只,按体质量随机分为对照组、伏立康唑(50、100、200、400μg)组。每只兔选取一侧眼作为实验眼。兔眼以0.5%盐酸丙美卡因滴眼液表面麻醉后,常规安尔碘眼周消毒,剪除眼周毛发及睫毛,无菌贴膜覆盖术眼,开睑器撑开眼睑,颞上方进行结膜下注射。对照组结膜下注射0.1 mL生理盐水,伏立康唑组均结膜下注射0.1 mL伏立康唑注射液,分别含50、100、200、400μg注射用伏立康唑。1次/d,连续给药5 d。
2.2 一般观察给药前及末次给药后的第1、7、14天,安抚动物,用裂隙灯和直接眼底镜观察检查角膜透明性、角膜新生血管生长情况,晶状体是否透明,玻璃体有无浑浊、出血,视网膜有无水肿、出血、脱离,视网膜血管有无闭塞、迂曲、扩张。2%的荧光素染色评估角膜上皮完整性。
2.3 活体共聚焦显微镜观察新西兰兔经耳缘静脉注射3%戊巴比妥钠(30 mg/kg)全身麻醉后,行共聚焦显微镜检查,分别于末次给药后第1、7、14天观察角膜各层细胞的变化,计数角膜内皮细胞的数量,并测量角膜的厚度。
2.4 病理组织学观察各组于末次给药后第14天随机取2只兔,摘取实验眼眼球,浸入10%的酸性福尔马林液中固定,48 h后常规脱水,之后取出眼球进行取材,沿矢状位方向将眼球剖位为3 个部分,取中间部分进一步脱水、透明、浸蜡后,石蜡包埋,制成石蜡切片,HE染色,观察角膜组织形态。
2.5 统计学处理应用SPSS l5.0统计软件进行统计学分析,采用单因素方差分析,LSD-t检验进行组间多重比较。
3 结果 3.1 一般观察(裂隙灯检查、直接检眼镜检查)
给药前各组兔眼经裂隙灯检查结膜无充血、水肿及出血,晶状体透明,角膜、巩膜和虹膜未见异常。角膜荧光素无着色。直接检眼镜检查玻璃体透明、眼底血管清晰、眼底无出血。整个实验过程中无实验眼出现角膜新生血管或感染征象。对照组各个时间段角膜均未出现水肿及出血,晶状体无浑浊,玻璃体无浑浊、出血,荧光素无着色。伏立康唑200 μg组在末次给药后第1天可见结膜轻度充血,观察24 h后消退;伏立康唑400 μg组在末次给药后第1天出现轻微的角膜水肿并于24 h后消退,角膜恢复透明,在给药后7 d,角膜上皮可见局限性荧光素着色,给药后14d,染色面积增大。直接检眼镜检查各给药组实验眼均玻璃体透明,视网膜无水肿,出血,脱离,眼底血管清晰,眼底无出血。
3.2 活体共聚焦显微镜观察 3.2.1 角膜上皮的改变各个时间段对照组兔角膜上皮细胞呈多角性,大小形状不一,细胞排列规则,边界清楚。给药后1 d,伏立康唑各组角膜上皮细胞形态规则,排列紧密,细胞边界清楚。给药后7 d,观察到伏立康唑400 μg组上皮细胞轮廓模糊,边界不清,细胞边界反光增强。给药后14 d,伏立康唑200 μg组角膜上皮细胞失去正常形态,细胞边界不清,上皮细胞肿胀,细胞中央表现为黑色低反光;伏立康唑400 μg组角膜上皮细胞形态不规则,角膜上皮细胞呈片状脱落,脱落区域呈黑色低反光。见图 1。
3.2.2 角膜基质的改变各个时间段对照组兔角膜基质细胞核呈纺锤状或椭圆形高反光,轮廓清晰,胞体反光弱,基质纤维透光性好。给药后1 d,伏立康唑各组基质细胞形态为纺锤状或椭圆形,轮廓清晰。给药后7 d,伏立康唑200、400 μg组基质细胞轮廓模糊,角膜基质出现宽窄不一黑色低反光带,与正常基质纤维共同形成深浅不同的皱折,同时观察到基质细胞核轮廓不清楚,细胞核缩小;给药后14 d,伏立康唑200、400μg组角膜基质黑色反光带增宽,与基质纤维间的皱折明显,基质细胞核缩小明显,形态不规则,轮廓模糊。见图 2。
3.2.3 角膜内皮的改变通过共聚焦显微镜观察到各个时间段对照组内皮细胞为排列规则的多边形细胞,大小一致,边界低反光,细胞质高反光,细胞排列紧密。给药后7 d,伏立康唑200、400μg组多形性细胞的形态不规则,细胞边界清楚。给药后14 d,观察到伏立康唑200 μg组角膜内皮细胞肿胀,增大,部分内皮细胞大小不一,形态不规则,伏立康唑400 μg组内皮细胞形态异常,边界模糊。见图 3。
3.2.4 基质神经的改变各个时间段对照组角膜基质下可见大量基质神经纤维,神经纤维分枝富,分枝彼此连接。给药后7 d,伏立康唑400 μg组前基质纤维神经断裂,粗细不均。给药后14 d,伏立康唑200 μg组角膜基质神经断裂且明显增粗,伏立康唑400 μg组角膜基质可见粗大的角膜基质神经纤维中部有高反光线性条索。见图 4。
 | 图 1 共聚焦显微镜下角膜上皮的改变Fig.1Changes of corneal epithelial cells observed by confocal microscopy |
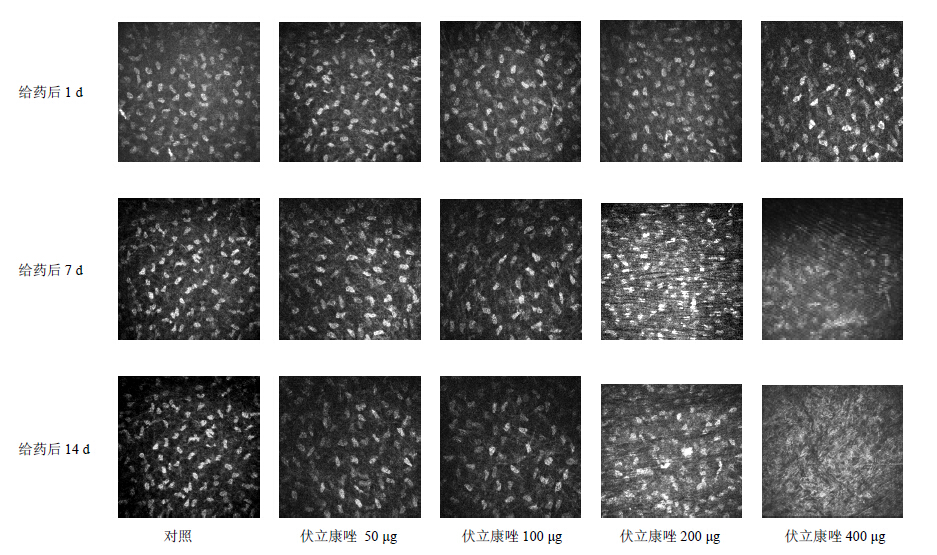 | 图 2 共聚焦显微镜下角膜基质的改变Fig.2Changes of corneal stromal cells observed by confocal microscopy |
 | 图 3 共聚焦显微镜下角膜内皮的改变Fig.3Changes of corneal endothelial cell observed by confocal microscopy |
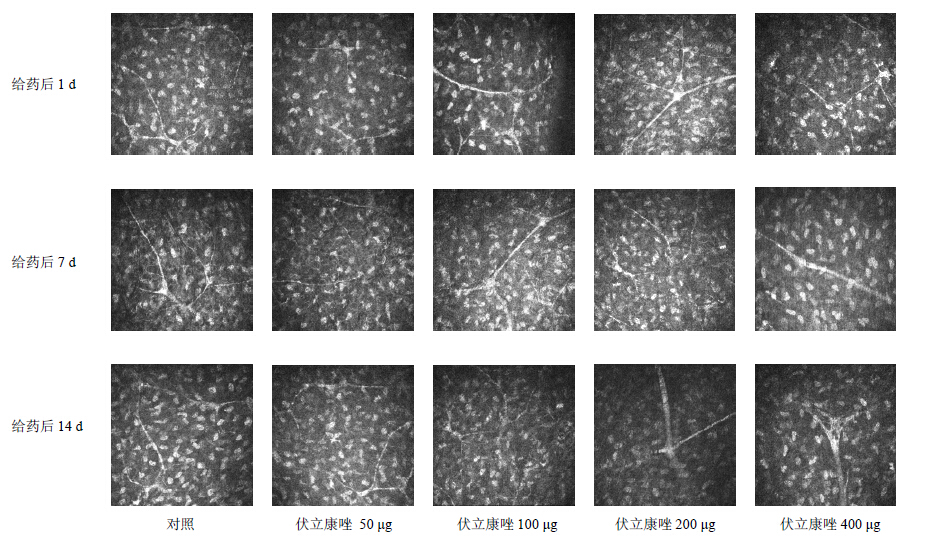 | 图 4 共聚焦显微镜下基质神经的改变Fig.4Changes of corneal nerves observed by confocal microscopy |
各时间段各给药组角膜内皮细胞计数与对照组比较,差异均无统计学意义,结果见表 1。
3.2.6 角膜厚度的测量各时间段各给药组角膜厚度与对照组比较,差异均无统计学意义,结果见表 2。
| 表 1 各组角膜内皮细胞计数比较(n =5) Table 1 CComparisonof endothelial cell counts of five groups (n = 5) |
| 表 2 各组角膜厚度比较(n =5) Table 2 Comparison of corneal thickness of five groups (n = 5) |
对照组角膜组织结构完整,各层结构清晰。角膜上皮层为3~4层鳞状上皮细胞组成,排列规则,角膜基质层纤维排列整齐,板层纤维之间有很少量的短梭性角膜细胞,角膜后弹力层清晰可见,与角膜内皮细胞层贴附紧密,角膜内皮细胞层完整,内皮细胞呈单层扁平状,体积较小,无明显水肿。
伏立康唑50、100μg组角膜各层组织结构清楚,角膜上皮层完整,基质层纤维排列规则,后弹力层和内皮细胞层清晰可见。与对照组比较,各层组织形态基本相同,无明显病理学改变。伏立康唑200 μg组角膜上皮层水肿,有些液体聚集在上皮细胞层之间,引起上皮细胞层间分离或上皮间大泡,但角膜上皮层与基质层之间无明显分离;角膜基质层水肿,失去正常角膜板层纤维的规则排列,板层纤维互相融合、结构不清或板层纤维间有明显的裂隙;角膜后弹力层颜色变淡或模糊,角膜内皮细胞体积增大,水肿。伏立康唑400 μg组角膜上皮层水肿,角膜上皮层与角膜基质层分离,可见上皮细胞层之间分离或点灶状上皮缺损;角膜基质层纤维水肿,板层纤维互相融合或其间有较大的裂隙,角膜细胞数量增多、体积增大,角膜后弹力层颜色变淡或模糊,角膜内皮细胞明显水肿,内皮细胞体积增大。
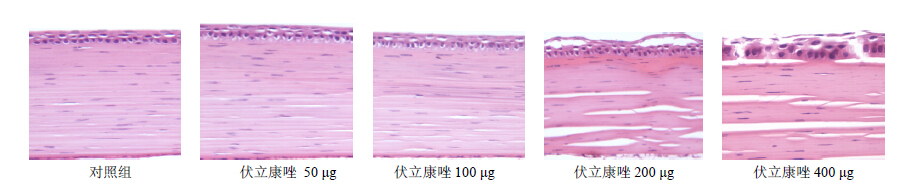 | 图 5 兔角膜组织形态改变(HE 染色)Fig.5Changes of histomorphology of rabbit corneas (HE stain) |
新三唑类抗真菌药物伏立康唑具有良好的抗菌活性[9],局部应用的组织穿透性好[10]。有文献报道,角膜基质内注射伏立康唑0.1mL(500 mg/L)和1%伏立康唑前房内注射0.05 mL(250 mg/L),对治疗深部难治性真菌性角膜炎发挥了较好的效果[11]。Prakash等[5]也报道角膜基质内注射500 mg/L伏立康唑0.05~0.10mL,治疗3例常规治疗无效的顽固性深层真菌性角膜炎,溃疡愈合,病情明显好转。
值得注意的是,角膜基质内注射及前房注射药物,可能会刺穿角膜并导致角膜穿孔、前房炎症反应、眼内炎等并发症,需操作者小心谨慎,注意无菌操作,并在手术显微镜下进行。结膜下注射作为眼科常用的治疗方法之一,它操作相对简单,既能使药物快速准确地作用于眼部,又能避免了全身用药的缺点。鉴于目前尚无结膜下注射伏立康唑的相关研究,本实验参考其他局部给药方案设计4个不同浓度,并按照文献报道结膜下注射最长给药时间,进行伏立康唑兔眼结膜下注射的安全性研究,探讨其对兔眼角膜的影响。
角膜是眼部屈光系统的重要组成部分,在维持眼球完整性、保护眼内容物等方面发挥着重要作用。角膜形态学评价方法多种多样,各有优缺点。本实验采用活体共聚焦显微镜检查和病理组织学检查。
角膜共焦显微镜采用激光对角膜细胞进行无损伤连续断层光学扫描,形成一系列二维图像,可以在活体上清楚观察角膜各层组织,分辨率高达1 μm,甚至达到病理活检水平[12]。它是目前一种新型的可应用于活体检查的光学显微镜,通过角膜各层细胞的形状和大小进行形态学分析,反映角膜各层细胞的功能状态及损害程度。本实验各个时间段对照组兔角膜各层细胞均排列规则,边界清楚,大小均一。上皮细胞呈多角性,角膜基质细胞核呈纺锤状或椭圆形高反光,内皮细胞呈多边形,基质下可见神经纤维分枝丰富。结膜下注射伏立康唑,随着浓度的增加、时间的延长,可见各层细胞形态由规则变为不规则甚至异常,细胞轮廓模糊,排列疏松。基质出现宽窄不一黑色低反光带。内皮细胞肿胀,增大。基质神经纤维分枝连接少见,神经纤维粗细不均,出现断裂。伏立康唑400 μg连续给药后,角膜上皮细胞部分脱落,同时还可见基底细胞层大量活化的郎格汉斯细胞浸润。
利用角膜共聚焦显微镜不但可以清晰观察角膜各层细胞的超微结构,还能为角膜内皮细胞的定性及定量分析提供了一个方便而有效的工具,并且还可以用于角膜厚度的测量。虽然有些研究显示其测量值与测量角膜厚度的“金标准”A 超相比偏小[13],但是该系统误差对各组实验眼的影响是一致的。因此,它虽然可能影响单个角膜厚度的绝对数值,但是对各组之间统计学检验的结果却不会产生影响。本实验中给药后各给药组实验眼与对照组比较,角膜厚度、内皮细胞计数差异均无统计学意义。从此结果也可以看出,虽然定量分析细胞图像所提供的内皮细胞的形态资料可以更准确地描述内皮细胞的群体状态,但是细胞形态的评价描述比细胞密度测量对角膜内皮细胞早期病变更加敏感。同期角膜病理组织学检查也发现角膜上皮细胞水肿,失去正常角膜板层纤维的规则排列,板层纤维互相融合、结构不清或板层纤维间有明显的裂隙,内皮细胞连接疏松,细胞核增大,轻度水肿,与后弹力层连接疏松,提示角膜内皮细胞功能受损。因此,共聚焦显微镜和角膜病理学检查结果表明,剂量≤100 μg的伏立康唑兔眼结膜下注射后角膜组织结构和功能都未见损害。因此从形态学上来说,兔眼结膜下注射≤100μg的伏立康唑对角膜是安全的。
新一代的伏立康唑是适用于眼部抗真菌性疾病的理想药物。该药结膜下注射治疗真菌性角膜炎等疾病具有良好的应用前景,今后有必要对该药的结膜下注射眼内药动学和眼内用药疗效等作进一步研究,为临床应用提供更多的实验依据。
| [1] | Shivaprakash M R, Appannanavar S B, Dhaliwal M, et al. Colletotrichum truncatum: an unusual pathogen causing mycotic keratitis and endophthalmitis [J]. J Clin Microbiol, 2011, 49(8): 2894-2898. |
| [2] | 王淑然, 叶俊杰. 真菌性眼内炎的治疗现状与进展 [J]. 中华眼科杂志,.2012, 48(11): 1041-1044. |
| [3] | 高 燕, 董晓光, 孙士营, 等. 真菌性角膜溃疡继发真菌性眼内炎的治疗 [J]. 中华眼外伤职业眼病杂志, 2013, 35(5): 345-348. |
| [4] | Hariprasad S M, Mieler W F, Lin T K, et al. Voriconazole in the treatment of fungal eye infections: a review of current literature [J]. Br J Ophthalmol, 2008, 92(7): 871-878. |
| [5] | Prakash G, Sharma N, Goel M, et al. Evaluation of intrastromal injection of voriconazole as a therapeutic adjunctive for the management of deep recalcitrant fungal keratitis [J]. Am J Ophthalmol, 2008, 146(1): 56-59. |
| [6] | Al-Badriyeh D, Neoh C F, Stewart K, et al. Clinical utility of voriconazole eye drops in ophthalmic fungal keratitis [J]. Clin Ophthalmol, 2010, 4: 391-405. |
| [7] | Diekema D J, Messer S A, Hollis R J, et al. A global evaluation of voriconazole activity tested against recent clinical isolates of Candida spp. [J]. Diagn Microbiol Infect Dis, 2009, 63(2): 233-236. |
| [8] | 吴玮峰, 张 晔. 抗真菌上市新药及其合成评述 [J]. 中国药师, 2011, 14(8): 1203-1206. |
| [9] | Berbel R F, Casella A M, de Freitas D, et al. Curvularia lunata endophthalmitis [J]. J Ocul Pharmacol Ther, 2011, 27(5): 535-537. |
| [10] | Ramakrishnan T, Constantinou M, Jhanji V, et al. Factors affecting treatment outcomes with voriconazole in cases with fungal keratitis [J]. Cornea, 2013, 32(4): 445-449. |
| [11] | Lin R C, Sanduja N, Hariparad S M. Successful treatment of postoperative fungal endophthalmitis using intravitreal and intracameral voriconazole [J]. J Ocular Pharmacol Ther, 2008, 24(2): 245-248. |
| [12] | Barkana Y, Gerber Y, Elbaz U, et al. Central corneal thickness measurement with the Pentacam Scheimpflug system, optical low-coherence reflectometry pachymeter, and ultrasound pachymetry [J]. J Cataract Refract Surg, 2005, 31(9): 1729-1735. |
| [13] | McLaren J W, Nau C B, Erie J C,. et al. Corneal thickness measurement by confocal microscopy, ultrasound, and scanning slit methods [J]. Am J Ophthalmol, 2004, 137(6): 1011-1020. |
 2015, Vol. 30
2015, Vol. 30


