2. 天津药物研究院 化学制药部, 天津 300193;
3. 哈尔滨工业大学 应用化学系, 黑龙江 哈尔滨 150001
2. Centre for Chemical Pharmaceutical Research, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. Department of Applied Chemistry, Harbin Institute of Technology, Harbin 150001, China
溴甲纳曲酮皮下注射剂是由美国惠氏制药和Progenics Pharmaceuticals公司联合研究开发,于2008年在加拿大、美国和欧盟上市的外周μ阿片受体拮抗剂,可用于接受姑息疗法的晚期重症患者因阿片所致的便秘而使用轻泻药又无效的情况[1]。溴甲纳曲酮在纳曲酮结构上引入甲基形成季铵盐,因此不易透过血脑屏障,避免了阿片类药物作用于中枢神经系统影响止痛效果。另外溴甲纳曲酮还可以阻止阿片类药物进入平滑肌细胞,干扰正常的肠道功能[2, 3, 4]。因此溴甲纳曲酮对于提高晚期患者的生活质量减轻患者病痛具有重要意义。
对溴甲纳曲酮注射液进行破坏性试验发现在光照、过氧化氢及氢氧化钠条件下,溴甲纳曲酮结构被破坏并产生杂质,通过查阅文献推测,在光照及氧化条件下溴甲纳曲酮结构中五元含氧环结构被破坏产生单个羟基及两个羟基的结构并且这两个杂质具有潜在的基因毒性[5]。另外根据溴甲纳曲酮的结构推测在氢氧化钠存在条件下溴甲纳曲酮可能发生了霍夫曼降解,得到13、14位碳原子间含有双键的结构。由于基因毒性杂质对人体伤害巨大,溴甲纳曲酮注射液在生产过程中,注射液的pH值对产生霍夫曼降解产物具有至关重要的作用,因此合成这3个降解产物并确定其结构,对溴甲纳曲酮注射液的储存、运输、保证成品质量具有十分重要的意义。本实验以溴甲纳曲酮为起始原料[6],通过紫外灯照射得到化合物1,过氧叔丁醇的三羟甲基氨基甲烷(TRIS)溶液的氧化得到化合物2,霍夫曼降解得到化合物3,并利用质谱和核磁数据确证了结构。目标化合物1~3的合成路线见图1 。
 | 图1 目标化合物的合成路线 Fig.1 Synthesis route of target compounds |
Agilent 1200高效液相色谱仪;Agilent 6520型Accurate-Mass-Q-TOF/MS质谱仪;Bruker 400 MHz 核磁共振仪(德国Bruker公司);自制溴甲纳曲酮(质量分数>99.0%);三羟甲基氨基甲烷(质量分数>99.5%,天津市光复精细化工研究所);溴离子交换树脂(南开大学化工厂717型阴离子交换树脂,经氢氧化钠水溶液洗涤、水洗至中性;氢溴酸水溶液洗涤、水洗至中性,即得)
2 方法与结果 2.1 化合物1的合成[7]取溴甲纳曲酮2.0 g溶于100mL水中,置于通风橱中,安装500 W紫外灯。打开紫外灯照射48 h。关闭紫外灯,烧杯中溶液体系由无色变为红褐色,HPLC检测显示产生新的物质,且新物质占比为55.28%,继续照射10 h,直至比例不再变化。去除体系,冷冻干燥溶液浓缩至15 mL。通过制备液相色谱分离,分离的物质使用溴离子交换树脂进行离子交换,得到的溶液冷冻干燥得到棕红色固体0.71 g,收率为35.5%,质量分数为99.77%。ESI-MS m/z:356.0。1H-NMR(400MHz,DMSO-d6)δ:0.37(m,1H,CHCH2CH2),0.55(m,1H,CH2CH2CH),0.69(m,1H,CHCH2CH2),0.74(m,1H,CH2CH2CH),1.31(m,1H,CH2CHCH2),1.73(d,J=12.8 Hz,1H,CCH2CH2),1.88(m,2H,OHCCH2CH2),1.98(m,1H,COCH2),2.42(t,J=12.4 Hz,1H,CCH2CH2),2.59(d,J=14.0 Hz,1H,CCH2CO),2.61(m,1H,COCH2CH2),2.84(dd,J=13.2 Hz,1H,NCH2CH),3.01(m,1H,NCH2CH2),3.27(m,1H,NCH2CH2),3.46(dd,J=13.2 Hz,1H,NCH2CH),3.57(d,J=14.0 Hz,1H,CCH2CO),3.58(s,3H,NCH3),4.43(d,J=6.8 Hz,1H,CCHN),6.41(s,1H,OH-14),6.48(d,J=9.6 Hz,1H,CHCO),6.71(d,J=6.8 Hz,1H,CHCHN),7.40(d,J=9.6 Hz,1H,C=CHCH),10.06(s,1H,OH-4)。
2.2 化合物2的合成[8]精密配制pH 8.0(使用0.1 mol/L稀盐酸调节)的三羟甲基氨基甲烷溶液100 mL,静置备用。取上述三羟甲基氨基甲烷溶液25 mL加入到三口瓶中,加入2.0 g溴甲纳曲酮,搅拌溶解,加入70%过氧叔丁醇6.4mL,室温反应,体系由无色逐渐变浅黄色再变为红褐色。反应69 h后HPLC检测显示反应体系中含有新化合物89.29%,继续反应5 h,反应体系各物质浓度不再变化。停止反应,慢慢加入三氟乙酸0.1mL(注射器加入),体系用100、80 mL二氯甲烷洗涤两次。冷冻干燥至10 mL,使用高压制备柱分离,分离的物质使用溴离子交换树脂进行离子交换,得到的溶液冷冻干燥得到棕红色固体0.52 g,收率为25.1%,质量分数为94.18%。ESI-MS m/z:356.0。1H-NMR(400MHz,DMSO-d6)δ:0.41(m,1H,CHCH2CH2),0.55(m,1H,CH2CH2CH),0.71(m,2H,CHCH2CH2),0.76(m,1H,CH2CH2CH),1.34(m,1H,CH2CHCH2),1.95(m,3H,CH2CH2COH,NCH2CH2),2.14(m,1H,COCH2),2.44(m,1H,NCH2CH2),2.67(m,1H,COCH2),2.85(dd,J=13.2 Hz,1H,NCH2CH),3.01(m,1H,NCH2CH2),3.27(m,1H,NCH2CH2),3.50(dd,J=13.2 Hz,1H,NCH2CH),3.73(s,3H,NCH3),4.39(d,J=6.8 Hz,1H,NCH),5.03(s,1H,CCHOHNCO),6.34(d,J=9.6 Hz,1H,CH=CHCO),6.54(d,J=7.2 Hz,1H,CCHC),6.68(s,1H,OH-14),7.30(d,J=9.6 Hz,1H,CH=CHCO)。
2.3 化合物3的合成[9]取溴甲纳曲酮2.0 g,加入到三口瓶中,取0.5 mol/L氢氧化钠溶液100 mL加入到三口瓶,室温下搅拌,通氮气5 min,加入已预热到80 ℃的油浴锅中,反应9 h。冷却,低温下用1 mol/L盐酸溶液调节pH值至7.0,加入二氯甲烷(50 mL×3)提取,饱和氯化钠水溶液洗涤,无水硫酸镁干燥,蒸干,柱色谱分离,二氯甲烷-甲醇(20∶1)洗脱,得到白色固体0.8 g,收率为40.0%,质量分数为99.51%。1H-NMR(400 MHz,DMSO-d6)δ:0.13(t,J=7.2 Hz,2H,CHCH2CH2),0.52(d,J=8.0 Hz,2H,CH2CH2CH),0.87(m,1H,CH2CHCH2),1.62(t,J=15.4 Hz,1H,CH2CH2COH),1.93(m,1H,NCH2CH2),1.97(m,1H,NCH2CH2),2.06(d,J=14.0 Hz,1H,NCH2CH),2.16(d,J=13.6 Hz,1H,NCH2CH),2.32(m,1H,COCH2),2.39(m,4H,COCH2,NCH3),2.46(m,1H,NCH2CH2),2.54(m,1H,NCH2CH2),2.95(t,J=16.0 Hz,1H,COCH2CH2),4.90(s,1H,COCH),5.26(s,1H,OH-14),5.69(d,J=9.2Hz,1H,COHCH=),6.26(d,J=9.2Hz,1H,=CHCH=),6.54(d,J=8.0 Hz,1H,CHCHCOH),6.67(d,J=8.0 Hz,1H,CHCHCOH),7.79(s,1H,OH-3)。13C-NMR(100 MHz,DMSO-d6)δ:3.81,4.19,7.84,32.33,34.10,34.92,41.13,52.40,56.39,61.69,73.93,91.42,117.60,118.92,121.59,123.55,129.45,137.49,141.73,143.78,209.43。
2.4 HPLC色谱条件色谱条件:BostonBreeze AQ C18色谱柱(250 mm×4.6mm,5 μm);流动相:0.1%三氟乙酸(A)-甲醇(B),梯度洗脱,0~10 min,85% A,10~35min,85% A→60% A,35~45 min,60% A→85% A,45~55min,85% A;柱温:40 ℃;体积流量:1.0 mL/min;检测波长:280 nm。
在上述液相色谱条件下,溴甲纳曲酮和化合物1、2、3的保留时间分别为17.429、8.39、14.724、35.67 min,本试验对破坏后的样品及合成的降解杂质在同样条件下进行了液相色谱测试,通过对光降解、氧化降解及碱破坏后杂质峰的相对保留时间的对比认为破坏后样品中出现的杂质峰与合成的杂质的相对保留时间分别一致,因此可以证明合成的杂质即为破坏后产生的杂质。见图2。
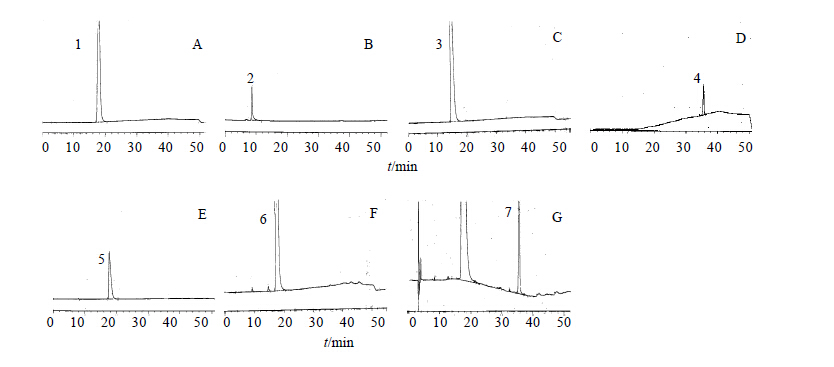 | 1-溴甲纳曲酮2, 5-化合物1 3, 6-化合物2 4, 7-化合物3 1- methylnaltrexone bromide 2, 5-compound 1 3,6-compound 2 4, 7-compound 3图 2 溴甲纳曲酮(A)、化合物1(B)、化合物2(C)、化合物3(D)、光照(E)、氧化(F)、碱破坏(G)溴甲纳曲酮的HPLC 色谱图Fig.2 HPLC chromatograms of methylnaltrexone bromide (A), compound 1 (B), compound 2 (C), compound 3 (D),methylnaltrexone bromide under light (E), oxidation (F), and alkaline (G) conditions |
对溴甲纳曲酮进行光照、氧化剂氧化、碱破坏后发现溴甲纳曲酮样品中均出现了较大的杂质,通过查阅文献,确认光照及氧化后的杂质具有潜在的基因毒性,碱性条件下产生的杂质未见报道。文献中对光照产物及氧化产物的合成或分离方法报道的过程较为复杂,本论文在文献的基础上对光照及氧化杂质的制备、合成及分离方法进行了改进,提高了收率,优化了分离方法,使分离方法更简单,产品纯度更高。另外本研究还对文献未报道的碱性降解杂质进行了合成及结构确认,确认了溴甲纳曲酮注射液在碱性条件下破坏产生的杂质即为化合物3。
| [1] | U.S. FDA approves relistor for opioid-induced constipation| Drug will help reduce effects of drugs like morphine on bowel function [EB/OL]. (2008-04-24). http://www.fda. gov/ewsEvents/newsroom/PressAnnouncements/2008/ucm 116885.htm. |
| [2] | Liu Z, Tang L, Zou P, et al. Synthesis and biological evaluation of allylated and prenylated mono-carbonyl analogs of curcumin as anti-inflammatory agents [J]. Eur J Med Chem, 2014, 74: 671-682. |
| [3] | Finlay B B, McFadden G. Anti-immunology: evasion of the host immune system by bacterial and viral pathogens [J]. Cell, 2006, 124(4): 767-782. |
| [4] | Chen T Y, Rosow C E, Serradel N, et al. Methylnaltrexone bromide: opioid receptor antagonist treatment of constipation treatment of postoperative ileus [J]. Drug future, 2007, 32(9): 771-775. |
| [5] | 赛诺菲–安万特. 制备N-烷基纳曲酮卤化物的方法 [P]. 中国: 102225939A, 2009-08-26. |
| [6] | Peter W X, Cantrell G L, Halvachs R E, et al. Halvach process for the preparation of quaternary n-alkyl morphinan alkaloid salts [P]. WO: 2004043964, 2014-03-11. |
| [7] | Nataliya B, Donato G J, Fabian S R, et al. Peripheral opioid receptor antagonists and uses thereof [P]. WO: 20102676881, 2013-04-16. |
| [8] | Hudlicky T, Carroll R, Leisch H, et al. Processes for the preparation of morphinane and morphinone compounds [P]. WO: 2010121369, 2010-10-28. |
| [9] | 杨琼瑶, 李 赟. 溴甲纳曲酮有关物质的HPLC-MS分析[J]. 药学与临床研究, 2011, 19(4): 373-376. |
 2015, Vol. 30
2015, Vol. 30


