刘继馨, 王秀丽, 袁瑞娟, 彭琛, 徐焕焕. 不同冻干保护剂对利巴韦林冻干粉针的影响研究[J]. 现代药物与临床, 2015, 30(7): 784-789.

LIU Ji-xin, WANG Xiu-li, YUAN Rui-juan, PENG Jason, Xu Huan-huan. Effects of freeze-drying powder protective agents on Ribavirin Freeze-dried Powder[J]. DRUGS&CLINIC, 2015, 30(7): 784-789.

不同冻干保护剂对利巴韦林冻干粉针的影响研究
刘继馨1,
王秀丽1

,
袁瑞娟1,
彭琛2,
徐焕焕1
1. 北京中医药大学 中药学院, 北京 100102;
2. 默克化工技术(上海)有限公司, 上海 201203
收稿日期: 2015-02-26;
作者简介:刘继馨,女,北京中医药大学中药学院本科生.
通讯作者:王秀丽(1978-),女,博士,副研究员,从事药物制剂研究.Tel:(010)84738657,E-mail:lnwangxiuli@163.com
摘要:目的 研究Emprove 低内毒素蔗糖、无水乳糖、Emprove 低内毒素葡萄糖、Emprove 低内毒素甘露醇、Emprove低内毒素山梨醇、Emprove 低内毒素氯化钾、Emprove 低内毒素甘氨酸7 种不同类型常用冻干保护剂对利巴韦林冻干粉针性能的影响.方法 以外观和复溶效果为指标,考察了预冻时间、冻干保护剂用量、冻干时间的影响.测定了空白粉针剂和利巴韦林粉针剂冻干后含水量、pH 值和利巴韦林质量分数.结果 以无水乳糖为冻干保护剂,预冻时间6 h,冻干时间9 h,保护剂用量4%;以Emprove 低内毒素氯化钾为冻干保护剂,预冻时间9 h,冻干时间9 h,保护剂用量4%;以Emprove 低内毒素甘露醇为冻干保护剂,预冻时间6 h,冻干时间6 h,保护剂用量4%;以Emprove 低内毒素甘氨酸为冻干保护剂,预冻时间12 h,冻干时间9 h,保护剂用量4%.所得冻干粉针外观饱满、平整,迅速、完全复溶.结论 无水乳糖、Emprove低内毒素氯化钾、Emprove 低内毒素甘露醇、Emprove 低内毒素甘氨酸4 种冻干保护剂更适合制备利巴韦林冻干粉针,可为水溶性药物冻干粉针剂的制备提供了参考.
关键词:
利巴韦林冻干粉针
冻干保护剂
无水乳糖
Emprove 低内毒素氯化钾
Emprove 低内毒素甘露醇
Emprove 低内毒素甘氨酸
冷冻干燥
Effects of freeze-drying powder protective agents on Ribavirin Freeze-dried Powder
LIU Ji-xin1,
WANG Xiu-li1

,
YUAN Rui-juan1,
PENG Jason2,
Xu Huan-huan1
1. School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 100102, China;
2. Merck Chemicals (Shanghai) Co., Ltd., Shanghai 201203, China
Abstract: Objective To study the effects of seven types of common freeze-drying powder protective agents (Emprove low endotoxin sucrose, lactose, Emprove low endotoxin glucose, Emprove low endotoxin mannitol, Emprove low endotoxin sorbitol, Emprove low endotoxin potassium chloride, and Emprove low endotoxin glycine) on properties of Ribavirin Freeze-dried Powder. Methods Appearance and re-dissolving performance of Ribavirin Freeze-dried Powder and its blank were as indexes, and time of pre-freezing, dosage of freeze-drying powder protective agents, and time of freeze-drying were studied, as well as moisture content, pH value, and ribavirincontent were determined. Results Lactose was used as freeze-drying powder protective agent with time of pre-freezing as 6 h, time of freeze-drying as 9 h, and dosage of freeze-drying powder protective agents as 4%; Emprove low endotoxin potassium chloride was used as freeze-drying powder protective agent with time of pre-freezing as 9 h, time of freeze-drying as 9 h, and dosage of freeze-drying powder protective agent as 4%; Emprove low endotoxin mannitol was used as freeze-drying powder protective agent with time of pre-freezing as 6 h, time of freeze-drying as 6 h, and dosage of freeze-drying powder protective agent as 4%; Emprove low endotoxin glycine was used as l freeze-drying powder protective agents with time of pre-freezing as 12 h, time of freeze-drying as 9 h, and dosage of freeze-drying powder protective agent as 4%. The products were full, smooth, and with complete re-dissolving performance. Conclusion Lactose, Emprove low endotoxin potassium chloride, Emprove low endotoxin mannitol, and Emprove low endotoxin glycine are suitable for preparations of Ribavirin Freeze-dried Powder, which can provide references on freeze-drying preparation of soluble drugs.
Key words:
Ribavirin Freeze-dried Powder
freeze-drying powder protective agent
lactose
Emprove low endotoxin potassium chloride
Emprove low endotoxin mannitol
Emprove low endotoxin glycine
freeze-drying
在制备冻干粉针剂的过程中,为了保护药品的活性,获得均匀、一致、表面光滑、稳定的产品,必须加入起到填充、赋形、稳定作用的保护剂,很多糖类或多元醇经常被用于溶液冻融和冻干过程中的稳定剂。常用的保护剂有糖类(如葡萄糖、乳糖等)、多元醇(如甘露醇、山梨醇等)、氨基酸类(如甘氨酸、谷氨酸等)、无机盐类(如氯化钠、氯化钾、氯化钙等)和大分子类(如明胶等)。它们既是有效的低温保护剂,又是很好的冻干保护剂,它们对冻结的影响取决于种类和浓度。但在实际应用中,因没有依据而广泛尝试大量保护剂种类,并通过大量实验摸索确定保护剂品种的冻干参数是对资源、时间的浪费。本实验以利巴韦林为模型药物,同时辅以空白组作为对比,研究蔗糖、无水乳糖、葡萄糖、甘露醇、山梨醇、氯化钾、甘氨酸7种不同类型常用冻干保护剂的预冻时间、用量、冻干时间等冻干参数,并比较其冻干后的外观和复溶效果、含水量、pH值、主药含量变化等相关性能,以期对冻干剂制备时保护剂的选择提供依据。
1 材料
BX51TRF型显微镜(奥林巴斯株式会社);BSl10S型万分之一电子分析天平、P8-10型pH酸度计(北京赛多利斯仪器系统有限公司);DW- 86L626型超低温保存箱(青岛海尔特种电器有限公司);LGJ-12型冷冻干燥机(北京松源华兴科技发展有限公司);FD-1C-50冷冻干燥机(北京博医康实验仪器有限公司);Lyo-0.4型真空冷冻干燥机(上海东富龙科技有限公司);HCT型微机差热天平(北京恒久科学仪器厂);Waters超高效液相色谱仪:二元溶剂管理系统、在线脱气机、自动进样器、PDA检测器(美国Waters公司)。
利巴韦林由生工生物工程(上海)股份有限公司提供。Emprove低内毒素蔗糖(批号K43921892)、Emprove低内毒素甘露醇(批号M759903247)、Emprove低内毒素甘氨酸(批号VP559490329)、Emprove低内毒素山梨醇(批号M630297337)、Emprove低内毒素氯化钾(批号A0519420)、Emprove低内毒素葡萄糖(批号K45447546413)均由默克化工技术(上海)有限公司提供;无水乳糖(上海昌为医药辅料技术有限公司,批号1320012820)。
2 方法与结果
2.1 冻干粉针的制备
2.1.1 利巴韦林冻干粉针的制备
按照处方量精密称取利巴韦林250 mg以及适量冻干保护剂,用注射用水溶解,定容至10 mL,以0.45µm微孔滤膜滤过,分装于5 mL西林瓶,1 mL/瓶,25 mg/mL。−80 ℃低温预冻后放入冻干机中干燥。
2.1.2 空白冻干粉针的制备
按照处方量精密称取适量冻干保护剂,用注射用水溶解,定容至10 mL,以0.45 µm微孔滤膜滤过,分装于5 mL西林瓶,1 mL/瓶,25 mg/mL。−80 ℃低温预冻后放入冻干机中干燥。
2.1.3 冻干粉针的外观和复溶效果
取利巴韦林冻干粉针和空白冻干粉针,冻干保护剂用量为10%,预冻15 h,冻干15 h,初步比较不同冻干保护剂的冻干效果。Emprove低内毒素葡萄糖、山梨醇冻干失败,原辅料损失;Emprove低内毒素蔗糖和无水乳糖冻干后外观和复溶均良好,但放置后逐渐塌陷;Emprove低内毒素甘露醇、甘氨酸、氯化钾冻干粉针的外观饱满平整、复溶迅速完全。结果见表 1。
表 1(Table 1)

表 1 不同种类冻干保护剂制备的冻干粉针的外观和复溶效果
Table 1 Appearance and dissolving ability of powder injections using different freeze-drying powder protective agents
| 冻干保护剂 | 利巴韦林冻干粉针 | 空白冻干粉针 | | 外观 | 复溶 | 外观 | 复溶 | | Emprove低内毒素蔗糖 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | 无水乳糖 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素葡萄糖 | 全部损失 | | 全部损失 | | | Emprove低内毒素山梨醇 | 全部损失 | | 全部损失 | | | Emprove低内毒素甘露醇 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素甘氨酸 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素氯化钾 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 |
|
表 1 不同种类冻干保护剂制备的冻干粉针的外观和复溶效果
Table 1 Appearance and dissolving ability of powder injections using different freeze-drying powder protective agents |
2.2 预冻时间的考察
取利巴韦林冻干粉针和空白冻干粉针,冻干保护剂用量为10%,冻干15 h,考察不同冻干保护剂的适用的最短预冻时间。鉴于2.1.3的结果,冻干失败的原因有可能与预冻不完全有关,故不同的冻干保护剂选择了不同的预冻时间水平进行考察,结果见表 2。依据降低能耗、节约能源的原则,在取得同样效果的前提下,选择预冻时间Emprove低内毒素蔗糖24 h,无水乳糖、Emprove低内毒素甘露醇、Emprove低内毒素甘氨酸和Emprove低内毒素氯化钾均为9 h,Emprove低内毒素葡萄糖、山梨醇仍然失败。
表 2(Table 2)

表 2 预冻时间对不同冻干保护剂制备的冻干粉针的外观和复溶的影响
Table 2 Effects of pre-freezing time on appearance and re-dissolving of lyophilized powder prepared with various freeze- drying powder protective agents
| 冻干保护剂 | 预冻时间/h | 利巴韦林冻干粉针 | 空白冻干粉针 | | 外观 | 复溶 | 外观 | 复溶 | | Emprove低内毒素蔗糖 | 12 | 放置后塌陷 | 迅速、完全 | 放置后塌陷 | 迅速、完全 | | | 24 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 48 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | 无水乳糖 | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素葡萄糖 | 12 | 全部损失 | | 全部损失 | | | | 24 | 全部损失 | | 全部损失 | | | | 48 | 全部损失 | | 全部损失 | | | Emprove低内毒素山梨醇 | 12 | 全部损失 | | 全部损失 | | | | 24 | 全部损失 | | 全部损失 | | | | 48 | 全部损失 | | 全部损失 | | | Emprove低内毒素甘露醇 | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素甘氨酸 | 6 | 塌陷 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 塌陷 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素氯化钾 | 6 | 塌陷 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 |
|
表 2 预冻时间对不同冻干保护剂制备的冻干粉针的外观和复溶的影响
Table 2 Effects of pre-freezing time on appearance and re-dissolving of lyophilized powder prepared with various freeze- drying powder protective agents |
2.3 冻干保护剂用量的考察
取利巴韦林冻干粉针和空白冻干粉针,按照2.2的结果确定不同冻干保护剂的预冻时间,冻干15 h,考察不同冻干保护剂、不同用量水平适用的最少用量,结果见表 3。依据降低能耗、节约能源的原则,在取得同样效果的前提下,选择Emprove低内毒素蔗糖10%,Emprove低内毒素甘露醇、甘氨酸、氯化钾和无水乳糖均为4%,Emprove低内毒素葡萄糖、山梨醇仍然失败。
表 3(Table 3)

表 3 保护剂用量对不同冻干保护剂制备的冻干粉针的外观和复溶的影响
Table 3 Effects of dosage on appearance and re-dissolving of products prepared with freeze-drying powder protective agents
| 冻干保护剂 | 保护剂 用量/% | 利巴韦林冻干粉针 | 空白冻干粉针 | | 外观 | 复溶 | 外观 | 复溶 | | Emprove低内毒素蔗糖 | 10 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 20 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 30 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | 无水乳糖 | 4 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 8 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素葡萄糖 | 10 | 全部损失 | | 全部损失 | | | | 20 | 全部损失 | | 全部损失 | | | | 30 | 全部损失 | | 全部损失 | | | Emprove低内毒素山梨醇 | 10 | 全部损失 | | 全部损失 | | | | 20 | 全部损失 | | 全部损失 | | | | 30 | 全部损失 | | 全部损失 | | | Emprove低内毒素甘露醇 | 4 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 8 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素甘氨酸 | 4 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 8 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素氯化钾 | 4 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 8 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 |
|
表 3 保护剂用量对不同冻干保护剂制备的冻干粉针的外观和复溶的影响
Table 3 Effects of dosage on appearance and re-dissolving of products prepared with freeze-drying powder protective agents |
2.4 冻干时间的考察
取利巴韦林冻干粉针和空白冻干粉针,按照2.2的结果确定不同冻干保护剂的预冻时间,按照2.3的结果确定不同冻干保护剂的用量,考察不同冻干保护剂的适用的最短冻干时间,结果见表 4。依据节约辅料的原则,在取得同样效果的前提下,选择Emprove低内毒素蔗糖15 h,Emprove低内毒素甘露醇、甘氨酸、氯化钾和无水乳糖均为6 h,Emprove低内毒素葡萄糖、山梨醇仍然失败。
表 4(Table 4)

表 4 冻干时间对不同冻干保护剂制备的冻干粉针的外观和复溶的影响
Table 4 Effects of freeze-drying time on appearance and re-dissolving of products prepared with freeze-drying powder protective agents
| 冻干保护剂 | 冻干时间/h | 利巴韦林冻干粉针 | 空白冻干粉针 | | 外观 | 复溶 | 外观 | 复溶 | | Emprove低内毒素蔗糖 | 6 | 放置后塌陷 | 迅速、完全 | 放置后塌陷 | 迅速、完全 | | | 10 | 放置后塌陷 | 迅速、完全 | 放置后塌陷 | 迅速、完全 | | | 15 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | 无水乳糖 | 6 | 塌陷 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素葡萄糖 | 24 | 全部损失 | | 全部损失 | | | | 36 | 全部损失 | | 全部损失 | | | | 48 | 全部损失 | | 全部损失 | | | Emprove低内毒素山梨醇 | 24 | 全部损失 | | 全部损失 | | | | 36 | 全部损失 | | 全部损失 | | | | 48 | 全部损失 | | 全部损失 | | | Emprove低内毒素甘露醇 | 6 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素甘氨酸 | 6 | 塌陷 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素氯化钾 | 6 | 塌陷 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 9 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 | | | 12 | 饱满、平整 | 迅速、完全 | 饱满、平整 | 迅速、完全 |
|
表 4 冻干时间对不同冻干保护剂制备的冻干粉针的外观和复溶的影响
Table 4 Effects of freeze-drying time on appearance and re-dissolving of products prepared with freeze-drying powder protective agents |
2.5 验证试验
依据单因素试验结果,确定最优条件,进行3次验证实验,结果见表 5。所得冻干粉针除Emprove低内毒素甘氨酸表面略有裂隙外,其他冻干粉针均外观饱满、平整,同时所有冻干粉针剂均能够迅速、完全复溶。
表 5(Table 5)

表 5 验证试验结果(n=3)
Table 5 Results of verified test (n=3)
| 冻干保护剂 | 预冻时间/h | 冻干时间/h | 保护剂用量/% | 外观 | 复溶 | | Emprove低内毒素蔗糖 | 24 | 15 | 10 | 饱满、平整 | 迅速、完全 | | 无水乳糖 | 6 | 9 | 4 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素氯化钾 | 9 | 9 | 4 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素甘露醇 | 6 | 6 | 4 | 饱满、平整 | 迅速、完全 | | Emprove低内毒素甘氨酸 | 12 | 9 | 4 | 饱满、平整 | 迅速、完全 |
|
表 5 验证试验结果(n=3)
Table 5 Results of verified test (n=3) |
2.6 含水量的测定
采用库仑法测定含水量。取适量样品,减重法称量,加入C30库仑法卡尔费休水分仪中,输入样品编号和质量后进行测定,最终含水量均为3批样品含水量的平均值,结果见表 6,均符合冻干制剂含水量低于5%的要求。
表 6(Table 6)

表 6 冻干粉针中含水量的测定
Table 6 Moisture of lyophilized powder
| 冻干保护剂 | 含水量/% | | 利巴韦林 冻干粉针 | 空白冻干 粉针 | | Emprove低内毒素蔗糖 | 1.26 | 1.21 | | Emprove低内毒素甘露醇 | 1.67 | 0.98 | | 无水乳糖 | 1.75 | 1.11 | | Emprove低内毒素氯化钾 | 2.07 | 1.54 | | Emprove低内毒素甘氨酸 | 1.36 | 0.32 |
|
表 6 冻干粉针中含水量的测定
Table 6 Moisture of lyophilized powder |
2.7 pH值的测定
取冻干前的样品溶液2 mL,将pH计探头插入溶液中,直到pH计读数不变,此时的读数即为所求pH值;冻干后的样品以冻干前相同体积的水复溶后,取2 mL用pH计测定pH值。取实验所得样品测定冻干前后的pH值,最终pH值均为3批样品的平均值,结果见表 7。冻干后pH值变化不大,考虑到pH计存在一定的测量误差,总体认为pH值没有根本性改变,影响不大。
表 7(Table 7)

表 7 冻干粉针的pH值
Table 7 pH value of lyophilized powder
| 冻干保护剂 | 利巴伟林冻干粉针pH值 | 空白冻干粉针pH值 | | 冻干前 | 冻干后 | 冻干前 | 冻干后 | | Emprove低内毒素蔗糖 | 5.49 | 5.78 | 6.50 | 6.42 | | 无水乳糖 | 4.78 | 5.13 | 5.13 | 5.40 | | Emprove低内毒素氯化钾 | 5.24 | 5.26 | 5.97 | 5.64 | | Emprove低内毒素甘露醇 | 5.23 | 5.59 | 5.73 | 5.97 | | Emprove低内毒素甘氨酸 | 6.07 | 6.05 | 6.16 | 6.04 |
|
表 7 冻干粉针的pH值
Table 7 pH value of lyophilized powder |
2.8 利巴韦林冻干粉针中利巴韦林的测定
2.8.1 色谱条件
色谱柱:ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相为纯水;体积流量0.25 mL/min;柱温30 ℃;样品室温度4 ℃;检测波长206 nm;进样量1 μL。
2.8.2 对照品溶液的制备
精密称定利巴韦林对照品4.01 mg,置10 mL量瓶中,纯水溶解并稀释至刻度,摇匀,即得。
2.8.3 供试品溶液的制备
取空白冻干粉针剂和利巴韦林冻干粉针剂各1瓶,分别用纯水溶解,并各自转移至10 mL量瓶中,纯水稀释至刻度,摇匀,即得。
2.8.4 专属性试验
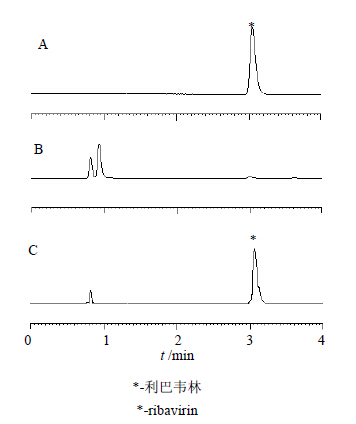
分别取空白冻干粉、利巴韦林冻干粉和利巴韦林对照品溶液,进样测定,并记录色谱图,见图 1。
2.8.5 标准曲线的建立
精密称定利巴韦林对照品10.03 mg,置25 mL量瓶中,纯水溶解并稀释至刻度,摇匀即得0.40 mg/mL利巴韦林对照品储备液。分别精密移取上述储备液0.3、0.6、0.9、1.2、1.5、1.8 mL置10 mL量瓶中,纯水稀释至刻度,摇匀即得质量浓度分别为12、24、36、48、60、72 μg/mL对照品溶液。将上述对照品溶液进样分析,并记录色谱图。以峰面积对质量浓度进行线性回归,得回归方程Y=2 591.8 X-1 974.1,R2=0.999 7,表明利巴韦林在12~72 μg/mL与峰面积线性关系良好。
2.8.6 精密度试验
取利巴韦林冻干粉针剂1瓶,制备供试品溶液,连续进样测定6次,结果利巴韦林峰面积的RSD值为1.7%。
2.8.7 重复性试验
取同一批利巴韦林冻干粉针剂6瓶,制备供试品溶液,进样测定,结果利巴韦林质量分数的RSD值为2.1%。
2.8.8 稳定性试验
吸取利巴韦林冻干粉针剂供试品溶液,分别于0、2、4、6、8、10、12 h进样测定,计算得利巴韦林峰面积的RSD值为2.2%。结果表明供试品溶液在12 h内稳定性较好。
2.8.9 加样回收试验
取已知量的利巴韦林冻干粉针剂供试品共9份,精密加入一定量利巴韦林对照品溶液,制备供试品溶液6份,进样测定。结果利巴韦林的平均回收率为101.1%,RSD值为1.7%。
2.8.10 样品测定
取利巴韦林冻干粉针剂样品,制备供试品溶液,进样测定,外标法计算样品冻干前和冻干后利巴韦林的质量分数,结果见表 8。
表 8(Table 8)

表 8 利巴韦林冻干粉针剂中利巴韦林的测定结果
Table 8 Determination of ribavirin in Ribavirin Freeze- dried Powder
| 样品 | 利巴韦林/(mg·支−1) | | 冻干前 | 冻干后 | | Emprove低内毒素蔗糖 | 24.36 | 23.44 | | 无水乳糖 | 24.22 | 23.50 | | Emprove低内毒素甘露醇 | 23.72 | 22.72 | | Emprove低内毒素甘氨酸 | 23.95 | 23.28 | | Emprove低内毒素氯化钾 | 23.40 | 22.99 |
|
表 8 利巴韦林冻干粉针剂中利巴韦林的测定结果
Table 8 Determination of ribavirin in Ribavirin Freeze- dried Powder |
3 讨论
实验选择了7种冻干保护剂进行比较研究,其中Emprove低内毒素葡萄糖和Emprove低内毒素山梨醇在不同因素水平下均未能成功制备粉针剂。Emprove低内毒素蔗糖、无水乳糖、Emprove低内毒素氯化钾、Emprove低内毒素甘露醇、Emprove低内毒素甘氨酸均能在适宜条件下制备粉针剂。从节约能耗的角度考虑,Emprove低内毒素甘露醇、Emprove低内毒素甘氨酸、Emprove低内毒素氯化钾、无水乳糖4种保护剂更为适合选择,尤以Emprove低内毒素甘露醇为佳。
实验研究了Emprove低内毒素蔗糖、无水乳糖、Emprove低内毒素葡萄糖、Emprove低内毒素甘露醇、Emprove低内毒素山梨醇、Emprove低内毒素氯化钾、Emprove低内毒素甘氨酸7种不同类型常用冻干保护剂作为水溶性药物利巴韦林冻干保护剂的性能,确定了一些基本参数,为水溶性药物冻干粉针剂的制备提供了参考。
 2015, Vol. 30
2015, Vol. 30


