2. 天津药物研究院 释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin 300193, China
长春新碱为夹竹桃科植物长春花Catharanthus roseus (Linn.) G. Don中有效成分,主要用于治疗白血病、乳腺癌、支气管肺癌、软组织肉瘤及神经母细胞瘤等,其作用机制是抑制微管蛋白的聚合,阻止纺锤体微管形成,使有丝分裂停止于中期[1, 2, 3]。由于长春新碱性质极不稳定,因此常用其硫酸盐,即硫酸长春新碱[4]。临床应用的硫酸长春新碱制剂通常为注射剂,存在药物半衰期短、神经系统和胃肠道毒性强等缺点,使其应用受到限制。将硫酸长春新碱制成脂质体可改善其体内药动学行为,提高药物治疗指数,降低毒副作用,延缓药物释放[5, 6, 7]。本课题组选用氢化磷脂(SPC-3)/胆固醇、二硬脂酰磷脂酰胆碱(DSPC)/胆固醇作为膜材,采用pH梯度法制备硫酸长春新碱脂质体。本实验对硫酸长春新碱脂质体的药剂学性质进行研究。
1 材料 1.1 仪器高效液相色谱仪(Laballiance SeriesⅢ泵,Waters486检测器,Agilent1200自动进样器);JEM100CXII型透射电子显微镜(日本电子公司);AG245﹑AT460电子天平(瑞士Mettler-Toledo仪器公司);FE20精密pH计(瑞士Mettler-Toledo仪器公司);Nano ZS90电位粒径测定仪(英国马尔文仪器公司);AS10200BT超声波清洗机(天津奥特赛恩斯仪器有限公司);GSC恒温循环加热锅(河南爱博特科技发展有限公司);透析袋(截留相对分子质量12 000~14 000,美国生产)。
1.2 试药硫酸长春新碱原料药(批号20130189,质量分数99.5%,广州汉方现代中药研究开发有限公司),氢化大豆磷脂酰胆碱(LIPOID SPC-3,静脉注射用,质量分数98%,德国Lipoid公司),二硬脂酰磷脂酰胆碱(Lipoid PC 18∶0/18∶0,即DSPC,静脉注射用,质量分数99%,德国Lipoid公司),胆固醇(批号20130265,质量分数99.2%,南京新百科药业有限公司),Triton-X 100、001×7型阳离子交换树脂(天津光复精细化工研究所);甲醇和乙腈均为色谱纯,其余试剂均为分析纯。
2 方法与结果 2.1 硫酸长春新碱脂质体的制备[8]分别以SPC-3为磷脂材料制备硫酸长春新碱脂质体,批号分别为1112、1113、1114;DSPC为磷脂材料制备硫酸长春新碱脂质体,批号分别为1205、1206、1207。
2.2 外观与形态取SPC-3和DSPC空白脂质体和其硫酸长春新碱载药脂质体,用去离子水稀释至略显浑浊,滴至专用铜网上,滤纸吸干多余脂质体。1%磷钨酸进行负染色,并用滤纸轻轻吸干多余染液,自然挥干。使用透射电子显微镜观察脂质体形态外貌并拍照,结果见图 1。
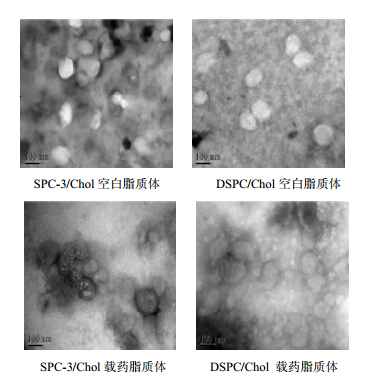 | 图 1 硫酸长春新碱脂质体透射电镜图像Fig. 1 Thermal microphotograph of Vincristine Sulphate Liposomes |
透射电镜显示,脂质体粒径均匀,圆整度良好,药物成功载入脂质体内。空白脂质体内部为水相中空结构,亮度较高。载药脂质体内部有阴影,是载入的药物,四周脂质双分子层结构轮廓清晰可见。SPC-3和DSPC两种磷脂组成的脂质体在形态学上差异无显著性。
2.3 pH值的测定采用pH梯度法制备硫酸长春新碱脂质体,处方工艺条件下所制得脂质体的pH值应在7.20左右。取各批次脂质体适量于烧杯内,采用精密pH计分别测定其pH值,结果见表 1。各批次脂质体pH值均在7.20左右。
| 表 1 样品pH值的测定Table 1 Determination of pHvalues of samples |
采用粒度分析仪测量硫酸长春新碱脂质体的粒径及粒度分布(PDI)。取少量待测脂质体样品,去离子水稀释至样品有轻微浊度,放入样品池待测。以水为分散介质,25 ℃条件下平衡2 min,进行多次扫描。每个样品测定3次,计算平均值。以1112批样品为例,测定结果见图 2。各批次样品平均粒径及粒度分布见表 2。可见硫酸长春新碱脂质体的粒径为120 nm左右,粒度分布为单峰、窄分布。各批次样品的重复性、均一性良好。
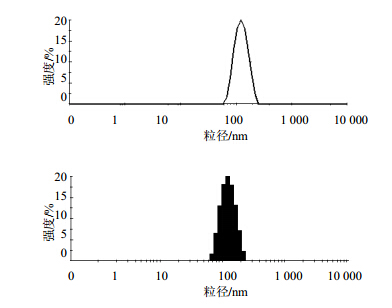 | 图 2 硫酸长春新碱脂质体(批号1112)粒径及粒度分布Fig. 2 Particle diameter and PDI of Vincristine Sulphate Liposomes (batch 1112) |
| 表 2 粒径及粒度分布的测定结果Table 2 Result of detection particle diameter and PDI |
Zeta电位的测定原理是使用激光多普勒测速法对样品进行电泳迁移率实验,得到带电粒子电泳迁移率,并运用Henry方程计算Zeta电位。以批号1112硫酸长春新碱脂质体样品为例,测定结果见图 3。各批次Zeta电位为10 mV左右,结果见表 3。
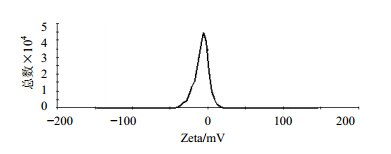 | 图 3 脂质体电位图Fig. 3 Potential of liposome |
| 表 3 Zeta 电位的测定结果Table 3 Result of Zeta potential |
取适量阳离子交换树脂进行酸碱预处理,用大量去离子水洗至中性后装于色谱柱(20 cm×0.8 cm)中,填装柱高10 cm,去离子水洗脱平衡,待用。
2.6.2 色谱条件Diamonsil C18色谱柱(200 mm×4.6 mm,5 μm);流动相:甲醇-水-三乙胺(70∶30∶0.5,用磷酸调pH 7.0); 紫外检测波长:297 nm;柱温:40 ℃;体积流量:1.2 mL/min;进样量:20 μL。
2.6.3 包封率测定精密称取硫酸长春新碱50 mg,置50 mL量瓶内,去离子水定容,配制成1.00 g/L硫酸长春新碱溶液,取0.5 mL置250 mL量瓶内,加入10% Triton-X 100溶液1.0 mL,用去离子水定容,得2 mg/L硫酸长春新碱对照品溶液,HPLC法测定其峰面积。取0.15 mL硫酸长春新碱脂质体,置10 mL量瓶,加水适量,混匀后加入适量10% Triton-X 100溶液,振摇破乳,去离子水定容。HPLC法测定峰面积,计算总药量(mtot)。取0.5 mL载药脂质体上样于阳离子交换树脂柱顶端,以水为洗脱介质。收集0~20 mL洗脱液,置25 mL量瓶,加入10% Triton-X 100溶液破乳,去离子水定容。HPLC法测定,计算脂质体部分药物含量(mlip)。根据公式包封率=mlip/ mtot计算药物包封率。结果见表 4。两种脂质体包封率均在90%以上。
| 表 4 硫酸长春新碱脂质体包封率测定结果Table 4 Results of EE of Vincristine Sulphate Liposomes |
选取生理盐水作为介质,考察药物的释放情况。取3 mL硫酸长春新碱脂质体,置于具塞试管中,加入6 mL释药介质并充分混匀,同时平行制备6份。同时在37 ℃的水浴下保温,在每个取样点取1份样品,测定其包封率,取样时刻药物的包封率与0时刻之差的绝对值,即为药物的释放量。考察两种硫酸长春新碱脂质体在37、50 ℃下的释药情况。结果见图 4。在37 、50 ℃下,硫酸长春新碱的DSPC脂质体对于药物的保留略优于SPC-3脂质体。药物在50 ℃条件下的释放速率明显高于37 ℃。
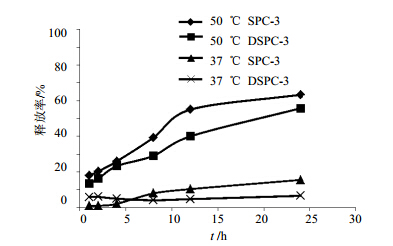 | 图 4 释药温度对药物释放的影响Fig. 4 Effects of release temperature on drug release |
分别考察了以SPC-3、DSPC为磷脂材料的两种脂质体,鉴于两种脂质体体外理化性质差异不大,故选择SPC-3制备的批号1112样品为例,考察载药脂质体的稳定性情况。使用安瓿进行分装熔封,于光照、4 ℃、18 ℃、25 ℃、40 ℃条件下放样,规定时间取样测定。考察外观性状、粒径及粒度分布、Zeta电位和包封率,结果见表 5。光照10 d对载药脂质体的外观性状、粒径及粒度分布、Zeta电位和包封率无显著性影响。4、18、25 ℃条件下放置30 d,硫酸长春新碱脂质体各项指标无显著变化。高温对载药脂质体的稳定性有明显影响。40 ℃条件下,包封率随着放置时间的延长明显降低,30 d时,包封率只有31%。PDI略有增加的趋势,平均粒径、Zeta电位无明显变化。
| 表 5 载药脂质体稳定性实验结果Table 5 Stability of drug-loaded liposome |
脂质体作为药物载体的功效与体循环内脂质体保留药物的能力有关。脂质体释药太快和太慢都不利于发挥疗效。药物释放过快会导致脂质体和等剂量游离药物的功效相似,完全的保留将使包封药物失去治疗作用。因此脂质体最佳疗效的发挥应当是介于这两者之间。对于每种药物而言,必须控制释药的影响因素,寻求药物保留和释放的最佳平衡点。磷脂是脂质体的重要组成部分,磷脂的种类和比例会影响脂质体的物理和化学性质,进而影响药物在体内循环时间[10, 11]。本实验选择的两种磷脂均为氢化磷脂,在体外释药考察时,结果无显著性差异,DSPC脂质体对于药物的保留略显优势。
脂质体体外释药方法主要有透析法和直接混合法。透析法是将一定量脂质体密封于透析袋中,然后将透析袋置于透析介质中,在不同时间点取出一定量的透析液测定药物浓度,或取出透析袋测定袋内药物浓度。直接混合法是将脂质体与介质直接混合,定时取样,测定药物释放量。本实验采用直接混合法测定体外释药,排除透析袋等因素的干扰,药物与释药介质直接接触,可以更好地模拟药物在体内的释放环境,考察脂质体中药物的释药机制。释药温度对于药物释放影响较大。释药温度考察结果显示,50 ℃时药物释放速率明显高于37 ℃时。推测由于温度的升高增加了脂质膜的流动性和通透性,导致药物易透过脂质膜渗漏出来,加速了药物的释放。
稳定性试验表明,硫酸长春新碱更易于从脂质体中渗漏。已有文献报道,硫酸长春新碱脂质体采用三瓶分装的方式,临用前再载药。三瓶分别为硫酸长春新碱药物、外水相缓冲液和空白脂质体溶液,临用前,将三瓶溶液混合,在一定温度孵育,完成载药。三瓶分装的方式可以有效地解决硫酸长春新碱脂质体易渗漏的问题。本实验结果也证实了这一问题。
| [1] | 陈颖翀, 李 翔, 张 婧, 等. 硫酸长春新碱脂质体含量测定及3种包封率测定方法的比较 [J]. 中国药房, 2014, 25(37): 3504-3507. |
| [2] | 李明媛, 张 慧, 杨臻博, 等. 硫酸长春新碱热敏脂质体的制备和质量评价 [J]. 中国药学杂志, 2014, 49(18): 1615-1619. |
| [3] | Zhang L, Gao H, Chen L, et al. Tumor targeting of vincristine by mBAFF-modified PEG liposomes in B lymphoma cells [J]. Cancer Lett, 2008, 269(1): 26-36. |
| [4] | 卢 懿, 侯世祥, 陈 彤. 长春花抗癌成分长春新碱研究的进展 [J]. 中国中药杂志, 2003, 28(11): 1006-1009. |
| [5] | Junping W, Takayama K, Nagai T, et al. Pharmacokinetics and antitumor effects of vincristine carried by microemulsions composed of PEG-lipid, oleic acid, vitamin E and cholesterol [J]. Int J Pharm, 2003, 251(1/2):13-21. |
| [6] | 赵 妍, 邓意辉, 孟胜男, 等. 硫酸长春新碱脂质体的释放度和药效学研究 [J]. 广东药学院学报, 2007, 23(1): 25-27. |
| [7] | 夏爱晓, 宋倩倩, 孙 渊, 等. 硫酸长春新碱固体脂质纳米粒的制备及其性质考察 [J]. 中国现代应用药学, 2013, 30(2): 163-169. |
| [8] | 吴 溪, 李文静, 杨志强, 等. 正交试验优化硫酸长春新碱脂质体的制备工艺 [J]. 现代药物与临床, 2015, 30(6): 653-657. |
| [9] | 李文静, 杨志强, 王杏林. 两种硫酸长春新碱脂质体包封率测定方法的比较 [J]. 中国实验方剂学杂志, 2012, 18(14): 71-75. |
| [10] | 王立华, 毛微曦, 黄慧婷, 等. 大黄酚前体脂质体的制备及其质量评价 [J]. 中草药, 2014, 45(14): 2014-2017. |
| [11] | 蔡明志, 王 昆, 黄复生. 载药脂质体物理化学稳定性研究进展 [J]. 国外医学: 药学分册, 2005, 32(6): 404-407. |
 2015, Vol. 30
2015, Vol. 30


