2. 中国医学科学院 药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China
槲皮素是一种存在于多种植物中的黄酮类化合物,具有广泛的药理活性,如抗肿瘤、抗氧化、肾脏保护、舒张血管与心脏保护作用等[1, 2, 3],但其水溶性较差、口服难吸收、注射无法给药等使应用受到限制。近年来有学者尝试将槲皮素制备成不同剂型,如胶束、聚合物纳米粒、固体脂质纳米粒[4, 5, 6],但载药量均较低(<20%)。纳米混悬剂是一种将药物制备成纳米大小的微粒,并用少量表面活性剂将其稳定下来,从而能均匀分散在水中形成的一种胶体分散体系。纳米混悬剂粒径小,具有很大的表面积和表面能,故能很大程度上提高难溶性药物的溶出速率和程度,并有助于提高生物利用度。具有很高载药量的槲皮素纳米晶虽然也有研究报道[7],但其粒径较大(将近400 nm),对溶解度提高有限。因此本实验尝试制备兼具高载药、小粒径两个特点的槲皮素纳米混悬剂,并对其体外性质进行评价。
1 材料AL204型电子天平(梅特勒-托利多仪器上海有限公司);高速台式离心机(无锡市瑞江分析仪器有限公司);KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司);LGJ-10B冷冻干燥机(北京四环科学仪器厂有限公司); Q200型差示扫描量热分析仪(美国TA仪器公司);Zetasizer nano ZS 90纳米粒度及Zeta电位分析仪(马尔文仪器有限公司);JN3000温控型超高压纳米乳匀机(广州聚能生物科技有限公司,控温范围0~80 ℃);Ultimate 3000 series高效液相色谱仪(戴安中国有限公司)。
槲皮素原药(大连美仑生物技术有限公司,批号20140328,质量分数>98.0%),聚乙二醇1000维生素E琥珀酸酯(TPGS,西安海斯夫生物科技有限公司,批号20121203),PEG2000-PCL2000(山东岱罡生物技术有限公司,批号20140521),PEG2000-PLA2000(山东岱罡生物技术有限公司,批号2014040902),卵磷脂(SPC,广州汉方现代中药研究开发有限公司,批号A4140170),高效液相色谱用试剂均为色谱纯,其他试剂均为分析纯。
2 方法与结果 2.1 槲皮素纳米混悬剂制备方法筛选 2.1.1 稳定剂的筛选和制备方法初筛本研究的目的是制备载药量不低于50%同时粒径小于200 nm的纳米混悬剂,故在选用稳定剂方面,从药载比1∶1开始试验;制备方法先从最简单的溶剂注入法开始。因槲皮素在DMF中具有较高的溶解性,故溶剂注入法暂采用DMF为溶剂溶解药物和稳定剂,超声下缓慢注入到一定体积的水中,13 000 r/min离心20 min,弃上清,沉淀加适量水超声复溶即得。如制备的纳米粒粒径偏大,尝试进一步高压均质以减小粒径,高压均质条件为10 ℃、200 MPa、循环5次。根据预实验筛选结果,分别以PEG 2000- PCL 2000、PEG 2000-PLA 2000、TPGS、TPGS/SPC(2∶1)为稳定剂制备槲皮素纳米粒,测定粒度、粒径分布、多分散系数(PDI)及Zeta电位。测量温度均为25 ℃,每个样品平行3份。结果4种稳定剂均需要联合高压均质才可得到粒径相对较小的纳米粒(表 1),其中以TPGS为稳定剂制备得的槲皮素纳米混悬剂平均粒径最小(160 nm左右),PDI值最小(粒径较均一),且表面电位绝对值最大(提示稳定性可能最好)。故后续研究中选择TPGS为最佳稳定剂,以溶剂注入法联合高压均质的方法制备槲皮素纳米混悬剂。
| 表 1 不同稳定剂制备的槲皮素纳米混悬剂粒径、PDI和电位平均值比较Table 1 Comparision on particle size, PDI, and Zeta potential of Quercetion Nanosuspensions prepared with different stabilizers |
溶剂注入法制备纳米粒时,既可采用超声下注入,也可采用搅拌下注入。不同药物需要不同的注入条件,故在其他条件不变的情况下,考察超声注入和搅拌注入对所制备的槲皮素纳米混悬剂的粒径是否有影响,结果见表 2。超声注入制备的槲皮素纳米粒粒径更小,分布也更均一。故后续研究中确定使用超声注入的方法。这可能是因为超声可使注入的药物注更快地分散成粒径较小的粒子,并被稳定剂稳定下来。
| 表 2 不同方法制备的槲皮素纳米混悬剂粒径、PDI和电位平均值比较Table 2 Comparision on average particle size, PDI, and Zeta potential of Quercetion Nanosuspensions prepared with different methods |
溶剂注入法制备纳米混悬剂时,所使用的有机溶剂在特定条件下可能会影响药物纳米混悬剂的组装,导致其具有不同的粒径。由于TPGS和槲皮素可以同时溶于DMF、甲醇、乙醇,且乙醇作为有机溶剂在制药工业上广泛应用,故本研究尝试是否可以用甲醇、乙醇代替高沸点的DMF来制备槲皮素纳米混悬剂。在固定其他条件不变的情况下,分别以甲醇、乙醇为溶剂制备槲皮素纳米混悬剂,只是以减压旋转蒸发代替离心的方法除去甲醇和乙醇。测定粒径和电位,结果见表 3。以DMF为有机相制备的槲皮素纳米粒粒径最小,分布较窄,推测原因可能是槲皮素为极难溶性药物,在DMF中溶解性最好;另外减压旋转蒸发除去有机溶剂的过程也可能影响纳米粒的大小。
| 表 3 不同有机试剂制备的槲皮素纳米混悬剂粒径、PDI和电位平均值比较Table 3 Comparision on average particle size, PDI, and Zeta potential of Quercetion Nanosuspensions prepared with different organic reagents |
在高压均质过程中,均质温度有时也会影响均质效果,故在其他条件不变的情况下,分别采用低温10 ℃、常温25 ℃和高温40 ℃对制备的槲皮素纳米混悬剂进行均质,测定并比较粒径分布,见表 4。结果表明低温条件下制备的纳米粒粒径较小,较均一,故将均质温度设定为10 ℃。
| 表 4 不同温度制备的槲皮素纳米混悬剂粒径、PDI和电位平均值比较Table 4 Comparision on average particle size, PDI, and Zeta potential of Quercetion Nanosuspensions prepared at different temperatures |
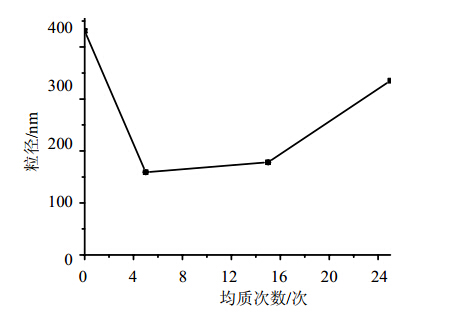
高压均质条件为10 ℃、200 MPa,对制备的槲皮素纳米混悬剂分别均质5、15、25次,考察均质次数对样品粒径大小的影响,见图 1。可以看出,并非均质次数越多越好,均质15次较均质5次其平均粒径并没有进一步减小,均质25次之后粒径反而大幅度增加。原因可能是一定的剪切作用后纳米粒子达到最小,继续均质会不断加剧奥斯瓦尔德熟化作用,使粒径反而增大。因此选定均质5次最佳均质次数。
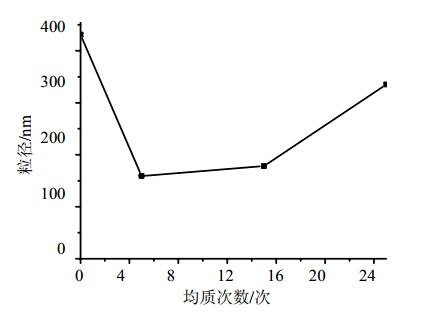 | 图 1 高压均质次数对槲皮素纳米混悬剂粒径变化的影响Fig. 1 Effect of different homogenization cycles on particles size of Quercetion Nanosuspensions |
为进一步提高载药量,在药载比1∶1的槲皮素纳米混悬剂处方、工艺优化的基础上,使用5∶1的药载比进行制备,考察所制备的纳米粒的粒径,结果见表 5。药载比提高到5∶1后,所制备的纳米粒的平均粒径为173 nm,仅略有增加,放置稳定性也较好,故最终选择药载比5∶1为最佳药载比。
| 表 5 不同药载比槲皮素纳米混悬剂粒径、PDI和电位平均值比较Table 5 Comparision on average particle size, PDI, and Zeta potential of Quercetion Nanosuspensions prepared with different drug-stabilizer ratio |
通过以上实验最终筛选出最佳处方为TPGS作为稳定剂、药载比为5∶1、DMF为有机试剂;最佳制备方法为超声注入-高压均质法,注入温度为10 ℃,高压均质条件为10 ℃、200 MPa均质5次。按照最佳处方制备样品,具体操作为:精密称取槲皮素 20 mg、TPGS 4 mg,溶于0.5 mL DMF中,10 ℃和超声条件下缓慢滴加至10 mL水中,13 000 r/min离心20 min,弃上清,沉淀加水5 mL超声复溶,10 ℃、200 MPa,高压均质5次,即得。
制备后样品平均粒径为173.21 nm,PDI为0.18,电位为−19.02 mV,粒径分布见图 2。样品粒径小,呈正态单峰分布,粒子表面所带电位绝对值越大,粒子之间静电排斥作用越大,体系越稳定。
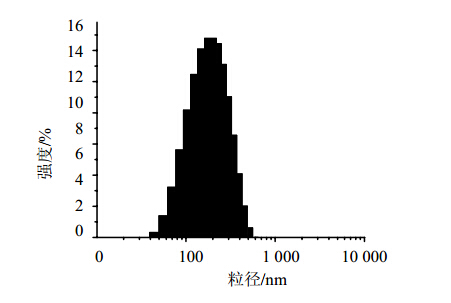 | 图 2 药载比5∶1槲皮素纳米混悬剂粒径分布Fig. 2 Size distribution of Quercetin Nanosuspensions with drug-stbilizer ratio 5∶1 |
取1 mL槲皮素纳米混悬剂逐渐滴加到1 mL新鲜空白大鼠血浆中,37 ℃孵育,并在0、3、5 h测其粒径,平行实验3份,考察其在血浆中的稳定性,见表 6。另将槲皮素纳米混悬剂放置于4 ℃条件下储存,在5、10 d测定粒径分布,平行实验3份,考察储存放置稳定性,见表 7。
| 表 6 槲皮素纳米混悬剂在37 ℃血浆中平均粒径随时间的变化(n=3)Table 6 Size change of Quercetin Nanosuspensions in rat plasma at 37 ℃ (n=3) |
| 表 7 槲皮素纳米混悬剂放置过程中粒径随时间的变化(n=3)Table 7 Size change of Quercetin Nanosuspensions when stored (n=3) |
同时考察样品在水和5%葡萄糖溶液中粒径分布及电位变化,见图 3。可见槲皮素纳米混悬剂在水、5%葡萄糖溶液中孵育5 h,粒径几乎无变化,电位也无明显改变。4 ℃条件下放置10 d的粒径、电位几乎没有变化,显示具有较好的稳定性。血浆中孵育后粒径虽有所增大,但5 h后也只有不到260 nm,提示槲皮素纳米混悬剂在血浆中稳定,加之不会引起红细胞溶血,故槲皮素纳米混悬剂适合于静脉注射给药。槲皮素纳米粒在血浆中粒径略有增大,可能与血浆蛋白在其表面吸附有关。
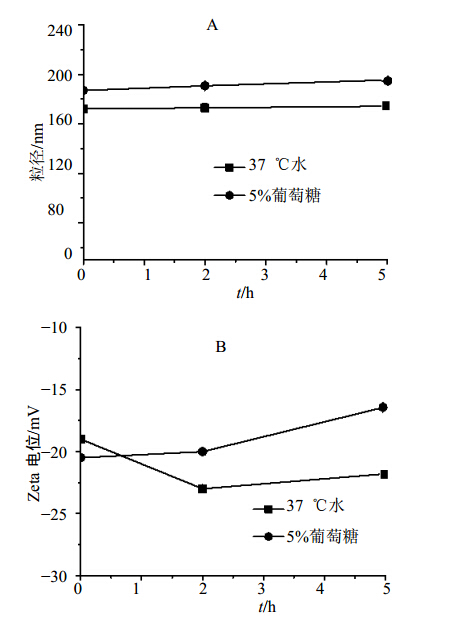 | 图 3 槲皮素纳米混悬剂在37 ℃水和5%葡萄糖溶液中粒径(A)和电位(B)变化Fig. 3 Size and Zeta potential change of Quercetin Nanosuspensions in 5% glucose solution and water at 37 ℃ |
Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.4%磷酸水(65∶35),流速0.8 ml/min,检测波长372 nm,进样量20 μL,柱温25 ℃。
2.3.2 测定取药载比为5∶1的槲皮素纳米混悬剂 5 mL冻干,用甲醇溶解破坏纳米粒使药物释放出来,HPLC测定载入纳米粒内的药物含量,计算载药量(drug loading,DL)和包封率(entrapment efficiency,EE)。结果药载比5∶1的槲皮素纳米混悬剂实测包封率为(96.41±1.72)%,载药量为(80.40±1.44)%。
EE=W1/ W2
DL=W1/ W3
W1为5 mL纳米粒中实测槲皮素质量,W2为制备5 mL槲皮素纳米混悬剂时槲皮素投料量,W3为制备5 mL槲皮素纳米混悬剂的实测质量
实验测定槲皮素在水中饱和溶解度为(6.83±0.41)μg/mL,将槲皮素制备成纳米混悬剂之后,其在水中的浓度可轻易达到2.0 mg/mL,提高约293倍,并可以静脉注射给药,极大地改善了槲皮素水中溶解性差和因此带来的难以给药问题。
2.4 差示扫描量热法分析(DSC)精密称取5 mg样品于标准铝盘中,密封后在氮气环境下按照10 ℃/min的速率扫描,分析后绘制DSC曲线,扫描温度范围为0~350 ℃。槲皮素原药、槲皮素纳米混悬剂、辅料TPGS以及药物与辅料物理混合物的DSC结果见图 4。槲皮素在145.58、287.20、320.58 ℃处均有1个吸热峰,表明槲皮素为晶型,纳米混悬剂与物理混合物在上述位置出现与槲皮素原药相似的吸热峰,表示槲皮素制备成槲皮素纳米混悬剂后晶型未发生改变,仍为晶型状态;TPGS在33.52 ℃处有1个微弱的吸热峰,物理混合物中也有相似的吸热峰出现,而纳米混悬剂中该吸热峰消失,表明TPGS与槲皮素已形成纳米粒结构。
 | 图 4 槲皮素与TPGS物理混合物、槲皮素纳米混悬剂(B)、槲皮素原药(C)和TPGS(D)的DSC热分析图Fig. 4 DSC thermograms of Physical mixture ofquercetin bulk powder and TPGS(A), Quercetin Nanosuspensions (B), quercetin (C), and TPGS (D) |
分别精密吸取1 mL槲皮素纳米混悬剂、槲皮素原药混悬液和槲皮素溶液(50 % PEG 400水溶液配制)于透析袋(MWCO 8 000~14 000)中,置于250 mL释放介质(含0.5% SDS、1%乙醇的去离子水)中,37 ℃、100 r/min恒温搅拌,分别于0.5、1、2、4、8、12、24、36 h取1 mL释放外液,同时补充等体积的37 ℃恒温的新鲜释放介质继续释放,24 h更换全部释放外液为新鲜释放外液,满足漏槽条件。HPLC法测定其中槲皮素的质量浓度,计算累积释放度;同一样品平行实验3份,并设置槲皮素溶液组为对照组。结果见图 5。
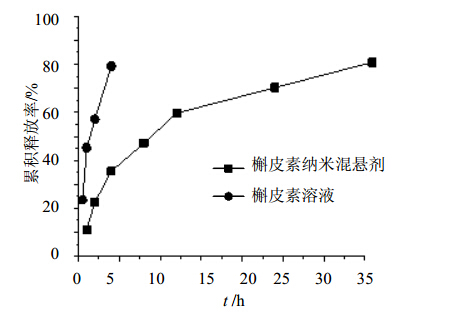 | 图 5 槲皮素纳米混悬剂与槲皮素溶液的释放曲线Fig. 5 In vitro release curves of Quercetin Nanosuspensions and Quercetin solutions |
体外释放实验中,由于槲皮素原药水溶性和脂溶性均较差[8],选择释放介质时分别考察了槲皮素在水、PBS、生理盐水中的饱和溶解度,得到槲皮素在纯水中饱和溶解度为6.8 μg/mL,在PBS、生理盐水中的溶解度与此相近。如此低的溶解度,不适合直接用来做释放度考察(释放太慢),通常要在水相中加入适量SDS、聚山梨酯、DMSO或乙醇等提高其在释放介质中的溶解性。经过摸索,实验选用含0.5% SDS、1.0%乙醇的水溶液作为释放介质可达到适当的释放速度和漏槽条件。将槲皮素分散在水中得到混悬液,一直到36 h还检测不到药物的释放;而槲皮素纳米混悬剂36 h已经释放出了约80%的药物,显示出纳米粒能大幅度提高难溶性药物的溶出速度和程度。这可能是因为将药物制备成纳米大小后,巨大的比表面带来很高的表面能,导致药物在纳米粒表面的饱和溶解度增加;同时巨大的比表面带来巨大的扩散面,释放出来的药物能够较快地从纳米粒表面扩散到释放介质本体。
本研究还尝试将槲皮素分散、溶解于50% PEG 400中形成溶液,研究了槲皮素溶液的体外释放,结果显示,溶液中的槲皮素在4 h内的释放量就达到了80%。这一处方可以克服由于槲皮素溶解度差而对口服生物利用度的不利影响,但肠道内的广泛代谢、过效应[9, 10]仍然是限制槲皮素发挥药效的瓶颈。有研究报道,平均粒径393 nm的槲皮素纳米晶,其口服生物利用度可较原料药提高15倍[7],本研究制备的槲皮素纳米混悬剂的平均粒径173 nm,载药量高达80%,有望在提高槲皮素口服生物利用度方面取得相似或更好的效果。同时,将所制备的槲皮素纳米混悬剂静脉注射,还会因较小的粒径和EPR效应而具有对肿瘤组织的被动靶向性,加上槲皮素纳米混悬剂较适宜的释放速度,有望促进槲皮素抗肿瘤作用发挥和推进相关研究。
3 讨论目前槲皮素纳米制剂的研究主要为纳米粒、脂质体、胶束、固体脂质纳米粒[6, 13],但载药量均较低(<20%),本实验采用新型稳定剂TPGS制备槲皮素纳米混悬剂,其载药量为(80.40±1.44)%,包封率为(96.41±1.72)%,包封效果较好;粒径均一、稳定,平均粒径为(173.21±0.90)nm。Sun等[7]也制备了槲皮素纳米混悬剂,平均粒径为393.5 nm,且制备纳米混悬剂后槲皮素水中溶解度比原药增加了70倍,本研究制备的纳米粒粒径更小,槲皮素的溶解性增加更显著(增加290倍),且可能因较长的体外释放时间而有望在体内达到长效缓释。
另外有研究表明,槲皮素原药在体内吸收较少(12 h吸收不到60 %[9]),吸收的同时即存在生物转化(多种转化产物进入血液并快速清除[10,14]),而且槲皮素本身在血液循环中药物清除极快,入血的槲皮素在2 h后就已检测不到。因此本研究制备的高载药、小粒径、缓慢释放、表面有PEG链的槲皮素纳米粒有望在入血后实现长循环、缓慢释放、高生物利用度等,利于在血液和组织中较长时间维持有效血药浓度,从而改善临床治疗效果。
研究表明TPGS还可以抑制肿瘤细胞P-糖蛋白对药物的外排,将其作为辅料可逆转肿瘤耐药性,增加抗癌药物对肿瘤细胞的杀伤作用[11,12]。基于以上原因,本实验以TPGS为稳定剂制备的高载药槲皮素纳米混悬剂,静脉注射后用于肿瘤治疗时,不但可以由于EPR效应具有对肿瘤的被动靶向性,同时有望抑制肿瘤的多药耐药性,从而增加药效。
综上所述,本实验制备的槲皮素纳米混悬剂具有高载药、小粒径、缓释、降低肿瘤多药耐药等优点,这将使得槲皮素的这种剂型在抗肿瘤等方面具有很好的潜在应用前景。
| [1] | 安昌勇. 槲皮素对结肠癌LOVO细胞增殖、侵袭及癌胚抗原CEA表达的影响 [D]. 重庆: 重庆医科大学, 2013. |
| [2] | 王蓝天, 王天然. 槲皮素对慢性肾衰大鼠肾脏细胞的保护作用研究 [J]. 西南国防医药, 2014, 24(2): 144-146. |
| [3] | 侯晓敏, 秦小江. 槲皮素对大鼠胸主动脉不同节段的差异性舒张作用研究 [J]. 中西医结合心脑血管病杂志, 2014, 12(3): 341-342. |
| [4] | Tan B J, Liu Y, Chang K L, et al. Perorally active nanomicellar formulation of quercetin in the treatment of lung cancer [J]. Int J Nanomedicine, 2012, 7: 651-661. |
| [5] | Tan Q, Liu W, Guo C, et al. Preparation and evaluation of QC-loaded lecithin -chitosan nanoparticles for topical delivery [J]. Int J Nanomedicine, 2011, 6: 1621-1630. |
| [6] | Li H, Zhao X, Ma Y, et al. Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles [J]. J Control Release, 2009, 133(3): 238-244. |
| [7] | Sun M, Gao Y, Pei Y, et al. Development of nanosuspension formulation for oral delivery of quercetin [J]. J Biomed Nanotechnol, 2010, 6(4): 325-332. |
| [8] | Lan K, Zhang Y, Yang J, et al. Simple quality assessment approach for herbal extracts using high performance liquid chromatography-UV based metabolomics platform [J]. J Chromatogr A, 2010, 1217(8): 1414-1418. |
| [9] | 王 刚, 常明泉, 杨光义, 等. 槲皮素长循环纳米脂质体的小鼠口服吸收研究 [J]. 医药导报, 2011, 30(10): 1266-1269. |
| [10] | Morand C, Crespy V, Manach C, et al. Plasma metabolites of quercetin and their antioxidant properties [J]. Am J Physiol, 1998, 275(1/2): 212-219. |
| [11] | Zhang Z, Feng S S. Self-assembled nanoparticles of poly(lactide)-Vitamin E TPGS copolymers for oral chemotherapy [J]. Int J Pharm, 2006, 324(2): 191-198. |
| [12] | Pan J, Feng S S. Targeted delivery of paclitaxel using folate-decorated poly(lactide)-vitamin E TPGS nanoparticles [J]. Biomaterials, 2008, 29(17): 2663-2672. |
| [13] | Wang G, Wang J J, Yang G Y, et al. Effects of quercetin nanoliposomes on C6 glioma cells through induction of type III programmed cell death [J]. Int J Nanomedicine, 2012, 7: 271-280. |
| [14] | 廖 瀚, 甄宇红, 丁 超, 等. 槲皮素的生物活性机制及药动学特点 [J]. 现代生物医学进展, 2012, 12(16): 3174-3177. |
 2015, Vol. 30
2015, Vol. 30


