甘草次酸是从豆科植物甘草Glycyrrhiza uralensis Fisch.的根及根茎中提取出来的具有齐墩果烷型骨架的五环三萜类天然产物[1]。自1935年Ruzicka等[2]首次报道甘草次酸的化学结构以来,国内外学者对甘草次酸及其衍生物进行了大量的研究[3, 4, 5],主要是将甘草次酸C3位羟基和C30位羧基同相应的酸酐、醇或卤代烷反应生成一系列甘草次酸酯类衍生物,这类衍生物大多具有很好的抗肿瘤活性。将甘草次酸C11位羰基还原,C3位羟基成酯,C30位羧基与相应的醇反应得到3-胺基酸酯-11-脱氧甘草次酸-30-酯类衍生物,具有很好的抑菌活性及抗炎活性[6, 7]。本文以甘草次酸为先导化合物,在本课题组前期对五环三萜类化合物结构改造以及构效关系研究[8, 9, 10, 11, 12]的基础上,保留五环三萜骨架,对其C3和C30位进行结构修饰,合成了12个新的甘草次酸衍生物,利用MS、1H-NMR和元素分析确证了结构,并采用SRB法对目标化合物进行了体外抗肿瘤活性研究。
1 仪器与试药Büchi B-540熔点测定仪;Bruker ARX-300型核磁共振波谱仪;LCQ型质谱仪(Finnigan公司);MCO-15AC二氧化碳培养箱(日本Sanoy公司);Spectra Max PLUS 384型酶标仪;XDS-1B倒置显微镜;TGL-16B低速台式离心机;BCD-190TMPK电冰箱。
柱色谱用200~300目硅胶、薄层色谱用硅胶GF254均由青岛海洋化工厂生产;显色剂为10%硫酸乙醇溶液;流动相选用石油醚(沸程为60~90 ℃)与醋酸乙酯或丙酮。甘草次酸(质量分数>98%)购于成都天源天然产物有限公司;磺基罗丹明B(SRB)、台盼蓝均购自Sigma公司;胎牛血清购于杭州四季青公司;RPMI-1640培养基购自Gibco公司;紫杉醇(批号100382-200301,上海静荣生物科技有限公司);吉非替尼(批号J20070047,阿斯利康制药有限公司);所有试剂均为化学纯或分析纯。乳腺癌细胞株MCF-7/S、肺癌细胞株A549均购自美国模式培养物保藏所(ATCC),保存在中国科学院大连化学物理研究所药用资源开发组。
2 方法与结果以甘草次酸为原料,将C3位羟基消除,A环生成环烯,进而将C2、C3位双键氧化生成环氧化合物,同时将C30位羧基与相应的醇反应成酯,得到5个I系列2,3-环氧-11-氧代齐墩果烷型-12-烯-30-羧酸酯类化合物。C3位羟基氧化成羰基,同时C30位羧基与相应的醇反应成酯或与胺反应成酰胺,得到7个II系列3,11-氧代-齐墩果烷型-12-烯-30-羧酸酯/酰胺类化合物。
2.1 目标化合物GA-I1~I5的合成 2.1.1 3-羟基-11-氧代-齐墩果烷型-12-烯-30-羧酸酯(GA-1)的制备将甘草次酸(100 mg,0.219 mmol)溶于2 mL DMF中,加入无水K2CO3(100 mg,0.724 mmol),室温下搅拌,10 min后缓慢滴加0.08 mL溴乙烷,TLC监测反应,待反应完全后,加入适量水,用醋酸乙酯(10 mL×3)萃取,合并有机相,无水硫酸镁干燥,滤过,减压蒸馏浓缩得到产物90.6 mg,产率85.4%,mp 175.4~176.8 ℃,ESI-MS m/z:484.7 [M+H]+。
2.1.2 3-甲基磺酰氧基-11-氧代-齐墩果烷型-12-烯- 30-羧酸酯(GA-2)的制备将GA-1(100 mg,0.206 mmol)溶于3 mL二氯甲烷和1 mL三乙胺(TEA)的混合溶液中,冰浴下搅拌,缓慢滴加0.25 mL甲基磺酰氯(MSCl),控制反应温度在0 ℃左右。滴加完毕后,反应化合物搅拌3 h,TLC监控反应。反应完毕后,滤过,滤液用1 mol/L盐酸溶液洗涤至微酸性,醋酸乙酯萃取,再水洗至中性。有机相无水硫酸镁干燥,滤过,减压蒸除溶剂得到产物85.8 mg,产率70.4%,mp 175.4~176.8 ℃,ESI-MS m/z:590.8 [M+H]+。
2.1.3 2-烯-11-氧代-齐墩果烷型-12-烯-30-羧酸酯(GA-3)的制备将GA-2(100 mg,0.169 mmol)溶于10 mL二甲基乙酰胺(DMAC)中,加入无水Li2CO3(60.0 mg,73.89 mmol),于165 ℃下加热回流30 min。反应液冷却后,滤过。滤液加入10 mL水,用醋酸乙酯(10 mL×3)提取。有机相用1 mol/L盐酸溶液洗涤至微酸性,再水洗至中性。有机相无水硫酸镁干燥,滤过,减压蒸除溶剂得到产物51.7 mg,产率65.4%,mp 175.4~176.8 ℃,ESI-MS m/z:466.7 [M+H]+。
2.1.4 2,3-环氧-11-氧代-齐墩果烷型-30-羧酸乙酯 (GA-I1)的制备将GA-3(100 mg,0.214 mmol)溶于10 mL二氯甲烷中,冰浴下搅拌,加入间氯过氧苯甲酸(m-CPBA,200 mg,1.16 mmol),反应30 min后转至常温反应5 h左右,反应液用0.1 mg/L 10%亚硫酸钠溶液洗涤3次,然后用二氯甲烷(10 mL×3)萃取,有机相用无水硫酸镁干燥,滤过,减压蒸馏浓缩。粗品用硅胶柱色谱纯化,石油醚-醋酸乙酯(15∶1)洗脱,得白色粉末状固体45.6 mg,产率43%,mp 188.6~190.3 ℃。元素分析(%):C(77.20),H(9.88),O(12.99)。ESI-MS m/z:497.4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.67(s,1H,H-12),4.16(m,2H,COOCH2),3.18(m,1H,H-2),2.83(d,1H,J=7.0 Hz,H-3),2.32(s,1H,H-9),2.25(t,1H,J=6.5 Hz,H-5),1.27(t,3H,J=7.2 Hz,COOCH2CH3),1.32、1.15、1.14、1.11、1.09、1.04、0.80(s,21H,CH3×7)。
2.1.5 2,3-环氧-11-氧代-齐墩果烷型-30-羧酸苄酯(GA-I2)的制备按照化合物GA-I1的合成方法,由GA(100 mg,0.219 mmol)与溴化苄(0.12 mL)反应,硅胶柱色谱纯化,石油醚-醋酸乙酯(4∶1)洗脱,得白色粉末状固体76.0 mg,产率62.9%,mp 189.6~191.6 ℃。元素分析(%):C(79.63),H(9.10),O(11.56)。ESI-MS m/z:559. 2 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:7.38~6.89(m,5H,Ph),5.57(s,1H,H-12),4.83(s,2H,PhCH2),3.17(m,1H,H -2),2.85(d,1H,J=6.3 Hz,H-3),2.31(s,1H,H-9),2.23(t,1H,J=6.5 Hz,H-5),1.33、1.31、1.17、1.12、1.08、1.03,0.74(s,21H,CH3×7)。
2.1.6 2,3-环氧-11-氧代-齐墩果烷型-30-羧酸丙酯(GA-I3)的制备按照化合物GA-I1的合成方法,由GA(100 mg,0.219 mmol)与溴丙烷(0.08 mL)反应,硅胶柱色谱纯化,石油醚-醋酸乙酯(20∶1)洗脱,得白色粉末状固体42.3 mg,产率35.5%,mp 160.5~162.8 ℃。元素分析(%):C(77.75),H(10.02),O(12.39)。ESI-MS m/z:511. 4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.65(s,1H,H-12),4.05(t,J=7.2 Hz,2H,COOCH2),3.16(m,1H,H-2),2.81(d,1H,J=6.5 Hz,H-3),2.31(s,1H,H-9),2.21(t,1H,J=7.0 Hz,H-5),1.31、1.24(s,6H,CH3×2),1.20(m,2H,CH2CH3),1.14、1.10(s,6H,CH3×2),1.06、1.03(s,6H,CH& lt; sub>3×2),0.95(t,J=7.2 Hz,3H,CH2CH3),0.79(s,3H,CH3)。
2.1.7 2,3-环氧-11-氧代-齐墩果烷型-30-羧酸异丙酯(GA-I4)的制备按照化合物GA-I1的合成方法,由GA(100 mg,0.219 mmol)与2-溴丙烷(0.08ml)反应,粗品用硅胶柱色谱纯化,石油醚-醋酸乙酯(20∶1)洗脱,得白色粉末状固体49.5 mg ,产率41.3%,mp 162.9~163.6 ℃。元素分析(%):C(77.75),H(10.02),O(12.39)。ESI-MS m/z:511.4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.64(s,1H,H-12),4.43(m,1H,COOCH),3.22(m,1H,H-2),2.82(d,1H ,J=7.0 Hz,3-H),2.32(s,1H,H-9),2.26(t,1H,J=7.3 Hz,H-5),1.32(s,3H,CH3),1.23(d,3H,J=5.9 Hz,COOCHCH3a),1.18(d,3H,J=6.3 Hz,COOCHCH3b),1.15、1.12、1.11、1.09、1.04、0.79(s,18H,CH3×6)。
2.1.8 2,3-环氧-11-氧代-齐墩果烷型-30-羧酸丁酯(GA-I5)的制备按照化合物GA-I1的合成方法,由GA(100 mg,0.219 mmol)与溴代正丁烷(0.1 mL)反应,硅胶柱色谱纯化,石油醚-醋酸乙酯(20∶1)洗脱,得白色粉末状固体44.7 mg,产率37.1%,mp 149.2~151.1 ℃。元素分析(%):C(77.62),H(10.13),O(12.38)。ESI-MS m/z:525. 3 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.67(s,1H,H-12),4.12(t,J=7.0 Hz,2H,COOCH2),3.18(m,1H,H-2),2.83(d,J=6.5 Hz,1H,H-3 ),2.33(s,1H,H-9),2.21(t,J=7.5 Hz,1H,H-5),1.26、1.16、1.15、1.12、1.10(s,15H,CH3×5),1.07(m,2H,COOCH2CH2),1.03(s,3H,CH3), 0.99 < span style='font-family:宋体;letter-spacing:-.2pt'>(m,2H,CH2CH3),0.94(t,J=7.5 Hz,3H,CH2CH3),0.87(s,3H,CH3)。
目标化合物GA-I1~I5的合成路线见图 1。
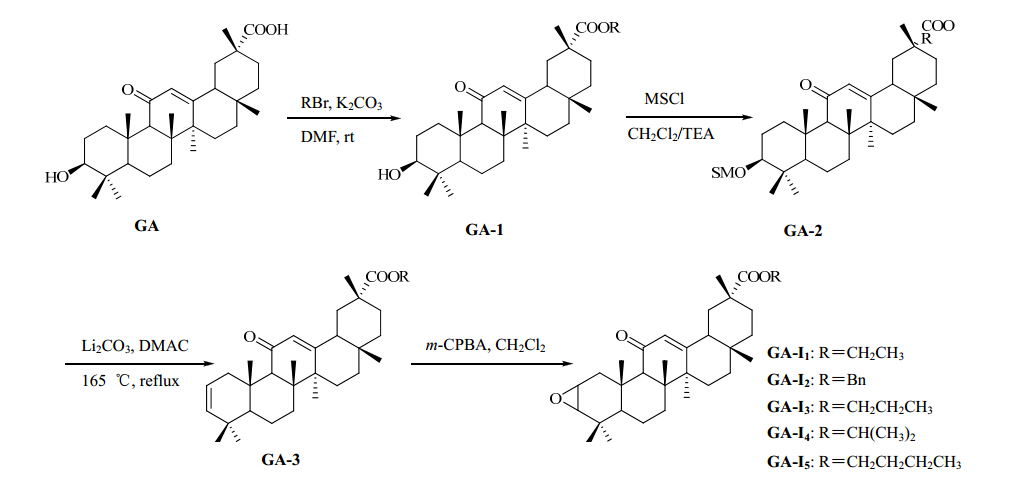 | 图 1 目标化合物GA-I1~I5的合成路线Fig. 1 Synthetic route of target compounds GA-I1~I5 |
将甘草次酸(1.00 g,2.12 mmol),溶于10 mL的四氢呋喃(THF)中,在冰盐浴下缓慢滴加2 mL新鲜制备的Jone's试剂。搅拌1 h后停止反应,将溶液倒入5 mL水中直至出现白色沉淀,抽滤,室温下自然干燥,得白色固体0.92 g,产率为92.59%,mp 184.6~186.8 ℃。ESI-MS m/z:482.7。
2.2.2 3,11-氧代-齐墩果烷型-12-烯-30-羧酸(GA-5)的制备将化合物GA-4(100 mg,0.21 mmol)溶解在5 mL二氯甲烷中,加入2 mL草酰氯,室温搅拌24 h,生成(3β, 20β)-3,11-氧代-齐墩果烷型-12-烯-30-酰氯,蒸除反应溶剂和草酰氯,残余物加入2 mL环己烷,减压蒸除环己烷,反复操作2次,得到化合物GA-5(直接进入下一步反应)。
2.2.3 N-[3,11-氧代-齐墩果烷型-12-烯-30-酰]-环己胺(GA-II1)的制备将GA-5溶于2 mL二氯甲烷中,加三乙胺调pH值至9~10,搅拌5 min后加入环己胺(78.36 mg,0.85 mmol),室温下反应,TLC检测反应终点。反应结束后,向反应液中加入3 mL水,以2 mol/L盐酸调pH值至3,减压蒸除二氯甲烷,析出淡黄色固体,抽滤,水洗滤饼至中性,室温干燥,粗品经硅胶柱色谱纯化,石油醚-丙酮(3∶1)洗脱,得白色粉末状固体58 mg,产率47.5%,mp 292.6~294.0 ℃。元素分析(%):C(78.36),H(10.22),N(2.39)O(8.91)。ESI-MS m/z:550.4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:6.41(brs,1H,NH),4.50(s,1H,H-12),3.84(m,1H,NHCH),2.97~2.88(m,1H,H-2a& lt; /span>),2.75~2.63(m,8H,CH2CH2×2),2.58~2.43(m,1H,H-2b),2.20(s,1H,H-9),1.90(t,J=7.5 Hz,1H,H-18),1.39、1.27、1.18、1.12、1.06、0.85、0.61(s,21H,CH3×7)。
2.2.4 N-[3,11-氧代-齐墩果烷型-12-烯-30-酰]-正丙胺(GA-II2)的制备按照化合物GA-II1的合成方法,由化合物GA-5(100 mg,0.21 mmol)与正丙胺(62.17 mg,0.85 mmol)反应得到,粗品用硅胶柱色谱纯化,石油醚-醋酸乙酯(3∶1)洗脱,得白色粉末状固体59 mg,产率41.1%。mp 170.7~171.4 ℃。元素分析(%):C(77.66),H(10.32),N(2.72 ),O(9.55)。ESI-MS m/z:510.3 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:6.38(brs,1H,NH),5.68(s,1H,12-H),3.11(t,2H,J=8.0 Hz,COCH2),3.00 < /span>~2.90(m,1H,H-2a),2.75~2.63(m,1H,H-2b),2.24(s,1H,9-H),2.08(t,1H,J=7.5 Hz,H-18),2.03(m,2H,COCH2CH2),1.35(t,3H,J=8.0 Hz,CH2CH3),1.24、1.13、1.06、0.95、0.81、0.75、0.63(s,21H,CH3×7)。
2.2.5 3,11-氧代-齐墩果烷型-12-烯-30-羧酸乙酯(GA-II3)的制备将GA-4(100 mg,0.21 mmol),溶于3 mL DMF中,加入无水K2CO3(100 mg,0.724 mmol),室温下搅拌,10 min后缓慢滴加10 mL溴乙烷,TLC监测反应,待反应完全后,加入适量水,用醋酸乙酯萃取(10 mL×3),合并有机相,无水硫酸镁干燥,滤过,减压蒸除溶剂得到粗品,硅胶柱色谱纯化,石油醚-醋酸乙酯(3∶1)洗脱,得到白色粉末状固体54.0 mg,产率48.1%,mp 175.3~176.4 ℃。元素分析(%):C(77.30),H(9.82),O(12.78)。ESI-MS m/z:497.1 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.78(s,1H,H-12),3.69(m,2H,OCH2CH3),3.02~2.90(m,1H,H-2a),2.72~2.63(m,1H,H-2b),2.30(s,1H,H-9),2.10(t,1H,J=7.5 Hz,H-18),1.73(t,3H,J=7.5 Hz,OCH2CH3),1.20、1.11、1.08、0.97、0.81、0.75、0.63(s,21H,CH3×7)。
2.2.6 3,11-氧代-齐墩果烷型-12-烯-30-羧酸甲氧甲酰基甲酯(GA-II4)的制备按照化合物GA-II3的合成方法,与氯乙酸甲酯20 mL在室温下反应,粗品用柱色谱纯化,石油醚-醋酸乙酯(5∶1)洗脱,得到白色固体41.1 mg,产率35.6%,mp 189.5~190.8 ℃。元素分析(%):C(73.57),H(8.80),O(17.75)。ESI-MS m/z:541.4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ: 5.77(s,1H,H-12),3.81(s,2H,OCH2CO),3.45(s,3H,COCH3),3.02~2.90(m,1H,H-2a),2.72~2.63(m,1H,H-2b),2.33(s,1H,H-9),2.05(t,J=7.5 Hz,1H,H-18),1.13、1.10、1.05、0.98、0.93、0.88、0.73(s,21H,CH3×7)。
2.2.7 3,11-氧代-齐墩果型-12-烯-30-酰-羧酸乙氧甲酰基甲酯(GA-II5)的制备按照GA-II3的合成方法,与氯乙酸乙酯10 mL在室温下反应,粗品用柱色谱纯化,石油醚-醋酸乙酯(5∶1)洗脱,得到白色固体44.5 mg,产率37.6%,mp 194.3~196.2 ℃。元素分析(%):C(73.40),H(8.95),O(17.55)。ESI-MS m/z:555.4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.80(s,1H,H-12),3.83(s,2H,OCH2CO),3.62(m,2H,COCH2),3.10~2.98(m,1H,H-2a),2.65~2.50(m,1H,H-2b),2.27(s,1H,H-9),2.07(t,J=7.5 Hz,1H,H-18),1.70(t,J=7.0 Hz,3H,OCH2CH3),1.27、1.19、1.09、0.99、0.92、0.87、0.75(s,21H,CH3×7)。
2.2.8 3,11-氧代-齐墩果烷型-12-烯-30-羧酸异丙酯(GA-II6)的制备根据化合物GA-II3的合成方法,与溴代异丙烷10 mL在室温下反应,粗品用柱色谱纯化,石油醚-醋酸乙酯(5∶1)洗脱,得到浅黄色固体42.6 mg,产率39.2%,mp 176.5~178.1 ℃。元素分析(%):C(77.38),H(9.74),O(12.68)。ESI-MS m/z:511.2 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.78(s,1H,H-12),3.78(m,1H,OCH),3.13~2.95(m,1H,H-2a),2.88~2.70(m,1H,H-2b),2.43(s,1H,H-9),2.10(t,1H,J=7.5 Hz,H-18),1.28(d,3H,J=7.5 Hz,OCHCH3a),1.20(d,J=7.5 Hz,3H,OCHCH3b),1.25、1.10、0.96、0.91、0.86、</ span> 0.83、0.75(s,21H,CH3×7)。
2.2.9 3,11-氧代-齐墩果烷型-12-烯-30-羧酸正丁酯(GA-II7)的制备根据化合物GA-II3的合成方法,与溴代正丁烷10 mL在室温下反应,粗品用柱色谱纯化,石油醚-醋酸乙酯(5∶1)洗脱,得到白色固体40.4 mg,产率36.2%,mp 183.4~184.7 ℃。元素分析(%):C(77.60),H(9.87),O(12.43)。ESI-MS m/z:525.4 [M+H]+。1H-NMR(500 MHz,CDCl3)δ:5.77(s,1H,H-12),3.65(t,J=7.5 Hz,2H,OCH2),3.16~2.98(m,1H,H-2a),2.90~2.75(m,1H,H-2b),2.43(,1H,H-9),2.10(t,1H,J=7.5 Hz,H-18),1.73(m,2H,OCH2),1.66(m,2H,OCH2CH2),1.51(t,3H,J=7.5 Hz,CH2CH3),1.27、1.15、0.96、0.91、0.87、0.80、0.76(s,21H,CH3×7)。
目标化合物GA-II1~II7的合成路线见图 2。
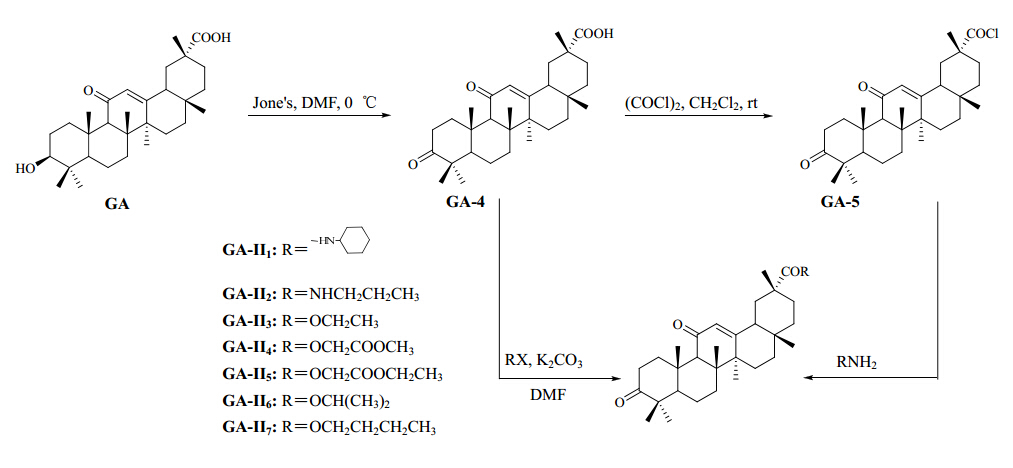 | 图 2 目标化合物GA-II1~II7的合成路线Fig. 2 Synthetic route of target compounds GA-II1~II7 |
以吉非替尼和紫杉醇为阳性对照药,采用SRB法对合成的甘草次酸衍生物进行初步的体外抗肿瘤活性测试。所选用的肿瘤细胞为人乳腺癌细胞MCF-7和人肺癌细胞A549。用SRB比色法测定化合物的细胞毒活性。对数生长期肿瘤细胞培养于96孔培养板内,每孔100 μL(大约含6 500个细胞),置于37 ℃、5% CO2恒温箱中培养。培养24 h后给药组加入含有不同浓度的测试物,每个组设3个复孔。加入等体积含有1%二甲基亚砜的RPMI-1640培养基为空白对照组,置于37 ℃、5% CO2恒温箱中培养。48 h后弃培养液,每孔加100 μL预冷的三氯乙酸,置于−4 ℃冷藏1 h,冷水清洗5次后,SRB于37 ℃恒温染色30 min。在酶标仪波长570 nm条件下测定吸光度(A)值,计算药物对细胞的生长抑制率(IR),并计算半数抑制浓度IC50值,实验重复3次,结果取平均值。见表 1。
| 表 1 目标化合物对MCF-7、A549的细胞毒活性 Table 1 Cytotoxic effects of target compounds against MCF-7 and A549 cells |
IR=1-(A加药组-A空白组)/(A对照组-A空白组)
由表 1数据可知,目标化合物对MCF-7和A549两种细胞增长均具有一定的抑制作用。其中化合物GA-I1、GA-I2和GA-II1对MCF-7和A549两种细胞表现出很好的抑制活性,GA-I1对MCF-7和A549细胞的抑制率分别为71.57%、24.91%。GA-I2对MCF-7和A549两种细胞的抑制率分别为40.33%、20.17%。
对MCF-7和A549两种细胞的抑制率分别为48.27%、37.25%,明显高于甘草次酸,且对此两种细胞的抑制活性高于临床常用药吉非替尼。因此,C3位羟基酯化,A环并环氧乙烷环,同时C30位羧基成酯和酰胺可以提高其抗肿瘤活性。
3 讨论初步药理实验结果表明,甘草次酸C3位羟基氧化成羰基或A环并环氧乙烷环,同时C28位羧基成酯或酰胺,对其体外抗肿瘤活性有显著提高。进一步分析,化合物I系列对MCF-7和A549肿瘤细胞的抑制活性:GA-I1>GA-I2>GA-I3>GA-I4>GA-I5,可见C30位羧基引入酯基碳链的增长或引入支链可能对抑制肿瘤细胞活性不利。化合物GA-II1、GA-II2对MCF-7和A549肿瘤细胞的抑制活性明显高于GA-II3~II7,所以,C30位羧基引入酰胺基团对肿瘤的抑制活性有可能高于使其成酯类所得化合物。这对进一步的甘草次酸结构修饰和抗肿瘤活性的研究具有一定的指导意义,为今后研究和开发高效低毒的抗肿瘤药物打下良好的基础。
| [1] | Hattori M, Sakamoto T, Kobashi K, et al. Metabolism of glycyrrhizin by human intestinal flora [J]. Planta Med, 1983, 48(1): 38-42. |
| [2] | Ruzicka L. Sexual hormones: Synthetic preparation of the male sexual hormones trans-dehydroandrosterone and androstene-3,17-dione [J]. Helv Chim Acta, 1935, 18: 86-95. |
| [3] | 康 蕾, 李学强, 王凤荣. 18β-甘草次酸结构修饰及生物活性研究进展 [J]. 中草药, 2012, 43(7): 1430-1440. |
| [4] | 申利红, 张奕华, 赖宜生, 等. NO供体型硝酸酯类甘草次酸衍生物的合成及抗肿瘤活性 [J]. 中国药科大学学报, 2011, 42(1): 34-38. |
| [5] | 木合布力·阿布力孜, 王永波, 马红艳, 等. 18α(18β)-甘草次酸30位酰胺衍生物的合成工艺研究 [J]. 华西药学杂志, 2013, 28(6): 553-556. |
| [6] | 王 军, 胡小丽, 文伟河, 等. 甘草次酸3位氨基酸衍生物的合成及其抑菌活性 [J]. 应用化学, 2012, 29(8): 873-877. |
| [7] | 杨晓辉, 刘利军, 任彬彬, 等. 甘草次酸3位酯类衍生物的合成及其抗炎活性的研究 [J].华西药学杂志, 2009, 24(3): 221-223. |
| [8] | 王 趱. 甘草次酸及其衍生物的研究与应用 [J]. 辽宁化工, 2006, 35(6): 347-349. |
| [9] | Meng Y Q, Wang X L, Song Y L, et al. Synthesis of novel glycyrrhetinic acid analogues [J]. ICBBE, 2010, 6: 52-60. |
| [10] | 孟艳秋, 杨 哲, 张 萌, 等. 甘草次酸C3, C11, C30衍生物的合成及其体外抗肿瘤活性研究 [J]. 现代药物与临床, 2014, 29(1): 6-10 . |
| [11] | Meng Y Q, Liu D, Cai L L, et al. Synthesis of ursolic acid derivatives with cytotoxic activity and the investigation of their preliminary mechanism of action. [J]. Bioorg Med Chem, 2009, 17(2): 848-854. |
| [12] | Meng Y Q, Song Y L, Yan Z, et al. Synthesis and in vitro cytotoxicity of novel ursolic acid derivatives [J]. Molecules, 2010, 15(6): 4033-4040. |
 2015, Vol. 30
2015, Vol. 30

