磺达肝癸钠是一种人工合成的肝素五糖类药物,英文名为fondaparinux sodium,是由法国Sanofi Winthrop Industrie研制生产的第一个抗凝血酶依赖性的Xa因子的间接抑制剂[1, 2]。化学结构式见图 1(用D、E、F、G、H分别代表从左至右的5个单糖)。
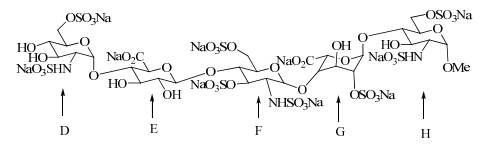 | 图 1 磺达肝癸钠的化学结构式Fig. 1 Chemical structure of fondaparinux sodium |
因磺达肝癸钠具有巨大的市场需求及广阔的市场前景,越来越多的学者研究磺达肝癸钠的合成,国内外有多种合成磺达肝癸钠的方法。但文献中普遍使用到一些昂贵原料以及叠氮钠等危险品,很难达到大规模工业化生产的要求。此外,偶联反应建立糖苷键时会产生异构体,使收率降低,而且不易纯化[3]。因此,课题组设计了磺达肝癸钠EF段中间体的合成,选择相对廉价的原料和安全的合成路线,使其能够实现工业化生产。利用1H-NMR和MS确证了该化合物的结构,并通过HPLC检测质量分数可达99%以上,可以为磺达肝癸钠和其他多糖合成提供重要的中间体原料。合成路线见图 2。
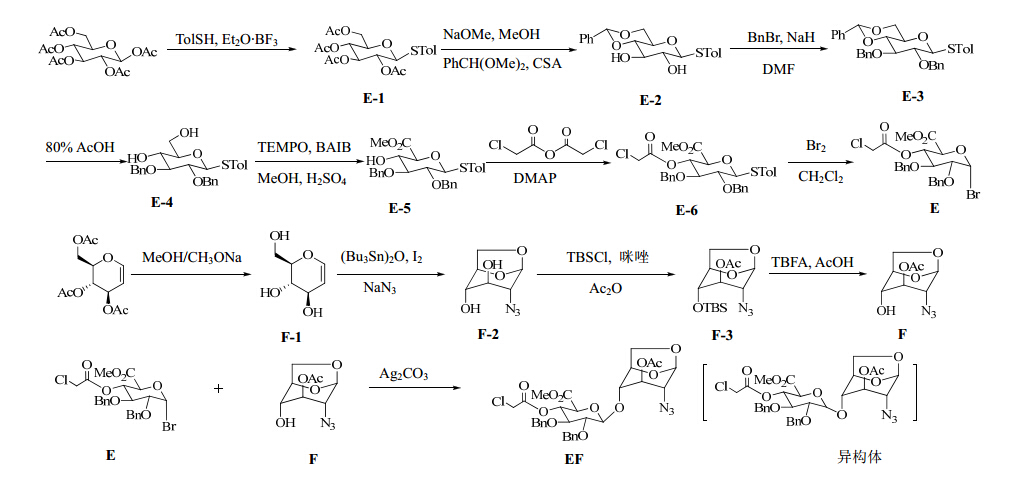 | 图 2 磺达肝癸钠中间体EF的合成路线Fig. 2 Synthetic route of fondaparinux sodium intermediate EF |
Waters e2695-2998系列高效液相色谱仪(美国Waters公司);Agilent 6520 Q-TOF液质联用仪(美国安捷伦科技公司);Bruker Avance 400 MHz型核磁共振波谱仪(德国Bruker公司);β-1,2,3,4,6-五乙酰基葡萄糖(质量分数≥98%)、3,4,6-三乙酰-D-葡萄糖烯(质量分数≥98%)均购自北京凯森莱医药科技有限公司;酸性离子交换树脂(天津南开和成科技有限公司);其他试剂均为国产分析纯。
2 方法与结果 2.1 6-甲基-2,3-O-二苄基-4-O-氯乙酰基-1-溴代- β-D-吡喃葡萄糖醛酸(E)的合成 2.1.1 苯基-2,3,4,6-O-四乙酰基-1-硫代-β-D-吡喃葡萄糖(E-1)的合成反应瓶中加入β-1,2,3,4,6-五乙酰基葡萄糖(1 000.0 g,2.56 mol)、对甲基苯硫酚(TolSH,381.5 g,3.08 mol)、二氯甲烷5 L,冰浴下滴加三氟化硼乙醚(1 290 mL,10.26 mol),室温反应3 h。加入饱和碳酸氢钠溶液淬灭反应,取有机层,无水硫酸钠干燥,滤过,旋蒸至干。石油醚3 L、醋酸乙酯1.2 L重结晶,滤过,干燥,得化合物E-1(960.0 g),收率82.6%。1H-NMR(400 MHz,CDCl3)δ:1.99(s,3H),2.02(s,3H),2.09(s,6H),2.35(s,3H),3.70(t,1H,J=4.8、7.2 Hz),4.16~4.24(m,2H),4.63(d,1H,J=10.0 Hz ),4.94(t,1H,J=9.2、10.0 Hz),5.03(t,1H,J=9.6、10.0 Hz),5.21(d,1H,J=9.6 Hz),7.13(d,2H,J=7.6 Hz),7 . 39(d,2H,J=7.6 Hz)。
2.1.2 苯基-4,6-O-苯亚甲基-1-硫代-β-D-吡喃葡萄糖(E-2)的合成反应瓶中加入化合物E-1(960.0 g,2.11 mol)、无水甲醇4 L、二氯甲烷1 L、甲醇钠(35.0 g,0.65 mol),室温反应3 h。加入酸性离子交换树脂300 g,搅拌,滤过,旋蒸至干,加入N,N-二甲基甲酰胺2.5 L、二甲氧基苯甲缩醛(480 mL,3.17 mol)、樟脑磺酸(CSA,49.1 g,0.21 mol),室温反应5 h。加入蒸馏水8 L、醋酸乙酯4 L萃取,取有机层,无水硫酸钠干燥,滤过,旋蒸至干。无水乙醇1 L重结晶,滤过,干燥,得化合物E-2(476.7 g),收率60.2%。1H-NMR(400 MHz,CDCl3)δ:2.35(s,3H),3.42(t,1H,J=8.8、9.6 Hz),3.49(d,2H,J=8.4 Hz),3.74~3.84(m,2H),4.37(dd,1H,J=2.0、10.4 Hz),4.55(d,1H,J=9.6 Hz),5.51(s,1H),7.14(d,2H,J=8.0 Hz),7.35~7.38(m,3H),7.42~7.48(m,4H)。
2.1.3 苯基-2,3-O-二苄基-4,6-O-苯亚甲基-1-硫代- β-D-吡喃葡萄糖(E-3)的合成反应瓶中加入E-2(476.7 g,1.27 mol)、N,N-二甲基甲酰胺(DMF)2 L,冰浴下加入氢化钠(203.6 g,5.09 mol)、溴化苄(521.2 g,3.05 mol),室温反应4 h。先加入醋酸乙酯4 L,再滴加蒸馏水4 L淬灭反应,滤过,取有机层,无水硫酸钠干燥,滤过,旋蒸至干。无水乙醇打浆(1 L×3),干燥,得化合物E-3(646.3 g),收率91.7%。1H-NMR(400 MHz,CDCl3)δ:2.34(s,3H),3.44~3.50(m,2H),3.38(dd,1H,J=4.8、10.4 Hz),3.68(t,1H,J=9.2、9.6 Hz),3.80(m,2H),4.09(d,1H,J=9.6 Hz),4.77(d,1H,J=11.2 Hz),4.81(d,1H,J=10.4 Hz),4.87(d,& lt; span lang="EN-US">1H,J=10.4 Hz),4.94(d,1H,J=11.2 Hz),5.58(s,1H),7.12(d,2H,J=8.0 Hz),7.25~7.47(m,17H)。
2.1.4 苯基-2,3-O-二苄基-1-硫代-β-D-吡喃葡萄糖(E-4)的合成反应瓶中加入E-3(646.3 g,1.16 mol)、80%醋酸水溶液4.8 L,80 ℃反应5 h。旋蒸至干,饱和碳酸氢钠溶液洗涤,二氯甲烷4 L萃取,取有机层,无水硫酸钠干燥,滤过,旋蒸至干。无水乙醇打浆(1 L×2),干燥,得化合物E-4(437.3 g),收率80.9%。1H-NMR(400 MHz,CDCl3)δ:2.33(s,3H),3.31(m,1H),3.44(t,1H,J=9.2 Hz),3.50(t,1H,J=8.8 Hz),3.56(t,1H,J=9.2 Hz),3.73(dd,1H,J=5.2、12.0 Hz),3.85(dd,1H,J=3.2、12.0 Hz),4.65(d,1H,J=9.6 Hz),4.70~4.75(m,2H),4.94(dd,2H,J=2.4、10.0 Hz),5.58(s,1H),7.11(d,2H,J=8.0 Hz),7.29~7.43(m,12H)。
2.1.5 苯基-6-甲基-2,3-O-二苄基-1-硫代-β-D-吡喃葡萄糖醛酸(E-5)的合成反应瓶中加入E-4(437.3 g,0.94 mol)、2,2,6,6-四甲基哌啶氧化物(TEMPO,29.6 g,0.19 mol)、二乙酸碘苯(BAIB,756.7 g,2.35 mol)、二氯甲烷4 L、蒸馏水2 L,室温避光反应5 h。加入饱和硫代硫酸钠溶液8 L淬灭反应,再加入甲基叔丁基醚4 L萃取,取有机层,无水硫酸钠干燥,滤过,旋蒸至干,加入无水甲醇2 L、浓硫酸20 mL,加热回流反应5 h。旋蒸至干,硅胶色谱柱纯化,先用石油醚-醋酸乙酯(10∶1)洗脱,再用石油醚-醋酸乙酯(5∶1)洗脱,得化合物E-5(307.0 g),收率66.1%。1H-NMR(400 MHz,CDCl3)δ:2.37(s,3H),3.49(t,1H,J=9.2 Hz),3.62(t,1H,&l t;/ span>J=8.4 Hz),3.84~3.94(m,5H),4.66(d,1H,J=10.0 Hz),4.78(d,1H,J=10.4 Hz),4.90(s,2H),4.93(s,1H),7.15(d < span st="" yle='font-family: 宋体'>,2H,J=8.0 Hz),7.34~7.52(m,12H)。
2.1.6 苯基-6-甲基-2,3-O-二苄基-4-O-氯乙酰基-1-硫代-β-D-吡喃葡萄糖醛酸(E-6)的合成反应瓶中加入E-5(307.0 g,0.62 mol)、氯乙酸酐(159.1 g,0.93 mol)、二氯甲烷1.5 L、4-二甲氨基吡啶(3.7 g,0.03 mol),室温反应5 h。旋蒸至干,加入醋酸乙酯5 L、蒸馏水5 L萃取,取有机层,无水硫酸钠干燥,滤过,旋蒸至干。无水甲醇1 L重结晶,滤过,干燥,得化合物E-6(296.7 g),收率83.8%。1H-NMR(400 MHz,CDCl3)δ:2.34(s,3H),3.54(t,1H),3.67~3.69(m,2H),3.73(s,3H),3.81(d,1H,J=14.8 Hz),3.90(d,1H,J=9.6 Hz),4.59~4.65(m,2H),4.71(d,1H,J=10.0 Hz),4.82(d,1H,J=11.6 Hz),4.90(d,1H,J=10.0 Hz),5.14(t,1H,J=9.6 Hz),7.13(d,2H,J=8.0 Hz),7.22~7.41(m,10H),7.48(d,2H,J=8.0 Hz)。
2.1.7 6-甲基-2,3-O-二苄基-4-O-氯乙酰基-1-溴代- β-D-吡喃葡萄糖醛酸(E)的合成反应瓶中加入E-6(296.7 g,0.52 mol)、0.4 nm分子筛296.7 g、无水二氯甲烷1 L,氮气保护下滴加溴素(37 mL,0.73 mol),室温反应1 h。滤过,加入饱和硫代硫酸钠溶液1 L淬灭反应,取有机层,无水硫酸钠干燥,滤过,旋蒸至干,硅胶色谱柱纯化,石油醚-醋酸乙酯(5∶1)洗脱,得化合物E(238.0 g),收率86.7%。1H-NMR(400 MHz,CDCl3)δ:3.59~3.62(m,1H),3.70(s,3H),3.73(s,1H),3.85(d,1H,J=14.8 Hz),4.01(t,1H,J=9.6 Hz),4.47(d,1H,J=10.4 Hz),4.65~4.76(m,3H),4.90(d,1H,J=11.6 Hz),5.13(dd,1H,J=9.6 Hz),6.31(d,1H,J=4.0 Hz),7.25~7.38(m,10H)。
2.2 化合物2-O-乙酰基-1,6-脱水-2-叠氮-2-脱氧-4-羟基-β-D-吡喃葡萄糖(F)合成 2.2.1 3,4,6-三羟基-D-葡萄糖烯(F-1)的合成反应瓶中加入3,4,6-三乙酰-D-葡萄糖烯(1 000.0 g,3.68 mol)、无水甲醇4 L、甲醇钠(20.0 g,0.37 mol),室温反应4 h。加入酸性离子交换树脂200 g,搅拌,滤过,旋蒸至干,得化合物F-1(484.2 g),收率90.2%。1H-NMR(400 MHz,CDCl3)δ:3.53(t,1H,J=8.0 Hz),3.72(m,3H),4.08(d,1H,J=6.8 Hz),4.65(d,1H,J=5.7 Hz),6.26(d,1H,J=5.8 Hz)。
2.2.2 3,4,6-三羟基-D-葡萄糖烯(F-2)的合成反应瓶中加入F-1(484.2 g,3.32 mol)、0.4 nm分子筛484.2 g、无水乙腈4 L,40 ℃搅拌30 min,氮气保护下滴加三丁基氧化锡(1855 ml,3.65 mol),加热回流反应4 h。冰浴下加入碘(1179.7 g,4.65 mol),升至室温搅拌过夜。滤过,旋蒸至干。加入正己烷4 L、饱和硫代硫酸钠溶液4 L萃取,取水层,旋蒸至干。加入无水乙醇4 L在50 ℃打浆30 min,滤过,无水硫酸钠干燥,滤过,旋蒸至干,加入N,N-二甲基甲酰胺2.5 L、叠氮钠(280.8 g,4.32 mol)、蒸馏水500 mL,加热回流反应6 h。降至室温,无水硫酸钠干燥,布氏漏斗加入100~200目硅胶约3 cm,硅藻土约1 cm,滤过,用N,N-二甲基甲酰胺600 mL洗涤滤饼,滤液浓缩剩余约2 L,加入蒸馏水6 L,200 g碳酸钾,加入正丁醇6 L萃取,水相加入冰,用次氯酸钠3 L处理残留的叠氮钠;取有机层,无水硫酸钠干燥,滤过,加入活性炭100 g脱色,滤过,旋蒸至干。用二氯甲烷2 L溶解,滤过,滤饼加冰水冲洗,用次氯酸钠200 mL处理残留的叠氮钠;滤液用硅胶色谱柱纯化,先用二氯甲烷-甲醇(150∶1)洗脱,再用二氯甲烷-甲醇(50∶1)洗脱,得化合物F-2(224.1 g),收率36.2%。1H-NMR(400 MHz,CDCl3)δ:2.45(d,1H,J=6.9 Hz),2.61(d,1H,J=9.6 Hz),3.52(m,1H),3.66(d,1H,J=9.6 Hz),3.80(dd,1H,J=7.4、5.4 Hz),3.90(m,1H),4.2 1(d,1H,J=7.4 Hz),4.58(d,1H,J=5.4 Hz),5.51(s,1H)。
2.2.3 2-O-乙酰基-1,6-脱水-2-叠氮-2-脱氧-4-叔丁基三甲基硅烷基-β-D-吡喃葡萄糖(F-3)的合成反应瓶中加入F-2(224.1 g,1.20 mol)、N,N-二甲基甲酰胺1 L、咪唑(326.0 g,4.79 mol),冰浴下加入叔丁基二甲基氯硅烷(TBSCl,234.8 g,1.56 mol),升至室温反应过夜。加入蒸馏水2.5 L、醋酸乙酯2.5 L萃取,取有机层,无水硫酸钠干燥,滤过,加入活性炭45 g脱色,滤过,旋蒸至干,加入二氯甲烷1.5 L、4-二甲氨基吡啶(14.5 g, 0.12 mol),冰浴下加入乙酸酐(140 mL,1.47 mol),升至室温反应2 h。加入饱和氯化钠溶液500 mL洗涤,取有机层,无水硫酸钠干燥,滤过,旋蒸至干。无水乙醇打浆(300 mL×2),干燥,得化合物F-3(284.4 g),收率69.2%。1H-NMR(400 MHz,CDCl3)δ:0.15(s,3H),0.18(s,3H),0.96(s,9H),2.13(s,3H),3.07(s,1H),3.61(s,1H),3.79(dd,1H,J=5.9、7.4 Hz),4.03(d,1H,J=7.5 Hz),4.48(d,1H,J=5.4 Hz),4.86(s,1H),5.53(s,1H)。
2.2.4 化合物2-O-乙酰基-1,6-脱水-2-叠氮-2-脱氧- 4-羟基-β-D-吡喃葡萄糖(F)的合成反应瓶中加入F-3(284.4 g,0.83 mol)、四氢呋喃1 L、冰乙酸(78 mL,1.24 mol)、四丁基氟化铵(529.1 g,2.03 mol),30 ℃反应5 h。旋蒸至干,加入二氯甲烷500 mL、蒸馏水300 mL萃取,取有机层,无水硫酸钠干燥,滤过,旋蒸至干,硅胶柱色谱纯化,先用石油醚-醋酸乙酯(4∶1)洗脱,再用石油醚-醋酸乙酯(1∶1)洗 脱,得化合物F(172.9 g),收率91.1%。1H-NMR(400 MHz,CDCl3)δ:2.14(s,3H),3.50(s,1H),3.64(s,1H),3.84(t,1H),4.13(d,1H,J=7.6 Hz),4.61(d,1H,J=5.6 Hz),4.87(s,1H),5.45(s,1H)。
2.3 O-(6-甲基-2,3-O-二苄基-4-O-氯乙酰基-β-D-吡喃葡萄糖醛酸)-(1→4)-2-O-乙酰基-1,6-脱水-2-叠氮- 2-脱氧-β-D-吡喃葡萄糖(EF)合成反应瓶中加入化合物E(238.0 g,0.45 mol)、0.4 nm分子筛238.0 g、Ag2CO3(223.1 g,0.81 mol)、无水二氯甲烷1 L,氮气保护下搅拌30 min,再加入化合物F(123.9 g,0.54 mol),室温避光反应3 d。滤过,硅胶柱色谱纯化,先用石油醚-醋酸乙酯(3∶1)洗脱,再用二氯甲烷-甲醇(100∶1)洗脱,得化合物EF粗品。无水甲醇1.5 L重结晶,滤过,干燥,得化合物EF(191.4 g)及其少量的异构体,收率为62.8%。该合成路线的总收率为11.1%。HPLC归一法测得质量分数为99.01%。分子式为C31H34ClN3O12,ESI-MS m/z:693.217 2 [M+NH4]+。1H-NMR(400 MHz,CDCl3)δ:2.13(s,3H),3.26(s,1H),3.67~3.71(m,4H),3.75(s,3H),3.80~3.87&l t;/ span>(m,2H),3.98(d,1H,J=14.0 Hz),4.03(d,1H,J=7.6 Hz),4.60(d,1H,J=5.2 Hz),4.65(d,1H,J=11.6 Hz),4.70(d,1H,J=6.8 Hz),4.81(d,1H,J=10.8 Hz),4.87(d,1H,J=11.6 Hz),5.03(d,1H,J=11.2 Hz),5.21(dd,1H,J=10.0、9.2 Hz),5.30(s,1H),5.53(s,1H),7.26~7.41(m,10H)。
色谱条件:岛津Inertsil C8-3色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇-水(70∶30);体积流量为1.0 mL/min;柱温为30 ℃;检测波长为220 nm。
在上述色谱条件下,化合物EF的保留时间为21.02 min,其异构体的保留时间为23.75 min,见图 3。
 | 1-化合物EF 2-EF异构体 1-compound EF 2-isomer of EF图 3 化合物EF+异构体(A)和化合物EF(B)的HPLCFig. 3 HPLC of compound EF + isomer (A) and compound EF (B) |
本课题组针对磺达肝癸钠的二糖中间体进行了合成研究,对文献中部分工艺进行优化,使其适合工业化生产。如由化合物E-4合成化合物E-5时,采用TEMPO氧化后做甲酯,而文献使用了剧毒品、危险品重氮甲烷[4, 5]或碘甲烷[6],选用甲醇和浓硫酸回流反应,在保证收率和质量的条件下,降低了成本,提高了安全性;由化合物E-6合成化合物E做供体时,选用常规试剂溴素代替文献[6]中的溴化碘,以及文献[7]中的N-碘代丁二酰亚胺(NIS),降低了成本;化合物F-2合成化合物F-3上叠氮保护基时,对比文献[8]减少了叠氮钠的用量,由10.0 mol降低到1.3 mol,且优化了后处理过程,淬灭残留的叠氮钠,保证反应的安全性,使其能够达到大规模生产的要求。
单糖E和单糖F偶联时会生成异构体杂质,若带入后面的偶联反应中,会产生更多的异构体,造成收率降低,纯化更加困难。因此,摸索了EF粗品的重结晶工艺,且建立了HPLC分析方法,对异构体进行严格控制。
| [1] | 陈旭华, 梁 岩, 杨艳敏, 等. 新一代抗血栓药物: Fondapar inux磺达肝癸钠 [J]. 中国分子心脏病学杂志, 2007, 7(5): 300-303. |
| [2] | 张 谦, 朱 珠. ArixtraTM [J]. 中国新药杂志, 2003, 12(4): 301-302. |
| [3] | Bauersachs R M. Fondaparinux: an update on new study results [J]. Eur J Clin Invest, 2005, 35(1): 27-32. |
| [4] | Zhou Y, Lin F, Chen J, Yu B. Toward synthesis of the regular sequence of heparin: synthesis of two tetra-saccharide precursors [J]. Carbohydr Res, 2006, 341(10): 1619-1629. |
| [5] | van den Bos L J, Codée J D, van der Toorn J C, et al. Thioglycuronides: synthesis and application in the assembly of acidic oligosaccharides [J]. Org Lett, 2004, 6(13): 2165-2168. |
| [6] | Li T, Ye H, Cao X, et al. Total synthesis of anticoagulant pentasaccharide fondaparinux [J]. Chem Med Chem, 2014, 9(5): 1071-1080. |
| [7] | Arungundram S, Al-Mafraji K, Asong J, et al. Modular synthesis of heparan sulfate oligosaccharides for structure-activity relationship studies [J]. J Am Chem Soc, 2009, 131(47): 17394-17405. |
| [8] | Ganguli A R S, Coward J. α:β Selectivity in the synthesis of 3-substituted, 4-methyl umbelliferone glycosides of N-acetyl glucosamine and chitobiose [J]. Tetrahedron Asymmetry, 2005, 16(2): 411-424. |
 2015, Vol. 30
2015, Vol. 30

