2. 天津药物研究院, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
苦参碱是一种喹诺里西啶类生物碱,主要来源于豆科植物苦豆子Sophora alopecuroides Linn.、苦参S. flavescens Alt.的全株和越南槐S. tonkinensis Gagnep.的根茎。苦参作为药用植物,最早记录于《神农本草经》,被列为上品,在我国沿用两千多年,具有清热、利尿、杀虫、祛湿之功效[1]。苦参碱是苦参中最主要的生物碱,具有镇痛、抗炎、抗菌、杀虫、抗病毒和抗肿瘤等活性,并制成复方苦参注射液应用与临床[2, 3]。苦参碱结构中含有5S,6S,7R,11R 4个碳手性中心和2个氮手性中心,具有独特的空间立体结构,其结构见图 1。苦参碱水溶性好,可溶于大部分有机溶剂。苦参碱具有液体和固体两种物理形态,其中至少包括α、β、δ 3种晶型。1-位氮原子可以被过氧化物氧化为氧化苦参碱,氧化苦参碱在体内可以转化为苦参碱,也可以由还原剂还原得到苦参碱。近年来研究发现,苦参碱在体内外均具有确切的抗肿瘤活性,通过多种作用机制发挥抗肿瘤作用[4, 5],如抑制肿瘤细胞的增殖、诱导肿瘤细胞凋亡、促进肿瘤细胞分化、抑制端粒酶的活性、抑制肿瘤新生血管的形成、抑制肿瘤细胞迁移、逆转肿瘤多药耐药、调控肿瘤细胞自噬以及调节免疫等。但是由于苦参碱水溶性大,在体内消除过程非常快,产生活性的时间短暂,影响了其药效的发挥。苦参碱的结构改造及衍生化可以改善其理化性质,提高药效。因此对苦参碱进行结构改造,改变其理化性质和增加其在体内的作用时间具有重要意义。
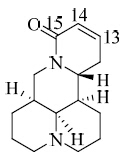 | 图 1 苦参碱的化学结构Fig. 1 Chemicalstructure of matrine |
本文主要综述了苦参碱在抗肿瘤方面的结构改造及其活性。苦参碱的结构改造主要集中在改变其脂水分配系数、调节脂溶性方面,在结构分类上,主要有13-单取代衍生物、14-单取代衍生物、15-位羰基改造衍生物、内酰胺环开环的苦参酸衍生物以及苦参碱拼合物等主要类型。
1 13-单取代苦参碱
苦参碱与槐果碱具有相同的碳手性中心,通过在槐果碱13,14-位双键进行Michael加成反应可以得到13-位单取代的苦参碱。王鹏等[6]以槐果碱为原料,经过双键的加成反应,得到13-羟乙基苦参碱,然后通过酯化反应得到两个系列的酯类苦参碱衍生物,见图 2。对人肝癌细胞HepG2的活性抑制实验显示,13-羟乙基苦参碱的烷基羧酸酯几乎没有抗肿瘤活性,其苯甲酸酯和4-氯苯甲酸酯活性优于苦参碱。苯甲酸酯结构具有高的脂溶性,苦参碱结构具有好的水溶性,整体分子形成了“疏水端+亲水端”的结构,提高了分子对作用靶点的亲和力。这些结构上的改变使整个分子的理化性质发生了变化,这可能与抗肿瘤活性的提高有关。
 | 图 2 苦参碱13-取代衍生物的结构Fig. 2 Structures of 13-substituted matrinederivatives |
苦参碱具有酰胺羰基,可以通过形成烯醇中间体对某些亲电体进行加成,与羰基化合物可以发生Claisen缩合反应。Wang等[7]利用芳基甲酸酯和苦参碱在氢化钠的作用下,得到了3个14-芳甲酰基苦参碱,发现抗肿瘤活性与苦参碱相比有所提高;该课题组在苦参碱14-位通过Claisen-Schmidt反应引入苯亚甲基衍生物,合成了3个14-芳甲酰基苦参碱,该类化合物对黑色素瘤细胞B16~F10等4株肿瘤细胞的增殖具有抑制作用,14-位芳环的引入增强了其抗肿瘤活性;该课题组也合成了一系列14-磺胺取代的苦参碱,未见活性报道[8]。何雄[9]采用类似的方法以吡啶醛代替苯甲醛,丰富了该类苦参碱衍生物的结构,发现14-位吡啶取代的苦参碱对前列腺癌细胞PC-3具有较为明显的生长抑制活性,并且活性优于苦参碱。冉炜[10]利用二异丙基氨基锂与苦参碱形成烯醇中间体,再与溴代烷烃反应,合成了一系列14-烷基取代苦参碱衍生物,在H22移植瘤模型中对抗肿瘤活性进行评价,发现这些衍生物均具有不同程度的抗肿瘤活性,其中14-苄基取代的苦参碱活性高于14-烷烃取代的衍生物,并且发现苯环上电子云密度与抗肿瘤活性相关。韦星船等[11]采用与Wang等[7]类似的方法合成了一系列14-芳香基取代的苦参碱衍生物,实验显示对结肠癌细胞HT-29和胰腺癌细胞PANC-1的增殖抑制作用较苦参碱有所提高。苦参碱14-位单取代可以提高其抗肿瘤活性。14-位含有芳香基团的取代基(苄基、苯亚甲基和芳甲酰基)取代的衍生物活性高于14-烷基取代的衍生物,提示该位置可能与作用靶点之间具有π-π相互作用,芳香基团的存在增强了衍生物与靶点的亲和力。苦参碱14-单取代衍生物的结构见图 3。
 | 图 3 苦参碱14-单取代衍生物的结构Fig. 3 Structuresof 14-substituted matrine derivatives |
苦参碱15-位羰基氧原子可以被硫原子取代或被还原为亚甲基。何黎琴等[12]利用四氢铝锂还原苦参碱15-位羰基得到了去氧苦参碱,并测试了化合物对肝癌细胞HepG2和SMMC7721的抑制活性,实验结果显示,去氧苦参碱具有显著的抑制这两种细胞生长的活性,半抑制浓度(IC50)分别为0.77、0.70mg/mL,优于苦参碱(IC50分别为2.1、2.5 mg/mL);并且发现去氧苦参碱对肿瘤细胞的抑制作用具有剂量相关性(0.25~2.0 mg/mL)。何雄[9]利用Lawesson试剂将苦参碱的酰胺羰基硫代,得到了15-硫代苦参碱,发现硫代可以提高苦参碱对前列腺癌细胞PC-3的抑制活性。苦参碱15-位去氧或硫代增加了分子的脂溶性,说明增加苦参碱分子喹诺里西啶结构的脂溶性可以提高其抗肿瘤活性。苦参碱15-位改造衍生物的结构见图 4。
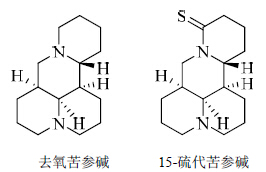 | 图 4 苦参碱15-位改造衍生物的结构Fig. 4 Structureof 15-modified matrine derivative |
苦参酸是苦参碱酰胺环开环后形成的羧酸衍生物。Wang等[7]将苦参碱的酰胺环开环得到苦参酸将其成酯和成酰胺衍生化后发现抗肿瘤活性比苦参碱弱,说明酰胺环对苦参碱发挥抗肿瘤活性是必需的。He等[13, 14]设计和合成了一系列NO工体的苦参酸衍生物,证明该类化合物对HepG2细胞的增殖抑制活性远远高于苦参碱,部分化合物活性好于阳性对照药5-氟尿嘧啶。孙云龙[15]将取代水杨酸与苦参酸拼合得到一系列苦参酸衍生物,对肝癌细胞7402和直肠癌细胞RKO的抗肿瘤活性实验显示,大部分化合物的活性与苦参碱相当或更优,部分活性好于阳性对照药顺铂。梁鹏云[16]合成了多个系列的哌嗪类苦参酸衍生物,部分化合物在体外抗肿瘤活性试验中和小鼠H22移植瘤模型实验中均表现出一定的抗肿瘤活性,优于苦参碱和对照药环磷酰胺,表明16-位氮原子上哌嗪基团能与喹诺里西啶结构发挥协同作用,提高活性。16-位氮原子取代的同时对苦参酸羧酸进行药效团拼合可以发挥喹诺里西啶环和拼合药效团之间的协同作用,提高抗肿瘤活性。苦参碱内酰胺环开环衍生物的结构见图 5。
 | 图 5 苦参碱内酰胺环开环衍生物的结构Fig. 5 Structures ofof ring-opening matrine derivatives |
拼合物是将药动学或药动学性质上具有协同作用的药物分子通过化学键结合在一个分子内,生成具有相同药效或协同药效的一类新化合物。王鹏等[17]以槐果碱为原料合成13-羟基(氨基)乙氧基苦参碱,然后与氮芥拼合得到4个新型的拼合物,未见相关活性报道。张娜等[18]将18α-甘草次酸和18β-甘草次酸与13-羟基乙氧基苦参碱缩合成酯,得到甘草次酸–苦参碱复合物,对人乳腺癌细胞MCF-7和人肝癌细胞SMMC-7721的抗肿瘤活性实验显示复合物的活性要明显高于甘草次酸、苦参碱和阳性对照药美法仑。笔者将苦参碱与查尔酮结构杂化在一起,得到多个系列的苦参碱–查尔酮杂化物,CCK-8实验显示,某些杂化物对人肺癌细胞A549、人乳腺癌细胞MCF-7、人肝癌细胞Bel-7402和人宫颈癌细胞HeLa具有较为明显的生长抑制作用,多个化合物对测试肿瘤株的IC50值达到mmol/L级别,活性远远好于苦参碱和查尔酮[19]。将苦参碱与其他活性药物拼合,可以互为药效团,发挥两者之间的协同效应,显著提高抗肿瘤活性。苦参碱拼合物的结构见图 6。
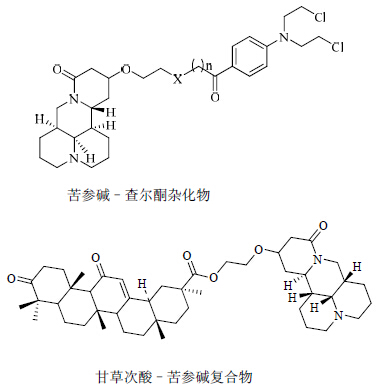 | 图 6 苦参碱拼合物的结构Fig. 6 Structuresof matrine conjugate |
苦参碱及其衍生物对多种肿瘤细胞都表现出良好的抗肿瘤活性,涉及到多种作用机制,是近几年研究的热点。但苦参碱水溶性极好,导致其在体内消除非常快,发挥药效的时间比较短。对苦参碱进行结构改造可以调整苦参碱的脂水分配系数,增加其在体内的作用时间,提高疗效;此外,结构改造有望提高其与作用靶标之间的亲和力,提高其生物活性。对苦参碱结构改造的研究总结有助于了解苦参碱产生活性的药效基础,指导发现活性更优、毒性更小的抗肿瘤苦参碱类似物。
| [1] | 顾关云, 肖年生, 蒋 昱. 苦参的化学成分、生物活性和药理作用 [J]. 现代药物与临床, 2009, 24(5): 265- 271. |
| [2] | 张 莹, 贾英杰, 金书晓. 复方苦参注射液对小鼠艾氏腹水癌的治疗作用 [J]. 药物评价研究, 2012, 35(5): 343-344. |
| [3] | 陈秀清. 复方苦参注射液治疗丙型肝炎肝硬化的临床疗效及其机制研究 [J]. 现代药物与临床, 2014, 29(5): 527-531. |
| [4] | 郭 斌, 申洪波, 李 智. 苦参碱对小鼠Lewis肺癌的影响 [J]. 中草药, 2010, 41(12): 2037-2039. |
| [5] | 邵明坤, 范 青. 苦参碱抗肿瘤作用研究的新进展 [J]. 实用药物与临床, 2014, 17(6): 756-759. |
| [6] | 王 鹏, 陶遵威, 郑晓辉, 等. 新型酯类苦参碱衍生物的合成与体外抗肿瘤活性 [J]. 中国新药杂志, 2012, 21(21): 2547-2551. |
| [7] | Wang L, You Y, Wang S, et al. Synthesis, characterization and in vitro anti-tumor activities of matrine derivatives [J]. Bioorg Med Chem Lett, 2012, 22(12): 4100-4102. |
| [8] | 王立升, 杨龙力, 刘 旭, 等. 苦参碱磺胺类拼合物的合成 [J]. 合成化学, 2015, 23(2): 15. |
| [9] | 何 雄. 新型苦参碱衍生物的合成及其抗肿瘤活性的研究 [D]. 广州: 广州大学, 2012. |
| [10] | 冉 炜. 苦参碱衍生物的合成及其体内抑制肝癌H22细胞活性研究 [D]. 南宁: 广西大学, 2012. |
| [11] | 韦星船, 郑 成, 何 雄, 等. 芳香基苦参碱衍生物的合成及抗肿瘤活性 [J]. 精细化工, 2013, 30(8): 936- 939. |
| [12] | 何黎琴, 黄 鹏, 王效山. 苦参碱衍生物的合成及抗肿瘤活性测试 [J]. 化学世界, 2011, 52(9): 523-525. |
| [13] | He L Q, Liu J, Yin D K, et al. Synthesis and biological evaluation of nitric oxide-releasing matrine derivatives as anticancer agents [J]. Chin Chem Lett, 2010, 21(4): 381- 384. |
| [14] | 何黎琴, 杨 琦, 顾宏霞, 等. 新型苦参碱衍生物杂合体的合成及抗肿瘤活性 [J]. 中国药物化学杂志, 2012, 22(6): 476-482. |
| [15] | 孙云龙. 水杨酸类苦参碱衍生物的合成及其抗炎和抗肿瘤活性研究 [D]. 南宁: 广西大学, 2014. |
| [16] | 梁鹏云. 哌嗪类苦参碱衍生物的合成及其抗肿瘤活性研究 [D]. 南宁: 广西大学, 2014. |
| [17] | 王 鹏, 陶遵威, 郑晓辉, 等. 氮芥型苦参碱前药的合成与表征 [J]. 化学试剂, 2012, 34(3): 208-215. |
| [18] | 张 娜, 崔晓燕, 赵秀梅, 等. 甘草次酸-苦参碱复合物的合成及其抗肿瘤活性研究 [J]. 现代药物与临床, 2014, 29(11): 1199-1202. |
| [19] | 赵力挥, 毛丽娜, 洪 阁, 等. 苦参碱-查尔酮杂化物的抗肿瘤活性研究 [C]. 天津市生物医学工程学会第三十四届学术年会论文集. 天津: 天津市生物医学工程学会, 2014: 25. |
 2015, Vol. 30
2015, Vol. 30


