2. 北京王府中西医结合医院, 北京 102209;
3. 内蒙古医科大学, 内蒙古 呼和浩特 010059
2. Beijing Royal Integrative Medicine Hospital, Beijing 102209, China;
3. Inner Mongolia Medical University, Hohhot 010059, China
1.1 动物
SPF级雄性SD大鼠41只,体质量160~190 g,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。动物饲养于北京中医药大学实验动物中心SPF实验室,室温20~25 ℃,相对湿度40%~70%,换气次数10~15次/h,12 h光照,昼夜循环。动物颗粒饲料喂养,自由摄食饮水。
1.2 药品
链脲佐菌素(Sigma公司,货号S0130);胰蛋白酶(规格1∶250,Amresco公司,货号1443 C193);羟苯磺酸钙胶囊,规格0.5 g/6粒,奥地利依比威药品有限公司,产品批号CD6512,用时配成33.4 mg/mL水溶液;复方血栓通胶囊,规格0.5 g/粒,广东众生药业股份有限公司,产品批号110401,用时配成0.105 g/mL水溶液。
1.3 试剂及仪器
TotalRNA提取试剂盒(批号0960602)、qPCR试剂盒(批号0960212),北京旷博生物技术有限公司。PCR引物由生工生物工程(上海)股份有限公司北京合成部合成。
美国BIO-RAD C1000 PCR扩增仪反转录仪,Real-Time PCR仪(AB公司),美国BIO-RAD7218 R04420凝胶成像系统。日立H-600电子显微镜。尼康公司NIS-Elements BR3.1图像分析系统。
2 方法2.1 动物模型的建立、分组与给药
SD大鼠适应性喂养2周后,禁食12 h,链脲佐菌素溶解于0.1 mmol/L柠檬酸钠缓冲液(冰盒中新鲜配制,pH 4.5),随机选取30只大鼠以65 mg/kg一次性ip链脲佐菌素诱导糖尿病模型。另设11只作为对照组,注射等量的溶剂(0.1 mmol/L柠檬酸钠溶液,pH 4.5)。一周后尾静脉采血检测血糖,以禁食6 h血糖≥16.7 mmol/L者为糖尿病模型。20周后抽取糖尿病模型大鼠和对照组大鼠各1只,取视网膜行电镜观察,确定视网膜病变形成,将糖尿病模型大鼠按体质量和血糖随机分为模型组、复方血栓通组(1.05 g/kg,相当于临床用药量的14倍)和羟苯磺酸钙组(0.334 g/kg,相当于临床用药量的14倍),另设对照组,均ig给药,1次/d,对照组给予等剂量蒸馏水,共12周。
2.2 指标检测2.2.1 Real-time PCR法检测Ⅳ型胶原及VEGF在视网膜组织中的表达
1%戊巴比妥钠注射液(50 mg/kg)ip麻醉大鼠,取出左侧眼球,沿角膜缘剪开眼球,去除角膜、晶状体和玻璃体,用眼科刀及弯镊将视网膜取出,迅速放入液氮中冷冻,后转入−80 ℃冰箱中储存。Trizol一步法提取总RNA。反转录反应体系:总RNA 3 μg,OligodT 1 μL,dNTP 2 μL,5×Buffer 4 μL,逆转录酶1 μL,加入经DEPC处理过的无菌水至20 μL;反应条件:42 ℃反应1 h,70 ℃ 5min终止反应。反应结束后,−20 ℃冰箱保存备用。从GenBank获得目的基因mRNA的全长序列,利用引物和探针设计软件Primer 5.0设计引物序列。经过Blast分析,引物序列具有特异性。以β-actin为内对照进行Real-time PCR反应。引物序列:β-actin上游5′-CAG CCA TGT ACG TAG CCATC-3′,下游5′-AGA GTACTT GCG CTC AGG AG-3′;Ⅳ型胶原上游:5′-CCA CAG ATA TCC GGT TCG CCTACA-3′;下游:5′-GCA CAC CCC ACA GCC AGC ACTAT-3′; VEGF上游5′-TAG ACC TCT CAC CGG AAAGAC-3′,下游5′-CAG GAATCC CAG AAA CAA AAC-3′。反应体系:cDNA 1 μL,mix 5 μL,引物0.8 μL,Rox0.2 μL,加DEPC水至10 μL。反应条件:95 ℃预变性5 min;95 ℃ 变性30 s,58 ℃退火1 min,72 ℃延伸30 s,共40个循环。反应结束后,读取每份样品中目的基因的Ct值,并与其β-actin基因的Ct值相减得出相对Ct值,以第1个相对Ct值为基线,后面的相对Ct值对其进行减法运算,得出n值后进行相对运算,运算法则为1/2n。校正后得到每份样品中Ⅳ型胶原及VEGF的相对表达量。
2.2.2 视网膜血管形态学观察
大鼠麻醉后,取大鼠右侧眼球,将眼球从睫状体后部经锯齿缘环形剪开虹膜,去除晶状体和眼前节部分,将后眼杯以视盘为中心橘瓣样剪成3块,取1块固定于4%多聚甲醛液72 h,固定后放入0.01 mmol/L PBS浸泡过夜,12 h后将视网膜放入3%胰蛋白酶液中37 ℃消化3~4 h,取出后放入蒸馏水中反复轻柔吹打,将透明的视网膜血管网平铺于洁净的载玻片上,自然晾干,进行PAS染色。光镜下观察视网膜血管形态学改变,采集图像后对视网膜血管铺片进行图像分析,测定视网膜毛细血管面积密度。
2.2.3 样品的电镜观察
大鼠麻醉后,取大鼠右侧眼球,从睫状体后部经锯齿缘环形剪开虹膜,去除晶状体和眼前节部分,将后眼杯以视盘为中心橘瓣样剪成3块,取其中1块置于2.5%戊二醛4 ℃固定;切取视网膜中央区组织2 mm2大小,固定于1%锇酸1 h,4 ℃;双蒸水冲洗4 min;梯度乙醇脱水;Epon 812 环氧树脂包埋;切1 µm半薄切片作光镜定位,再作超薄切片,经醋酸铀和枸橼酸铅双重染色,透射电镜观察并拍照。
2.3 统计学方法
实验数据用SPSS 20.0统计软件进行分析比较,计量资料采用`x ± s表示,多样本均数间比较采用单因素方差分析。
3 结果3.1 大鼠视网膜中Ⅳ型胶原和VEGF mRNA表达量的比较
与对照组比较,糖尿病模型组大鼠视网膜组织Ⅳ型胶原mRNA表达升高(P<0.05),VEGF mRNA表达升高(P<0.001)。与模型组比较,羟苯磺酸钙组、复方血栓通组Ⅳ型胶原mRNA和VEGF mRNA表达均降低(P<0.05)。结果见表 1。
| 表 1 大鼠视网膜中Ⅳ型胶原和VEGF mRNA的比较(x ± s,n=3) Table 1 Comparison of expressionof type Ⅳ collagen and VEGF mRNA in retinas of rats (x ± s, n=3) |
模型组大鼠视网膜毛细血管增生,排列紊乱,内皮细胞增生,周细胞减少,与对照组比较,毛细血管面积密度显著增高,差异具有统计学意义(P<0.001);羟苯磺酸钙组、复方血栓通组大鼠视网膜毛细血管的分布较为均匀,血管增生不明显,形态较规则,内皮细胞增生不明显。与模型组比较,毛细血管面积密度下降,差异具有统计学意义(P<0.05)。结果见表 2、图 1。
| 表 2 各组大鼠视网膜毛细血管的血管面积密度的比较(x ± s) Table 2 Comparison on retinalcapillary density in each group of rats (x ± s) |
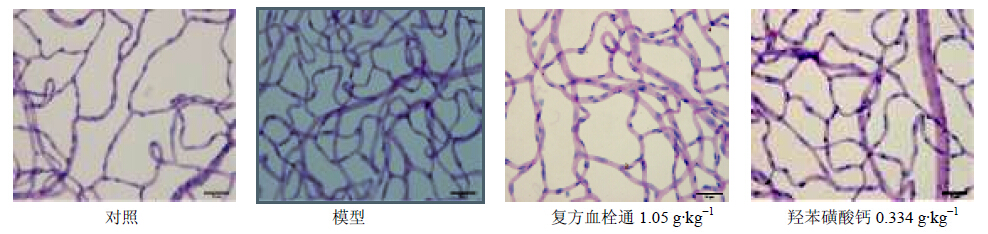 | 图 1 大鼠视网膜毛细血管形态学Fig. 1 Morphology of retinal capillary ineach group of rats |
对照组大鼠视网膜毛细血管管腔规则,内皮细胞紧靠管腔面,基底膜连续、无增厚。模型组大鼠视网膜毛细血管内皮细胞肿胀,内皮细胞胞质内吞饮小泡增多,部分线粒体肿胀,基底膜增厚较为明显。羟苯磺酸钙组、复方血栓通组大鼠视网膜血管基底膜增厚不明显,内皮细胞连接紧密,管腔较为平滑。见图 2。
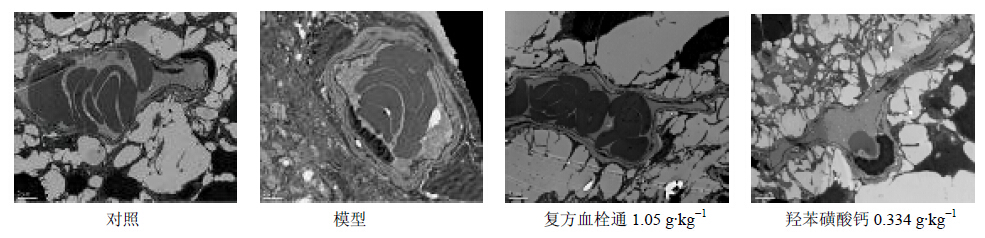 | 图 2 大鼠视网膜电镜超微结构Fig. 2 Ultrastructureof the retinal in each group of rats |
糖尿病视网膜病变是指长期慢性高血糖使视网膜血管发生进行性的结构和功能的损害所导致的视网膜微血管病变。长期的高血糖状态极易造成血–视网膜屏障受损,使全血黏度增高,血流速度减慢,视网膜毛细血管狭窄、闭塞,微循环障碍,导致视网膜缺血缺氧[8],从而促使VEGF在视网膜中的过度表达,导致血管增生[9]、血管通透性增加[10]。新生血管的生长和成纤维细胞的增殖在视网膜表面组成增生膜,形成增生性糖尿病视网膜病变。细胞外基质(extracellulamatrix,ECM)是增生膜的主要成分,胶原是细胞外基质的重要组成部分。视网膜基底膜主要由Ⅳ型胶原、层黏连蛋白等构成,是位于毛细血管周围特殊形式的ECM。糖尿病代谢紊乱使Ⅳ型胶原合成增加,而分解减慢,并在基底膜沉积[2]。基底膜增厚是糖尿病视网膜病变的特征性改变之一。有研究报道,在高糖培养基中系膜细胞在数小时到数天内Ⅳ型胶原mRNA表达水平迅速升高,并合成更多的蛋白质[11]。本实验采用Real-time PCR法检测Ⅳ型胶原及VEGF mRNA在视网膜组织中的表达,结果在模型组大鼠中其表达较对照组升高,羟苯磺酸钙组、复方血栓通组表达均较模型组明显降低,提示羟苯磺酸钙能够降低糖尿病大鼠视网膜中Ⅳ型胶原和VEGF的表达,减少视网膜毛细血管细胞外基质的过度沉积,抑制新生血管形成,从而起到防治视网膜病变的作用。
视网膜毛细血管主要由周细胞和内皮细胞组成,对维持视网膜毛细血管的稳定性具有十分重要的作用。视网膜毛细血管周细胞的丧失是糖尿病视网膜病变早期特征性病理改变。周细胞具有调节内皮细胞增殖、新生血管生长、毛细血管血流、通透性及稳定性等多种功能。周细胞缺失,继而引起视网膜毛细血管内皮细胞增殖,血管增生。视网膜毛细血管的定性和定量研究可以用来评估糖尿病微血管病变的严重程度。本实验通过视网膜消化铺片观察到糖尿病大鼠视网膜毛细血管排列紊乱,内皮细胞增生,周细胞减少,毛细血管面积密度增加;而羟苯磺酸钙组、复方血栓通组大鼠视网膜毛细血管形态相对规则,内皮细胞的增生不明显,毛细血管面积密度显著下降,说明羟苯磺酸钙可以抑制毛细血管和内皮细胞的增生,减少周细胞的凋亡。电镜观察可见模型组大鼠视网膜毛细血管基底膜增厚明显,羟苯磺酸钙组大鼠视网膜基底膜增厚不明显,提示羟苯磺酸钙对高糖造成的基底膜胶原的过量生成有一定的抑制作用。
本实验表明,羟苯磺酸钙能下调Ⅳ型胶原及VEGF在视网膜组织中的表达,抑制视网膜毛细血管胶原过度合成和毛细血管内皮细胞的增生,减少周细胞的凋亡,抑制视网膜新生血管形成,减少血管的渗漏,从而改善糖尿病视网膜病变的发生和发展。
| [1] | 徐凡杨, 莹张瑛, 宋滇平. 血管内皮生长因子与糖尿病视网膜病变的相关性研究 [J]. 实用糖尿病杂志, 2011, 7(1): 14-16. |
| [2] | 魏玲格, 王长龄, 段惠军. 实验性糖尿病视网膜微血管病变的病理研究 [J]. 中华眼科杂志, 2002, 38(9): 523-525. |
| [3] | 胡金芳, 刘兆凤, 刘 静, 等. 糖尿病大鼠视网膜血流动力学与视网膜血管形态学关系的研究 [J]. 药物评价研究, 2011, 34(3): 167-170. |
| [4] | 谢秀雯, 周建强, 崔红平. VEGF在糖尿病视网膜病变发病机制中作用的研究新进展 [J]. 国际眼科杂志, 2011, 11(2): 282-285. |
| [5] | Armulik A, Abramsson A, Betsholtz C. Endothelial/ pericyteinteractions [J]. Circ Res, 2005, 97(6): 512-523. |
| [6] | 杨文波, 王红雁. 羟苯磺酸钙的药理作用及临床应用 [J]. 现代医药卫生, 2012, 28(7): 1043-1044. |
| [7] | 孟旭霞, 牛膺筠, 曲 虹, 等. 大鼠糖尿病视网膜病变模型建立及超微结构观察 [J]. 青岛大学医学院学报, 2007, 43(3): 217-219. |
| [8] | Kern T S, Tang J, Berkowitz B A. Validation of structural and functional lesions of diabetic retinopathy in mice [J]. Mol Vis, 2010, 16: 2121-2131. |
| [9] | Ng E W, Adamis A P. Targeting angiogenesis, the underlying disorder in neovascular age-related macular degeneration [J]. Can J Ophthalmol, 2005, 40(3): 352-368. |
| [10] | Kurihara T, Westenskow P D, Friedlander M. Hypoxia- inducible factor (HIF)/vascular endothelial growth factor (VEGF) signaling in the retina [J]. Adv Exp Med Biol, 2014, 801: 275-281. |
| [11] | 高彦彬. 止消通脉宁治疗糖尿病肾病临床及作用机制研究 [D]. 北京: 北京中医药大学, 2000. |
 2015, Vol. 30
2015, Vol. 30


