2. 天津药物研究院, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
艾卡(IKA)C-MAGHS 7型磁力搅拌器;IKA RV10基本型旋转蒸发仪;梅特勒–托利多AL104电子天平;Bruker Avance III 600型核磁共振波谱仪;赛默飞世尔LTQ-Obitrap XL液质联用仪;Analect RFX-65A型红外光谱仪;BYLABUV-III紫外灯(北京炳洋科技有限公司),37 ℃、5%CO2恒温培养箱(日本Sanoy公司);IX51倒置荧光显微镜(Olympus公司);KC junior微孔板分光光度计(BioTek公司)。
绿原酸,质量分数为98%,购自四川省中药标准中心;辛伐他汀(质量分数为98%)、胰蛋白酶、四甲基氮唑蓝(MTT)、油红O染料、油酸(OA)、青霉素、链霉素均购自Sigma公司;DMEM高糖培养基购自Gibco公司;2,2-二甲氧基丙烷(DMP)、N,N-二异丙基乙胺(DIEA)、卡特缩合剂(BOP)、三氟乙酸(TFA)、对甲苯磺酸一水(TsOH),均购自安耐吉化学公司;柱色谱用硅胶及薄层色谱用硅胶G、H、GF254均购自青岛海洋化工有限公司;人肝癌HepG2细胞购自北京协和医学院基础医学研究所细胞中心。常规试剂为市售分析纯和化学纯。
2 方法与结果2.1 合成部分
2.1.1 4′,5′-O-丙叉基-3′-O-咖啡酰奎宁酸(CGA-1)的合成
参考文献的合成方法[9],于500 mL的圆底烧瓶中加入绿原酸(14.0 g,39.6mmol),然后加入120 mL无水丙酮和80 mL DMP,搅拌反应呈悬浊液。向反应液中加入催化量的TsOH(100 mg),搅拌反应至反应液澄清,于室温下反应,展开剂为醋酸乙酯–甲酸(100∶1),TLC监测反应结束后,用无水Na2CO3中和至pH值为5~6,抽滤,减压蒸除溶剂,残余物通过硅胶柱色谱纯化,石油醚–醋酸乙酯(1∶1)洗脱得淡黄色粉末,收率为90.1%。HR-ESI-MS m/z:417.116 7 [M+Na]+。1H-NMR(600MHz,DMSO-d6)δ:9.58(1H,s),9.14(1H,s),7.48(1H,d,J=15.8 Hz),7.05(1H,d,J=1.5 Hz),7.00(1H,dd,J=1.4 Hz,8.2 Hz),6.77(1H,d,J=8.1 Hz),6.23(1H,d,J=15.9 Hz),5.34~5.30(1H,m),4.39~4.38(1H,m),4.11~4.09(1H,m),2.20~2.16(1H,m),2.03~2.01(1H,m),1.92~1.89(1H,m),1.83~1.79(1H,m),1.40(3H,s),1.25(3H,s)。
2.1.2 4′,5′-O-丙叉基-3′-O-咖啡酰奎宁酸乙二酰胺二聚体衍生物(CGA-2a)的合成
参考文献的合成方法[9],于500 mL圆底烧瓶中,准确称取衍生物CGA-1(2.4g,6 mmol)和BOP(3.0 g,6 mmol),在氩气保护的条件下,加入140 mL无水混合溶剂THF-CH3CN(1∶1)搅拌至溶解。加入DIEA(2.0g,15 mmol)后,向反应液中滴加乙二胺(0.22 g,3.6 mmol),展开剂为二氯甲烷–甲醇(10∶1),直到TLC监测反应结束。减压蒸除溶剂,残余物通过硅胶柱色谱纯化,二氯甲烷–甲醇(20∶1)洗脱得淡黄色粉末,收率为21.3%。HR-ESI-MS m/z:811.293 0 [M-H]−。1H-NMR(600MHz,CD3OD)δ:7.56(2H,d,J=16.0 Hz),7.04(2H,d,J=1.9 Hz),6.93(2H,dd,J=1.9 Hz,8.2 Hz),6.78(2H,d,J=8.2 Hz),6.26(2H,d,J=15.9 Hz),5.45~5.41(2H,m),4.56~4.54(2H,m),4.20~4.18(2H,m),3.38~3.33(4H,m),2.38~2.34(2H,m),2.14~2.11(2H,m),1.97~1.95(2H,m),1.92~1.88(2H,m),1.52(6H,s),1.33(6H,m)。
2.1.3 4′,5′-O-丙叉基-3′-O-咖啡酰奎宁酸丙二酰胺二聚体衍生物(CGA-2b)的合成
按照化合物CGA-2a的合成及纯化方法,由化合物CGA-1和丙二胺(0.27 g,3.6mmol)反应。减压蒸除溶剂,残余物通过硅胶柱色谱纯化,二氯甲烷–甲醇(20∶1)洗脱得淡黄色粉末,收率为18.8%。HR-ESI-MSm/z:825.307 0 [M-H]−。1H-NMR(600MHz,CD3OD)δ:7.56(2H,d,J=16.0Hz),7.05(2H,d,J=1.8 Hz),6.95(2H,dd,J=1.8Hz,8.0 Hz),6.78(2H,d,J=8.0 Hz),6.27(2H,d,J=16.0Hz),5.47~5.43(2H,m),4.57~4.53(2H,m),4.22~4.18(2H,m),3.25~3.23(4H,m),2.38~2.34(2H,m),2.15~2.12(2H,m),1.95~1.93(4H,m),1.70~1.68(2H,m),1.53(6H,s),1.34(6H,m)。
2.1.44′,5′-O-丙叉基-3′-O-咖啡酰奎宁酸丁二酰胺二聚体衍生物(CGA-2c)的合成
按照化合物CGA-2a的合成及纯化方法,由化合物CGA-1和丁二胺(0.32 g,3.6 mmol)反应。减压蒸除溶剂,残余物通过硅胶柱色谱纯化,二氯甲烷–甲醇(20∶1)洗脱得淡黄色粉末,收率为25.0%。HR-ESI-MSm/z:839.323 0 [M-H]−。1H-NMR(600MHz,CD3OD)δ:9.59(2H,s),9.15(2H,s),7.75(2H,t,J=5.7 Hz),7.47(2H,d,J=16.0 Hz),7.04(2H,d,J=1.8 Hz),7.00(2H,dd,J=1.8、8.2 Hz),6.76(2H,d,J=8.1 Hz),6.24(2H,d,J=15.9 Hz),5.42(2H,s),5.36~5.32(2H,m),4.43~4.36(2H,m),4.12~4.09(2H,m),3.09~3.01(4H,m),2.24~2.21(2H,m),1.97~1.94(2H,m),1.75~1.74(4H,m),1.41(6H,s),1.39~1.34(4H,s),1.25(6H,m)。
2.1.5 4′,5′-O-丙叉基-3′-O-咖啡酰奎宁酸丁二酰胺二聚体衍生物(CGA-2d)的合成
按照化合物CGA-2a的合成及纯化方法,由化合物CGA-1和己二胺(0.42 g,3.6mmol)反应。减压蒸除溶剂,残余物通过硅胶柱色谱纯化,二氯甲烷–甲醇(20∶1)洗脱得淡黄色粉末,收率为20.3%。HR-ESI-MSm/z:867.354 8 [M-H]−。1H-NMR(600MHz,CD3OD)δ:7.56(2H,d,J=15.8Hz),7.04(2H,d,J=1.8 Hz),6.94(2H,dd,J=1.8 Hz,8.0 Hz),6.78(2H,d,J=8.0Hz),6.27(2H,d,J=15.8 Hz),5.46~5.42(2H,m),4.55~4.50(2H,m),4.22~4.15(2H,m),3.22~3.17(4H,m),2.37~2.33(2H,m),2.13~2.08(2H,m),1.95~1.90(4H,m),1.54~1.49(10H,m),1.35~1.32(10H,m)。
2.1.6 3′-O-咖啡酰奎宁酸乙二酰胺二聚体衍生物(CGA-3a)的合成
参考文献的合成方法[13],于50 mL圆底烧瓶中,准确称取衍生物CGA-2a(0.81g,1 mmol),加入TFA-DCM-H2O的混合溶液(9∶1∶1)15 mL,室温下搅拌反应,展开剂为二氯甲烷–甲醇(10∶1),至TLC监测反应结束。反复减压蒸除溶剂,残余物通过硅胶柱色谱纯化,二氯甲烷–甲醇(15∶1)洗脱得淡黄色粉末,收率为54.4%。HR-ESI-MSm/z:731.230 5[M-H]−。1H-NMR(600MHz,CD3OD)δ:7.58(2H,d,J=16.0Hz),7.09(2H,d,J=1.9 Hz),6.95(2H,dd,J=1.9Hz,8.1 Hz),6.78(2H,d,J=8.1 Hz),6.29(2H,d,J=15.8Hz),5.38~5.30(2H,m),4.29~4.22(2H,m),3.73~3.71(2H,m),3.68~3.58(4H,m),2.14~2.13(2H,m),2.12~2.08(2H,m),2.05~2.01(2H,m),1.97~1.94(2H,m)。
2.1.7 3′-O-咖啡酰奎宁酸丙二酰胺二聚体衍生物(CGA-3b)的合成
按照化合物CGA-3a的合成及纯化方法,由衍生物CGA-2b(0.83g,1 mmol)脱保护得淡黄色粉,收率为60.2%。HR-ESI-MSm/z:745.244 6 [M-H]−。1H-NMR(600MHz,CD3OD)δ:7.57(2H,d,J=15.8Hz),7.05(2H,d,J=2.1 Hz),6.94(2H,dd,J=2.0 Hz,8.1 Hz),6.78(2H,d,J=8.2Hz),6.29(2H,d,J=15.8 Hz),5.43~5.39(2H,m),4.24~4.23(2H,m),3.71~3.70(2H,m),3.24~3.22(4H,m),2.15~2.12(2H,m),2.10~2.07(2H,m),2.05~2.01(2H,m),1.98~1.95(2H,m),1.70~1.66(2H,m)。
2.1.8 3′-O-咖啡酰奎宁酸丁二酰胺二聚体衍生物(CGA-3c)的合成
按照化合物CGA-3a的合成及纯化方法,由衍生物CGA-2c(0.83g,1 mmol)脱保护得淡黄色粉末,收率为59.7%。HR-ESI-MSm/z:759.2615 [M-H]−。1H-NMR(600MHz,CD3OD)δ:7.58(2H,d,J=16.0Hz),7.06(2H,d,J=2.0 Hz),7.58(2H,d,J=16.0Hz),7.06(2H,d,J=2.0 Hz),6.95(2H,dd,J=2.0 Hz,8.2 Hz),6.79(2H,d,J=8.0Hz),6.30(2H,d,J=16.0 Hz),5.42~5.38(2H,m),4.24~4.22(2H,m),3.71~3.70(2H,m),3.24~3.19(4H,m),2.13~2.07(4H,m),2.05~2.01(2H,m),1.97~1.93(2H,m),1.54~1.50(4H,m)。
2.1.9 3′-O-咖啡酰奎宁酸己二酰胺二聚体衍生物(CGA-3d)的合成
按照化合物CGA-3a的合成及纯化方法,由衍生物CGA-2d(0.83g,1 mmol)脱保护得淡黄色粉末,收率为51.1%。HR-ESI-MSm/z:787.2923 [M-H]−。1H-NMR(600MHz,CD3OD)δ:7.57(2H,d,J=15.9Hz),7.05(2H,d,J=2.0 Hz),6.94(2H,dd,J=1.9 Hz,8.2 Hz),6.78(2H,d,J=8.1Hz),6.30(2H,d,J=15.9 Hz),5.42~5.38(2H,m),4.25~4.22(2H,m),3.72~3.70(2H,m),3.19~3.17(4H,m),2.13~2.07(4H,m),2.05~2.01(2H,m),1.94~1.92(2H,m),1.52~1.47(4H,m),1.33~1.30(4H,m)。
绿原酸酰胺二聚体衍生物的合成路线见图 1。
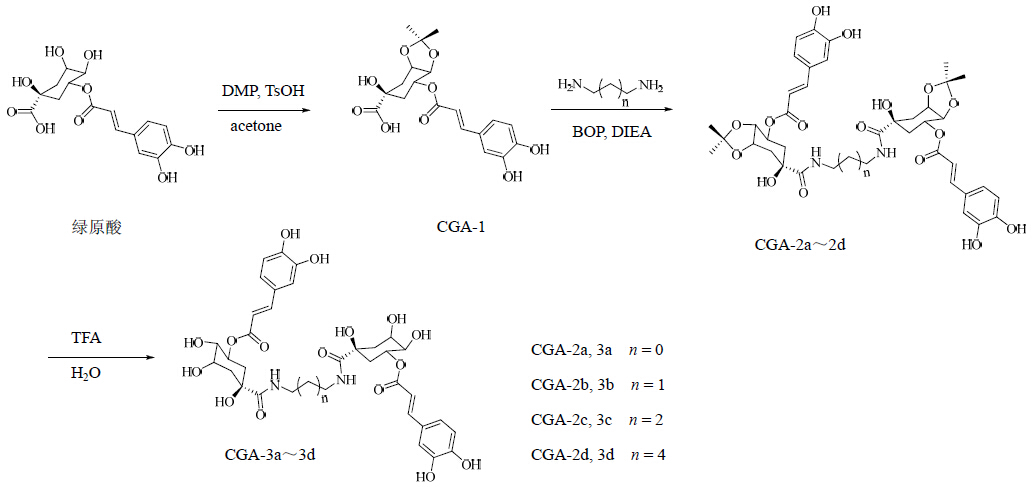 | 图 1 绿原酸酰胺二聚体的合成路线Fig. 1 Synthetic routes of chlorogenicacid amide dimers |
人肝HepG2细胞系采用含10%胎牛血清和青霉素/链霉素(100μg/mL)的DMEM培养基,于37 ℃、5% CO2的培养箱中培养。细胞长至培养皿70%~80%时,使用100 μmol/L油酸和棕榈酸混合液刺激细胞12 h,制成脂质堆积模型;随后给予不 同的绿原酸酰胺二聚体(10 μmol/L)以及同等浓度的绿原酸和辛伐他汀阳性对照,外加一个空白对照组,均孵育6 h。实验结束后使用油红O染色,通过分光分度仪在358 nm下测定吸光度(A)值,观察绿原酸酰胺二聚体中具有抑制脂质堆积的有效化合物。每个实验均重复3次[14]。
以绿原酸和调脂药物辛伐他汀为阳性对照,在10 μmol/L的浓度下,通过细胞学实验考察了衍生物CGA-2a~2d及CGA-3a~3d对HepG2细胞脂质代谢紊乱的抑制作用,见表 1。
| 表 1 绿原酸酰胺二聚体的调脂活性 Table 1 Lipid-regulating activities of chlorogenic acid amide dimers |
3.1 合成部分
本实验以绿原酸为起始原料,通过对甲苯磺酸催化,在干燥丙酮中将其绿原酸部分的4、5位羟基与DMP反应,得到中间体CGA-1;中间体CGA-1再在BOP和DIEA的缩合条件下,在无水乙腈和无水四氢呋喃混合溶剂中,与不同长度的脂肪二胺发生缩合反应,得到衍生物CGA-2a~2d;衍生物CGA-2a~2d再在含水的三氟乙酸二氯甲烷溶剂中脱去丙酮叉保护,最终得到衍生物CGA-3a~3d。化合物CGA-1的1位羧基分别与不同链长的二胺以酰胺键相连生成绿原酸二聚体化合物,亚甲基碳数分别为0(化合物CGA-2a、3a)、1(化合物CGA-2b、3b)、2(化合物CGA-2c、3c)、4(化合物CGA-2d、3d)。
3.2 体外活性研究
在设计合成的8个连有不同连接链长度的酰胺二聚体衍生物中,有7个化合物呈现出了不同程度的调脂作用,虽然未出现活性优于阳性对照药辛伐他汀的化合物,但衍生物CGA-2d和CGA-3a~3d的调脂活性均优于先导化合物绿原酸,其中CGA-2d的活性结果具有显著性意义,值得深入研究。初步的构效关系总结如下:(1)连接链的长度对活性具有一定的影响,碳数越大调脂活性越好,如化合物CGA-2a、2d;(2)4′及5′位丙叉基脱去保护的衍生物,活性整体优于未脱保护的衍生物。上述研究结果,为深入开展绿原酸酰胺二聚体抗脂质代谢紊乱活性研究奠定基础。
| [1] | 吴卫华, 康 桢, 欧阳冬生, 等. 绿原酸的药理学研究进展 [J]. 天然产物研究与开发, 2006, 18(4): 691-694. |
| [2] | 张鞍灵, 马 琼, 高锦明, 等. 绿原酸及其类似物与生物活性 [J]. 中草药, 2001, 32(2): 173-175. |
| [3] | 吕沅珊, 李棣华, 刘俊红. HPLC-ELSD法测定杜仲中绿原酸和鹅掌楸苷 [J]. 现代药物与临床, 2013, 28(3): 344-346. |
| [4] | 李小贝, 贺石麟, 彭照琪, 等. HPLC法测定还阳参药材中绿原酸 [J]. 药物评价研究, 2012, 35(3): 194-196. |
| [5] | Huang M, Richards W G, Grant G H. Diketoacid HIV-1 integrase inhibitors: an ab initio study [J]. J Phys Chem A, 2005, 109(23): 5195-5202. |
| [6] | Matsunaga K, Katayama M, Sakata K, et al. Inhibitory effects of chlorogenic acid on azoxymethane-induced colon carcinogenesis in male F344 rats [J]. Asian Pac J Cancer Prev, 2002, 3(2):163-166. |
| [7] | Rodriguez de Sotillo D V, Hadley M. Chlorogenic acid modifies plasma and liver concentrations of: cholesterol, triacylglycerol, and minerals in (fa/fa) Zucker rats [J]. J Nutr Biochem, 2002, 13(12): 717-726. |
| [8] | Frank J, Kamal-Eldin A, Razdan A, et al. The dietary hydroxycinnamate caffeic acid and its conjugate chlorogenic acid increase vitamin E and cholesterol concentrations in Sprague-Dawley rats [J]. J Agric Food Chem, 2003, 51(9): 2526-2531. |
| [9] | Ma C M, Kully M, Khan J K, et al. Synthesis of chlorogenic acid derivatives with promising antifungal activity [J]. Bioorgan Med Chem, 2007, 15(21): 6830- 6833. |
| [10] | Ma C M, Hattori M, Daneshtalab M, et al. Chlorogenic acid derivatives with alkyl chains of different lengths and orientations: potent α-glucosidase inhibitors [J]. J Med Chem, 2008, 51(19): 6188-6194. |
| [11] | Metaferia B B, Chen L, Baker H L, et al. Synthetic macrolides that inhibit breast cancer cell migration in vitro [J]. J Am Chem Soc, 2007, 129(9): 2434-2435. |
| [12] | Zhang X, Wu C, Wu H F, et al. Anti-hyperlipidemic effects and otential mechanisms of action of the caffeoylquinic acid-rich andanus tectorius fruit extract in hamsters fed a high fat-diet [J]. PLoS One, 2013, 8(4), e61922. |
| [13] | Metaferia B B, Chen L, Baker H L, et al. Synthetic macrolides that inhibit breast cancer cell migration in vitro [J]. J Am Chem Soc, 2007, 129(9): 2434-2435. |
| [14] | Li Y, Wu C M, Liu D, et al. Chartarlactams A-P, phenylspirodrimanes from the sponge-associated fungus stachybotrys chartarum with antihyperlipidemic activities [J]. J Nat Prod, 2014, 77(1): 138-147. |
 2015, Vol. 30
2015, Vol. 30


