2. 天津医科大学, 天津 300070;
3. 天津药物研究院 医药信息中心, 天津 300193
2. Tianjin Medical University, Tianjin 300070, China;
3. Drug Informatics Center, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
通用名:sotagliflozin
别名:LX4211
化学名:(2S,3R,4R,5S,6R)-2-(4-氯-3-(4-乙氧基苄基)苯基)-6-(甲硫基)四氢-2H-吡喃-3,4,5-三醇
CAS:1018899-04-1
分子式:C21H25ClO5S
相对分子质量:424.94
原研公司:Lexicon Pharmaceuticals
结构见图 1
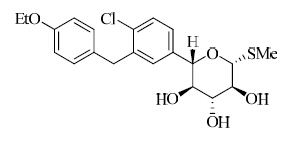 | 图 1 sotagliflozin结构式Fig. 1 Structure of sotagliflozin |
适应症:2型糖尿病、1型糖尿病
目前阶段:II期临床
给药途径:口服
2 相关背景国际糖尿病协会(IDF)预计到2035年全球糖尿病患者数量将达59亿,其中接近90%为2型糖尿病患者[1]。目前,常见的2型糖尿病治疗药物有磺酰脲类、α-碳苷酶抑制剂、双胍类和胰岛素类等,虽然它们控制血糖效果良好,但却存在多种不良反应。因此,研究者们仍然在寻找和开发具有新型作用机制和毒副作用小的治疗药物[2]。1835年,研究人员从苹果树皮中分离出一种天然的钠-葡萄糖共转运蛋白(SGLTs)抑制剂根皮苷,发现其在动物中有平衡血糖的作用,接着在根皮苷的结构基础上,合成了更多高效和高选择性的SGLTs抑制剂,并用于临床研究中。SGLT2是近年来发现的具有全新作用机制的一个糖尿病治疗新靶点[3],2013年,美国食品药品监督管理局(FDA)批准的canagliflozin成为第一个用于治疗成人2型糖尿病的SGLT2抑制剂[4]。随后,美国以及其他国家已经批准了多个SGLT2抑制剂,如百时美施贵宝和阿斯利康公司开发的dapagliflozin ,勃林格殷格翰和礼来公司开发的empagliflozin等[5, 6]。
Lexicon制药公司研发的sotagliflozin能够双重抑制SGLT1和SGLT2,并通过另一种非胰岛素依赖的机制治疗糖尿病,较SGLT2抑制剂疗效更佳。sotagliflozin的临床特征包括大幅降低餐后血糖、升高胰高血糖素样肽1(GLP-1)和适度促进尿糖排泄,且不出现腹泻或其他胃肠道反应,这些特征使其在1型和2型糖尿病的治疗方面具有明显的优势。
3 合成路线王瑞等[7]报道了sotagliflozin的合成方法。以L-(−)-木糖为起始原料,在酸性条件下环合制得1,2-O-异亚丙基-α-L-呋喃木糖(2),化合物2经氧化制得1,2-O-异亚丙基-α-L-呋喃木糖醛酸(3),中间体3再与吗啉缩合制得重要中间体(5S)-1-C-4-吗啉基-4,5-O-异亚丙基-D-2,5-呋喃木糖二醛(4);以5-溴-2-氯苯甲酸为原料经氯代得到中间体5,再与苯乙醚经傅克反应得到5-溴-2-氯-4′-甲氧基二苯甲酮(6),中间体6在硼氢化钠/三氯化铝体系下还原得到5-溴-2-氯-4′-甲氧基二苯甲烷(7)。中间体7与中间体4在n-BuLi作用下经缩合得到(5S)-1- C-[4-氯-3-[(4-乙氧基苯基)甲基]苯基]-4,5-O-异亚丙基-D-2,5-呋喃木糖二醛(8),中间体8经七水合氯化铈/硼氢化钠/甲醇体系还原得到中间体9,中间体9在醋酸/水体系中回流,反应开环,然后又在醋酸酐/吡啶的作用下扩环得到(3S,4R,5S,6S)-2,4,5-三乙酰氧基-6-[4-氯-3-(4-乙氧基苄 基)苯基]四氢呋喃- 3-基乙酸酯(10),中间体10在8.7 mol/L溴化氢醋酸溶液中经溴代得到(3S,4R,5S,6S)-4,5-二乙酰氧基-2-溴-6-[4-氯-3-(4-乙氧基苄基)]四氢吡喃-3-基乙酸酯(11),中间体11与甲硫醇钠发生取代反应、再经乙醇解得到目标产物sotagliflozin。见图 2。
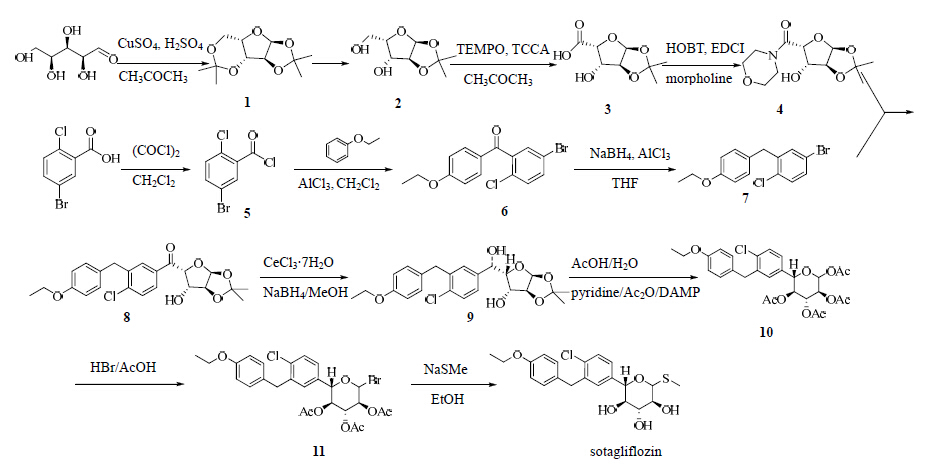 | 图 2 sotagliflozin的合成路线Fig. 2 Synthesis route of sotagliflozin |
葡萄糖在肾小管里的重吸收主要由葡萄糖转运蛋白(GLUTs)和SGLTs两种转运蛋白完成。GLUTs以易化扩散的方式转运葡萄糖,而SGLTs则以主动运输的方式转运葡萄糖。SGLTs主要分布于小肠、心肌细胞和肾小管的上皮细胞中[8]。其中SGLT1是高亲和力、低转运力的转运蛋白,以钠-葡萄糖(2∶1)的比率转运D-葡萄糖和D-半乳糖,主要负责肠道葡萄糖的主动转运;SGLT2是低亲和力、高转运力的转运蛋白,主要分布于近端小管S1段,其承担了90%葡萄糖重吸收的工作。
近年来,选择性SGLT2抑制剂是研究的热点,关于SGLT1抑制剂的研究也有报道。同时,Lexicon制药公司也开展了对新型SGLT1/2双靶点抑制剂的开发[9]。Powell等[10]发现sotagliflozin对SGLT1和SGLT2体外抑制的IC50值分别为0.036、0.001 8 μmol/L,表明sotagliflozin是SGLT1/2双重抑制剂,且对SGLT2具有更高的选择性,是SGLT1的20倍。进一步的研究发现,sotagliflozin可通过抑制SGLT1降低从胃肠道进入血液的葡萄糖量,将葡萄糖转运至盲肠,提高餐后GLP-1、酪酪肽(PYY)和胃肠激素释放,并可通过抑制SGLT2增强尿糖排泄来控制患者血糖水平[11, 12]。与其他选择性SGLT2抑制剂相比,sotagliflozin在餐后血糖、糖化血红蛋白(HbA1C)控制方面作用更佳,且不出现腹泻或其他胃肠道反应。因此,在抑制SGLT2的基础上,适当的抑制SGLT1,是开发降糖药物的一个新路径。
5 临床研究5.1 I期临床
Freiman等[12, 13]在96名健康志愿者中进行了一项sotagliflozin初步的单剂量、多剂量口服给药研究,用来确定其药动学、药效学特性以及安全性等。其中,多次给药剂量最高为500 mg,连续7 d,末次给药后sotagliflozin的达峰时间(tmax)为165 ng/mL,曲线下面积AUC0-tau为1 172 ng/(h∙mL−1),药物半衰期t1/2为29 h,推测给药剂量可以为每日1次。当以300 mg单剂量给予sotagliflozin时,24 h后最大的尿糖排量为44 g,并且增大给药剂量后尿糖排泄量不再增加;当以多 剂量给予sotagliflozin时,第7天最大的尿糖排量为36 g。该结果表明,sotagliflozin促进尿糖的排泄能力低于已报道的选择性SGLT2抑制剂,如在健康志愿者中给予canagliflozin后,24 h后尿糖的排泄量可达60~70 g[14],这种原因可能是sotagliflozin通过抑制SGLT1降低了经肾脏滤过的葡萄糖数量。安全性研究显示,安慰剂组(n=24)有1例受试者出现恶心,5~100 mg低剂量组(n=42)出现3例胃肠道不良反应,150~500 mg高剂量组(n=30)没有发生胃肠道反应,仅1例出现多尿症,表明sotagliflozin在所有受试者中的耐受性良好。
Zambrowicz等[15]选取了12名30~51岁男性健康志愿者进行交叉试验,每天餐前口服固体制剂sotagliflozin或安慰剂。结果表明,sotagliflozin能够降低受试者餐后血糖水平,且早餐后血糖平均峰值约为105 mg/dL,而安慰剂组高于130 mg/dL,可能由于sotagliflozin是SGLT1/2双重抑制剂,通过抑制胃肠道处的SGLT1使得餐后血糖降低;此外,sotagliflozin组与安慰剂组相比,GLP-1、PPY水平显著性升高,这与SGLT1抑制剂的临床前试验结果一致。
5.2 II期临床Zambrowicz等[9]在36名二甲双胍血糖控制不佳的2型糖尿病患者中进行了一项随机、安慰剂对照试验,旨在评价sotagliflozin对血糖水平的控制情况。受试者以1∶1∶1的比例随机给予sotagliflozin(150、300 mg)、安慰剂,1次/d,共28 d。第7天,sotagliflozin 150、300 mg组受试者的空腹血糖水平较基线值分别降低了30、43 mg/dL,而安慰剂组则升高了9 mg/dL;第27天,与安慰剂组相比,sotagliflozin 150、300 mg组患者口服糖耐量试验(OGTT)的葡萄糖AUC数值分别下降38%、39%;第28天,与安慰剂组相比(0.49%),sotagliflozin 150、300 mg组的HbA1C水平分别下降了1.15%、1.25%,差异具有统计学意义(P<0.05);并且24 h尿中葡萄糖排泄量分别达到44、65 g。文献报道,选择性SGLT2抑制剂canagliflozin(100 mg)的24 h尿糖排泄量约为80~100 g,而empagliflozin也具有相近的排糖能力[14, 16]。
Zambrowicz等[17]选取18名2型糖尿病患者进行了一项随机、开放的交叉试验。受试者在试验前洗脱体内的二甲双胍,每3名患者为一组,按照6种次序给药(单用sotagliflozin 400、100 mg、两种药物联用)。结果显示,sotagliflozin单独治疗,能够降低血糖水平、促进GLP-1和PYY的释放、减少胰岛素分泌;sitagliptin单独治疗,能够显著增强GLP-1的活性;而两种药物联用,可以使2型糖尿病患者实现了体内胰岛素分泌量降低。以上结果表明联合用药的相关研究具有可行性,同时sotagliflozin可以降低患者对胰岛素需求量,进一步说明其可能对1型糖尿病患者具有疗效。
Zambrowicz等[18]从139名受试者中选取31名兼有肾损伤[肾小球滤过率(eGFR)为15~59 mL/(min∙1.73 m−2)]的2型糖尿病患者进行了一项Ⅱ期临床研究,考察sotagliflozin对该类患者的有效性和安全性。美国FDA指南将eGFR为45 mL/(min∙1.73 m−2)作为肾损伤患者的分界值,而选择性SGLT2抑制剂通常对该类患者无效[19, 20]。受试者随机给予sotagliflozin 400 mg/d(n=16)或安慰剂(n=15),各组根据eGFR值分为45~59 mL/(min∙1.73 m−2)和小于45 mL/(min∙1.73 m−2)两组。结果显示,与安慰剂组相比,eGFR值<45 mL/(min∙1.73 m−2)的sotagliflozin组受试者餐后血糖显著降低,差异具有统计学意义(P<0.05),同时空腹血糖降低,并且GLP-1和PYY升高;而sotagliflozin组[eGFR=45~59 mL/(min∙1.73 m−2)]和sotagliflozin组[eGFR< 45 mL/(min∙1.73 m−2)]受试者2 h尿葡萄糖糖排泄量分别增加53.5、20.4 g(P<0.05),表明sotagliflozin对兼有肾损伤的2型糖尿病患者同样具有疗效。安全性方面研究显示,400 mg可以支持将来对长期肾损伤患者的评估,整个研究中没有严重的不良事件,也没有因为不良事件而中断,sotagliflozin和安慰剂的不良反应总发生率相似。
sotagliflozin对于1型糖尿病患者也存在疗效。2014年4月,Lexicon公司宣布了一项随机、安慰剂对照、双盲、为期28 d的Ⅱ期临床试验结果[21]。研究数据显示,在治疗1型糖尿病的临床试验中服用sotagliflozin的患者血糖改善率达到了32%,而对照组仅为6%,差异具有统计学意义(P<0.05);在良好控制血糖水平的基础上,另一项指标HbA1C的降低水平也达到了0.55%,对照组则仅降低了0.06%(P<0.05)。sotagliflozin能够减少餐前胰岛素的使用量,并在服药期间降低高血糖的发生率,同时也不引发低血糖症状,患者对其具有良好耐受性。此外,另一项针对青少年(年龄在30岁以下、HbA1C水平高于正常值9.0%)1型糖尿病患者的随机、双盲、安慰剂对照研究也正在进行中[22]。
6 安全性由于sotagliflozin适度促进尿糖排泄的作用,在所有的Ⅱ期临床试验中,几乎没出现生殖系统感染的现象,而且低血糖症的发生率也很低,可能与sotagliflozin能够减少对胰岛素的使用量有关,这对1型糖尿病患者以及注射胰岛素的2型糖尿病患者具有重大意义。在一项剂量探索研究中,sotagliflozin 400 mg组有6例患者发生短暂的恶心,而安慰剂组为3例,目前无法根据这个数据得出准确结论,但是该恶心反应可能与GLP-1水平升高有关。针对SGLT1/2双靶点抑制剂仍然需要通过长期的试验获得更多关于安全性方面的内容。
7 结语sotagliflozin作为一种新型SGLT1/2双靶点抑制剂,对1型和2型糖尿病均有疗效,它能够同时抑制SGLT1和SGLT2,延缓葡萄糖在小肠处吸收,并降低肾脏对葡萄糖的重吸收,通过非胰岛素依赖的机制实现更理性的血糖控制。此外,sotagliflozin能够降低餐前胰岛素的使用量,以及与二肽基肽酶4(DPP4)抑制剂合用发挥协同降糖作用,其单独用药或作为其他抗糖尿病药物的辅助用药均具有很好的临床应用前景,将为各型糖尿病患者带来福音。
| [1] | Danaei G, Finucane M M, Lu Y, et al. National, regional, and global trends in fasting plasma glugose and diabetes prevanlence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants [J]. Lancet, 2011, 378(9785): 31-40. |
| [2] | 刘永贵, 解学星, 吴 疆, 等. 治疗2型糖尿病的新靶点药物研究进展 [J]. 现代药物与临床, 2015, 30(2): 222-227. |
| [3] | 郝晨伟, 李正翔. 钠-葡萄糖共转运蛋白2抑制剂治疗2型糖尿病的临床研究进展 [J]. 药物评价研究 2014, 37(5): 463-471. |
| [4] | Dietrich E, Powell J, Taylor J R. Canagliflozin: a novel treatment option for type 2 diabetes [J]. Drug Des Devel Ther, 2013, 22(7):1399-1408. |
| [5] | Rosebraugh C J. Dapagliflozin new drug application approval letter [OL]. [2014-09-05]. http://www.access data.fda.gov/drugsatfda_docs/appletter/2014/202293Orig1s000ltr.pdf. |
| [6] | Rosebraugh C J. Empagliflozin new drug application approval letter [OL]. [2014-09-05]. http://www.access data.fda.gov/drugsatfda_docs/appletter/2014/204629Orig1s 000ltr.pdf. |
| [7] | 王 瑞, 马宗辉, 许 宁, 等. SGLT2抑制剂LX4211的合成方法研究 [J]. 中国药物化学杂志, 2014, 24(6): 464-469. |
| [8] | Wright E M, Loo D D F, Hriayama B A. Biology of human sodium glucose transporters [J]. Physiol Rev, 2011, 91: 733-794. |
| [9] | Zambrowicz B, Freiman J, Brown P M, et al. LX4211, a dual SGLT1/SGLT2 inhibitor, improved glycemic control in patients with type 2 diabetes in a randomized, placebo-controlled trial [J]. Clin Pharmacol Ther, 2012, 92(2): 158-169. |
| [10] | Powell D R, Smith M, Greer J, et al. LX4211 increases serum glucagon-like peptide 1 and peptide YY levels by reducing sodium/glucose cotransporter1 (SGLT1)-mediated absorption of intestinal glucose [J]. J Pharmacol Exp Ther, 2013, 345(2): 250-259. |
| [11] | Powell D R, DaCosta C M, Smith M, et al. Effect of LX4211 on glucose homeostasis and body composition in preclinical models [J]. J Pharmacol Exp Ther, 2014, 350(2): 232-242. |
| [12] | Freiman J, Ye G, Ogbaa I, et al. A phase 1, randomized, double-blind, placebo-controlled, ascending single-and multiple-dose study to determine the safety and tolerability of orally administered LX4211 in healthy human subjects [R]. Woodlands: Clinical Study Report LX4211.101, 2010. |
| [13] | Freiman J, Ye G, Ogbaa I. LX4211, a dual SGLT1/SGLT2 inhibitor shows a favorable gastrointestinal and genitourinary safety profile in type 2 diabetes mellitus (T2DM) patients and healthy subjects [C]. Berlin: 48th EASD Annual Meeting, 2012. |
| [14] | Janssen Research & Development, LLC. Canagliflozin as an adjunctive treatment to diet and exercise alone or co-administered with other antihyperglycemic agents to improve glycemic control in adults with type 2 diabetes mellitus [OL]. [2012-12-11]. http://www.fda.gov/downloads/AdvisoryCommittees /CommitteesMeetingMaterials/Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/UCM334551.pdf |
| [15] | Zambrowicz B, Ogbaa I, Frazier K, et al. Effects of LX4211, a dual sodium-dependent glucose cotransporters 1 and 2 inhibitor, on postprandial glucose, insulin, glucagon-like peptide 1, and peptide tyrosine tyrosine in a dose-timing study in healthy subjects [J]. Clin ther, 2013, 35(8): 1162-1173. |
| [16] | Neumiller J J. Empagliflozin: a new sodium-glucose co-transporter 2 (SGLT2) inhibitor for the treatment of type 2 diabetes [J]. Drugs Context, 2014, 3: 212-262. |
| [17] | Zambrowicz B, Ding Z M, Ogbaa I, et al. Effects of LX4211, a dual SGLT1/SGLT2 inhibitor, plus sitagliptin on postprandial active GLP-1 and glycemic control in type 2 diabetes [J]. Clin Ther, 2013, 35(3): 273-285. |
| [18] | Zambrowicz B, Lapuerta P, Strumph P, et al. LX4211 reduces postprandial glucose in patients with type 2 diabetes mellitus and renal impairment despite low urinary glucose excretion [J]. Clin Ther, 2015, 37(1): 71-82. |
| [19] | US, FDA. Full prescribing information, (canagliflozin) tablets, for oral use [OL]. [2014-09-14]. http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/204042s002lbl.pdf . |
| [20] | US, FDA. Full prescribing information, (empagliflozin) tablets, for oral use [OL]. [2014-09-14]. http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/204629s000lbl.pdf. |
| [21] | Lapuerta P. Sotagliflozn (LX4211) [OL]. [2014-04-07]. http://www.lexpharma.com/pipeline/lx4211.html. |
| [22] | Lapuerta P. Lexicon and JDRF Collaborate for Phase 2 Clinical Trial of LX4211 in Type1 Diabetes [OL]. [2014-07-09]. http://www.lexicon-genetics.com/news/press-releases/2335-lexicon-and-jdrf-collaborate-for-phase-2-clinical-trial-of-lx4211-in-type-1-diabetes.html. |
 2015, Vol. 30
2015, Vol. 30


