马征, 杨智, 胡春生, 马晓宁. 毛叶疏花蔷薇果提取物的亚慢性毒性研究[J]. 现代药物与临床, 2015, 30(4): 380-385.

MA Zheng, YANG Zhi, HU Chun-sheng, MA Xiao-ning. Subchronic toxicity of
Rosa laxa var. mollis fruit extract[J]. DRUGS&CLINIC, 2015, 30(4): 380-385.

毛叶疏花蔷薇果提取物的亚慢性毒性研究
马征1
,
杨智2,
胡春生1,
马晓宁3
1. 湖南省疾病预防控制中心, 湖南 长沙 410005;
2. 湖南师范大学 医学院, 湖南 长沙 410013;
3. 湖南省食品药品检验研究院, 湖南 长沙 410001
收稿日期: 2014-12-23;
基金项目: 湖南省中医药科研计划项目(2013106)
作者简介:马征(1978—),男,副主任药师,硕士研究生,从事药理毒理学和保健食品功能学研究.Tel:(0731)84305713E-mail:1846685@qq.com
摘要:目的 考察毛叶疏花蔷薇果提取物的亚慢性毒性.方法 选用96只健康SD大鼠随机分为4组,雌雄各半,分别ig给予0、1.25、2.50、5.00 g/kg毛叶疏花蔷薇果提取物,连续90 d,观察动物生长情况.试验中、末期对动物的血液学和血清生化指标进行检测,试验末计算动物主要脏器的脏器系数,并进行组织病理学检查.结果 试验期间动物无死亡.试验末各剂量组动物体质量增长值、进食量、食物利用率、脏器质量、脏器系数与对照组比较差异均无统计学意义.在试验中、末期各剂量组动物血液学检测指标与对照组比较差异无统计学意义.血清生化检测发现,试验中期5.00 g/kg剂量组雌雄大鼠血清中的肌酐(CR)和雌性大鼠血清中的尿素氮(BUN)水平显著升高;末期5.00 g/kg剂量组雄性大鼠血清中的CR水平仍居高不下,与对照组比较差异均有统计学意义(P< 0.05、0.01),而其他指标均在正常值范围内.病理组织学检查发现5.00 g/kg剂量组部分动物肾小管和小肠可见相关病理改变.结论 在本实验条件下,5.00 g/kg毛叶疏花蔷薇果提取物对SD大鼠的肾和小肠有损伤作用,最大无作用剂量为2.50 g/kg.
关键词:
毛叶疏花蔷薇果
提取物
大鼠
亚慢性毒性
Subchronic toxicity of Rosa laxa var. mollis fruit extract
MA Zheng1
,
YANG Zhi2,
HU Chun-sheng1,
MA Xiao-ning3
1. Hunan Provincial Center for Disease Control and Prevention, Changsha 410005, China;
2. The Medical College of Hunan Normal University, Changsha 410013, China;
3. Hunan Institute for Food and Drug Control, Changsha 410001, China
Abstract: Objective To study the subchronic toxicity of Rosa laxa var. mollis fruit extract. Methods SD rats (96) were divided randomly into four groups, and each group consisted of 12 males and 12 females. The animals in four groups were ig administered with R. laxa var. mollis fruit extract at doses of 0 (control), 1.25, 2.50, 5.00 g/kg for 90 d, respectively. During the entire course of the study, the rats were observed daily. The hematological and serum biochemical examinations were conducted after 16 h of starvation at 45th day as an intermittent study and 90th day as a terminal. All animals were calculated organ coefficients and studied for histological changes. Results At the end of the study, no deaths were observed in all groups. There were no differences in body weight gains, food intakes, food availability, and organ coefficients compared to the control (P> 0.05). For the hematological analyses, no parameters demonstrated significant changes in all groups during the entire study. During the serum biochemical analyses, there were significant increases of creatinine (CR) level in 5.00 g/kg both sexes and blood urea nitrogen (BUN) level in 5.00 g/kg female rats at the 45th day. Thereafter, significant increase of CR level in 5.00 g/kg male rats were observed at the end of the study (P <0.05, 0.01), but the other indexes were in the normal range. In 5.00 g/kg dose group, remarkable histopathological changes were observed in kidney and intestine of the SD rats. Conclusion R. laxa var. mollis fruit extract could be harmful to kidneys and intestines of the SD rats at 5.00 g/kg dose. No observed adverse effect level (NOAEL) is 2.50 g/kg.
Key words:
Rosa laxa Retz. var. mollis Yu et Ku cynarrhodion
extracts
rats
subchronic toxicity
蔷薇科Rosaceae蔷薇属Rosa L.植物有200多种,中国原产的有82种,多为野生,主要分布在山东、河南、江苏、安徽、新疆等地。野生蔷薇为蔷薇科的落叶小灌木,喜生于路旁、田边或丘陵的灌木丛中。蔷薇果富含大量维生素、类胡萝卜素、黄酮类化合物和膳食纤维等[1]。近年来研究[2, 3, 4]发现蔷薇果提取物在体外能有效抑制细菌生长,能对抗红细胞的氧化损伤,对肿瘤细胞有抑制作用等药理活性。更有技术将其制成果汁饮品食用[5]。作为药用,蔷薇果提取物的安全性是其药理活性的基础。本课题组前期对毛叶疏花蔷薇果提取物进行了急性经口毒性和遗传毒性的研究,在此基础上本研究选择90 d喂养对其亚慢性毒性进行评价,为其安全性提供进一步的实验室依据。
1 材料与方法
1.1 受试物及处理
试验用野生蔷薇果于2013年9~10月采集于新疆阿尔泰山区,经湖南师范大学医学院天然药化教研组鉴定为蔷薇科宿萼大叶系毛叶疏花蔷薇Rosa laxa retz. var. mollis Yu et Ku的新鲜果实。
将果实除去种子及种毛于103 ℃烘干研磨成粉过40目筛,脱脂,干燥后以固液比1∶20的80%乙醇,在80 ℃回流提取4 h,纱布滤过,对滤渣重复提取1次,合并提取液减压蒸至浸膏状,真空冷冻干燥后得棕色粉末,密封冷藏备用(以芦丁为参照品,通过紫外分光光度法计算出提取物中总黄酮质量分数为2.21%)[6]。
1.2 实验动物
SPF级SD大鼠,96只,雌雄各半,由湖南斯莱克景达实验动物有限公司提供,生产许可证号为SCXK(湘)2009-0004,实验动物使用许可证号为SYXK(湘)2012-0005。
1.3 仪器及试药
CD3700全自动血球计数仪,美国雅培公司;AU400全自动生化分析仪,日本奥林巴斯公司;TP1200、ES3000型电子天平,湘仪天平仪器设备有限公司;AJ100型电子天平,瑞士梅特勒-托利多公司;Finesse325旋转石蜡切片机,英国珊顿公司;BX41系统显微镜,日本奥林巴斯公司;R220旋转蒸发仪,瑞士Buchi公司;真空冷冻干燥机,美国Labconco公司;UV2450紫外可见分光光度计,日本岛津。
芦丁对照品,批号10080-200707,中国食品药品检定研究院;总蛋白(total protein,TP)、白蛋白(albumin,ALB)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、尿素氮(blood urea nitrogen,BUN)、血糖(glucose,GLU)、胆固醇(cholesterol,CHOL)、三酰甘油(triglycerides,TG)购自上海复星长征医学科学有限公司;肌酐(creatinine,CR)购自上海申能-德赛诊断技术有限公司;实验用水为超纯水,其他试剂均为分析纯。
1.4 方法
取健康体质量为60~90 g的SD大鼠96只,随机分为4组,每组24只,雌雄各半。设低、中、高剂量(由于没有明确的人体推荐剂量,高剂量按最大灌胃量设计原则,并向下等比设置。参考本室急性经口毒性试验,50.00 g受试物加蒸馏水至100 mL达最大可灌胃浓度,按10 mL/kg灌胃体积一次性灌胃折合剂量为5.00 g/kg)分别为1.25、2.50、5.00 g/kg。大鼠按10 mL/kg ig给予受试物,对照组给予等体积蒸馏水,1次/d,连续90 d。实验期间所有动物单笼喂饲基础饲料,自由摄食饮水,每天观察动物的活动和生长情况,每周加食2~3次,记录给食和剩食量,每周称定质量,计算食物利用率(利用率=增重/进食量×100%)。第45、90 天禁食16 h,动物舌下采血进行血液学和血清生化指标测定。实验末采血后颈椎脱臼处死动物作大体解剖观察,称定肝、肾、脾、睾丸/卵巢的质量,计算脏器系数,主要脏器作病理切片检查。
1.5 统计学处理
采用SPSS 18.0软件统计分析。数据以x ± s表示,组间计量资料差异性比较采用单因素方差分析,方差齐者组间比较用LSD检验,方差不齐者用Tamhane's T2检验。
2 结果
2.1 一般情况
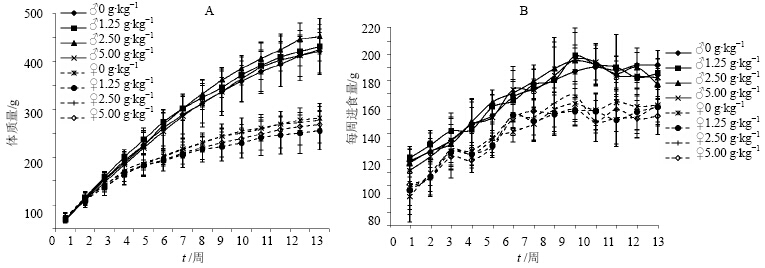
试验期间,各组动物无死亡。5.00 g/kg剂量组动物从实验开始到第2周末活动减少,被毛变得不光滑,并伴有腹泻现象,从第3周开始基本恢复正常。其他动物生长发育、活动正常,无异常行为和中毒症状。两种性别的大鼠各时点体质量和每周的进食量与对照组比较差异无显著性,见图 1。
试验末各剂量组动物的体质量增长值、总进食量、食物利用率与对照组比较差异均无统计学意义,见表 1。
表 1(Table 1)

表 1 受试物对SD大鼠增重、进食量和食物利用率的影响(x ± s,n=12)
Table 1 Effects of extract on increased body weight,food intake,and food efficiency in SD rats (x ± s,n=12)
|
性别
|
剂量/(g·kg−1)
|
增重/g
|
总进食量/g
|
食物利用率/%
|
|
♂
|
0.00
|
352.2±44.5
|
2 153.4±61.1
|
16.3±1.7
|
|
1.25
|
362.0±31.0
|
2 171.9±51.1
|
16.7±1.2
|
|
2.50
|
383.7±39.3
|
2 170.8±45.5
|
17.6±1.5
|
|
5.00
|
356.0±48.0
|
2 142.3±59.6
|
16.6±1.8
|
|
♀
|
0.00
|
209.8±35.5
|
1 846.8±93.7
|
11.3±1.4
|
|
1.25
|
182.8±43.0
|
1 824.8±48.9
|
10.0±2.2
|
|
2.50
|
204.6±20.6
|
1 848.6±38.1
|
11.0±1.1
|
|
5.00
|
194.0±42.5
|
1 813.9±49.6
|
10.7±2.2
|
|
表 1 受试物对SD大鼠增重、进食量和食物利用率的影响(x ± s,n=12)
Table 1 Effects of extract on increased body weight,food intake,and food efficiency in SD rats (x ± s,n=12) |
2.2 受试物对大鼠血液学指标的影响
实验中、末期(第45、90天)各剂量组动物血液学指标与对照组比较,差异均无统计学意义,结果见表 2、3。
表 2(Table 2)

表 2 受试物在第45天对大鼠血液学指标的影响 (x ± s,n=12)
Table 2 Effects of extract on hematological indexfor rats administered extract for 45th d (x ± s,n=12)
|
性别
|
剂量/
(g·kg−1)
|
WBC/
(109·L−1)
|
LYM/%
|
NEU/%
|
MONO/%
|
EOS/%
|
BASO/%
|
RBC/
(1012·L−1)
|
HGB/
(g·L−1)
|
PLT/
(109·L−1)
|
|
♂
|
0.00
|
13.4±5.2
|
75.5±8.5
|
15.7±9.0
|
5.27±2.66
|
1.32±0.52
|
2.17±0.69
|
8.37±0.81
|
157±13
|
600±251
|
|
1.25
|
11.4±2.4
|
74.5±5.6
|
17.5±4.3
|
4.94±1.16
|
1.46±0.62
|
1.57±0.57
|
8.26±0.51
|
155±4
|
510±214
|
|
2.50
|
12.5±3.6
|
74.9±5.2
|
16.5±4.4
|
5.59±2.06
|
1.08±0.39
|
1.92±0.71
|
8.07±0.45
|
151±9
|
624±111
|
|
5.00
|
11.3±5.3
|
75.3±7.1
|
15.6±5.8
|
5.78±1.78
|
1.58±0.61
|
1.72±0.75
|
7.89±0.72
|
150±9
|
596±151
|
|
♀
|
0.00
|
11.8±2.2
|
72.9±6.4
|
18.3±5.6
|
5.46±2.24
|
1.74±0.73
|
1.55±0.61
|
8.29±0.57
|
154±8
|
611±122
|
|
1.25
|
12.7±3.4
|
77.8±7.0
|
14.5±5.5
|
4.82±1.43
|
1.06±0.56
|
1.74±0.83
|
7.77±0.77
|
145±11
|
671±178
|
|
2.50
|
11.3±4.1
|
77.3±7.0
|
15.4±6.7
|
4.70±1.18
|
1.39±0.61
|
1.24±0.30
|
7.84±0.40
|
148±6
|
734±108
|
|
5.00
|
10.3±5.9
|
75.7±3.6
|
16.5±2.9
|
4.86±1.91
|
1.33±0.63
|
1.59±0.40
|
7.98±0.59
|
147±7
|
677±173
|
|
表 2 受试物在第45天对大鼠血液学指标的影响 (x ± s,n=12)
Table 2 Effects of extract on hematological indexfor rats administered extract for 45th d (x ± s,n=12) |
表 3(Table 3)

表 3 受试物在第90天对大鼠血液学指标的影响 (x ± s,n=12)
Table 3 Effects of extract on hematological indexfor rats administered extract for 90th d (x ± s,n=12)
|
性别
|
剂量/
(g·kg−1)
|
WBC/
(109·L−1)
|
LYM/%
|
NEU/%
|
MONO/%
|
EOS/%
|
BASO/%
|
RBC/
(1012·L−1)
|
HGB/
(g·L−1)
|
PLT/
(109·L−1)
|
|
♂
|
0.00
|
12.7±3.2
|
69.6±10.7
|
21.5±10.7
|
5.16±1.10
|
1.71±0.64
|
2.04±0.96
|
8.82±0.50
|
156±7
|
672±147
|
|
1.25
|
10.5±2.6
|
67.8±6.9
|
23.0±6.6
|
5.13±1.07
|
2.35±0.76
|
1.78±0.32
|
8.47±0.54
|
152±8
|
633±221
|
|
2.50
|
10.9±2.5
|
69.9±5.7
|
20.7±5.6
|
4.81±0.63
|
2.22±0.77
|
2.32±0.99
|
8.29±0.30
|
149±9
|
621±97
|
|
5.00
|
11.3±3.5
|
67.5±9.9
|
22.8±9.9
|
5.31±1.11
|
2.25±1.15
|
2.14±0.85
|
8.26±0.76
|
148±8
|
727±±219
|
|
♀
|
0.00
|
10.4±2.1
|
75.7±5.9
|
15.7±4.8
|
5.09±1.92
|
2.18±0.88
|
1.37±0.63
|
8.38±0.65
|
156±10
|
752±113
|
|
1.25
|
9.1±2.7
|
77.0±7.3
|
15.2±6.7
|
4.44±1.71
|
2.00±1.44
|
1.42±1.03
|
8.22±0.81
|
153±11
|
905±261
|
|
2.50
|
8.3±3.6
|
74.0±7.0
|
16.8±5.2
|
5.45±2.91
|
2.37±0.77
|
1.37±1.23
|
8.38±0.50
|
158±9
|
852±175
|
|
5.00
|
9.0±3.2
|
70.1±8.6
|
20.7±8.0
|
5.08±1.32
|
2.26±0.57
|
1.81±0.85
|
8.20±0.54
|
150±9
|
774±150
|
|
表 3 受试物在第90天对大鼠血液学指标的影响 (x ± s,n=12)
Table 3 Effects of extract on hematological indexfor rats administered extract for 90th d (x ± s,n=12) |
2.3 受试物对大鼠生化指标的影响
实验中期5.00 g/kg剂量组雌雄大鼠血清中的CR和雌性大鼠血清中的BUN水平显著升高,与对照组比较差异均具有统计学意义(P<0.05、0.01);在实验末期,5.00 g/kg剂量组雄性大鼠血清中的CR水平仍居高不下,与对照组比较差异有统计学意义(P<0.05);各剂量组其他生化指标在试验中、末期与对照组比较差异均无统计学意义。结果见表 4、5。
表 4(Table 4)

表 4 Effects of extract on serum biochemical index for rats administered extract for 45th d (x ± s,n=12)
Table 4 Effects of extract on serum biochemical index for rats administered extract for 45th d (x ± s,n=12)
|
性别
|
剂量/
(g·kg−1)
|
ALT/
(U·L−1)
|
AST/
(U·L−1)
|
TP/
(g·L−1)
|
ALB/
(g·L−1)
|
CHOL/
(mmol·L−1)
|
TG/
(mmol·L−1)
|
BUN/
(mmol·L−1)
|
CR/
(μmol·L−1)
|
GLU/
(mmol·L−1)
|
|
♂
|
0.00
|
32.61±6.80
|
138.72±19.05
|
67.88±3.72
|
38.29±2.79
|
1.70±0.46
|
0.87±0.24
|
6.01±0.94
|
46.22±3.02
|
4.51±0.44
|
|
1.25
|
28.98±4.30
|
131.58±22.98
|
66.56±2.48
|
39.30±1.53
|
1.60±0.42
|
0.91±0.28
|
6.18±0.67
|
45.27±2.07
|
4.75±0.48
|
|
2.50
|
31.65±6.46
|
143.15±27.26
|
68.34±2.92
|
38.50±1.56
|
1.82±0.45
|
0.98±0.28
|
6.20±0.94
|
46.02±2.04
|
4.55±0.38
|
|
5.00
|
33.79±7.93
|
132.13±14.12
|
67.40±4.01
|
37.37±2.30
|
1.95±0.42
|
1.01±0.27
|
5.48±0.70
|
53.92±2.48**
|
4.59±0.56
|
|
♀
|
0.00
|
26.95±4.34
|
125.78±23.81
|
73.28±3.78
|
41.21±1.68
|
1.91±0.26
|
0.87±0.32
|
6.89±1.34
|
46.55±2.58
|
4.76±0.60
|
|
1.25
|
28.60±6.72
|
140.23±25.61
|
71.17±4.82
|
39.62±2.72
|
2.00±0.21
|
1.06±0.49
|
6.45±1.52
|
46.10±4.52
|
4.80±0.53
|
|
2.50
|
26.19±4.70
|
126.62±28.30
|
73.32±2.63
|
40.97±1.69
|
1.96±0.34
|
0.98±0.28
|
6.95±1.01
|
48.35±3.43
|
4.99±0.34
|
|
5.00
|
28.99±8.95
|
137.32±32.29
|
72.23±3.71
|
39.38±3.01
|
1.97±0.32
|
1.00±0.39
|
7.97±1.62
|
50.25±3.91
|
5.13±0.55
|
与对照组比较:P<0.05 **P<0.01
P< 0.05 **P< 0.01 vs control group |
|
表 4 Effects of extract on serum biochemical index for rats administered extract for 45th d (x ± s,n=12)
Table 4 Effects of extract on serum biochemical index for rats administered extract for 45th d (x ± s,n=12) |
表 5(Table 5)

表 5 受试物在第90天对大鼠生化指标的影响(x ± s,n=12)
Table 5 Effects of extract on serum biochemical index for rats administered extract for 90thd (x ± s,n=12)
|
性别
|
剂量/
(g·kg−1)
|
ALT/
(U·L−1)
|
AST/
(U·L−1)
|
TP/
(g·L−1)
|
ALB/
(g·L−1)
|
CHOL/
(mmol·L−1)
|
TG/
(mmol·L−1)
|
BUN/
(mmol·L−1)
|
CR/
(μmol·L−1)
|
GLU/
(mmol·L−1)
|
|
♂
|
0.00
|
34.73±8.53
|
136.62±18.23
|
68.44±4.80
|
36.69±2.79
|
1.61±0.41
|
0.83±0.34
|
5.23±0.64
|
48.27±2.12
|
4.36±0.24
|
|
1.25
|
38.45±8.43
|
138.35±22.70
|
66.95±2.81
|
37.05±2.53
|
1.61±0.34
|
1.04±0.41
|
5.37±0.91
|
47.07±2.19
|
4.44±0.45
|
|
2.50
|
32.79±6.38
|
136.34±20.30
|
68.03±3.29
|
36.54±1.73
|
1.84±0.42
|
1.04±0.43
|
5.44±0.93
|
47.37±2.89
|
4.47±0.35
|
|
5.00
|
32.46±3.84
|
126.92±20.11
|
67.74±4.77
|
36.14±2.55
|
1.78±0.38
|
0.98±0.53
|
5.63±0.72
|
50.75±2.90
|
4.68±0.51
|
|
♀
|
0.00
|
34.84±6.63
|
142.66±27.12
|
73.43±4.27
|
42.98±2.89
|
2.05±0.32
|
0.85±0.19
|
6.34±1.43
|
51.01±4.41
|
4.70±0.66
|
|
1.25
|
38.56±11.43
|
148.09±46.05
|
72.67±4.44
|
42.67±2.12
|
1.93±0.44
|
0.94±0.33
|
6.71±2.34
|
49.80±3.86
|
4.53±0.43
|
|
2.50
|
31.27±6.65
|
128.66±32.10
|
72.15±3.70
|
42.46±2.86
|
2.08±0.55
|
0.75±0.21
|
6.86±1.85
|
50.27±3.66
|
4.46±0.38
|
|
5.00
|
32.73±9.87
|
130.64±25.10
|
71.04±3.22
|
40.75±3.03
|
1.94±0.29
|
0.74±0.19
|
6.93±1.48
|
48.11±2.96
|
4.96±0.45
|
与对照组比较:P<0.05
P< 0.05 vs control group |
|
表 5 受试物在第90天对大鼠生化指标的影响(x ± s,n=12)
Table 5 Effects of extract on serum biochemical index for rats administered extract for 90thd (x ± s,n=12) |
2.4 受试物对大鼠脏器质量、脏器系数的影响
各剂量组动物的脏器质量以及肝脏、脾、肾、睾丸的脏器系数与对照组比较差异均无统计学意义,结果见表 6。
表 6(Table 6)

表 6 受试物对大鼠脏器质量和脏器系数的影响(x ± s,n=12)
Table 6 Effects of extract on organ weights and organ coefficients of rats (x ± s,n=12)
|
性别
|
剂量/(g·kg−1)
|
肝脏/g
|
肝脏系数/%
|
脾/g
|
脾脏系数/%
|
肾/g
|
肾脏系数/%
|
睾丸
|
睾丸系数/%
|
|
♂
|
0.00
|
13.39±1.59
|
3.18±0.17
|
0.91±0.17
|
0.22±0.05
|
2.87±0.32
|
0.68±0.05
|
3.57±0.40
|
0.85±0.08
|
|
1.25
|
12.69±1.70
|
2.94±0.26
|
0.98±0.19
|
0.23±0.04
|
2.89±0.34
|
0.67±0.06
|
3.53±0.25
|
0.82±0.08
|
|
2.50
|
13.32±1.84
|
2.94±0.29
|
0.93±0.29
|
0.21±0.06
|
3.15±0.40
|
0.69±0.06
|
3.51±0.23
|
0.78±0.07
|
|
5.00
|
12.73±2.05
|
2.99±0.29
|
1.02±0.20
|
0.24±0.04
|
3.05±0.35
|
0.72±0.08
|
3.60±0.26
|
0.86±0.11
|
|
♀
|
0.00
|
8.67±1.15
|
3.08±0.34
|
0.70±0.14
|
0.25±0.04
|
1.96±0.23
|
0.70±0.10
|
|
|
1.25
|
7.67±1.55
|
2.99±0.27
|
0.73±0.19
|
0.28±0.05
|
1.78±0.28
|
0.70±0.07
|
|
|
2.50
|
7.63±1.15
|
2.76±0.45
|
0.66±0.16
|
0.24±0.06
|
1.97±0.15
|
0.71±0.07
|
|
|
5.00
|
8.14±0.97
|
3.06±0.22
|
0.62±0.20
|
0.23±0.07
|
2.02±0.24
|
0.76±0.07
|
|
|
表 6 受试物对大鼠脏器质量和脏器系数的影响(x ± s,n=12)
Table 6 Effects of extract on organ weights and organ coefficients of rats (x ± s,n=12) |
2.5 大体解剖及组织病理学检查
肉眼观察各剂量组、对照组大鼠的大体解剖,未见明显异常。对主要脏器进行病理组织切片检查,光学显微镜下可观察到:5.00 g/kg剂量组部分动物(♂:3/12,♀:2/12)肾小管间质可见瘀血、纤维化变性及多点溶解坏死;部分动物(♂:2/12,♀:4/12)小肠可见黏膜充血、水肿和炎性细胞浸润。对照组和1.25 g/kg剂量组各有1例雌性动物肝间质局灶性轻度炎性细胞浸润,该病变在实验动物中常有散发。除此之外,与对照组比较,其他组动物的主要脏器未见有意义的病理改变。
3 讨论
蔷薇科蔷薇属含有两个亚属,单叶蔷薇亚属Subgen. Hulthemia (Dumort.) Focke和蔷薇亚属Subgen. Rosa。其中蔷薇亚属包括9个组,本研究用的原料为其中桂味组Sect. Cinnamomeae DC.疏花蔷薇的变种毛叶疏花蔷薇的果实。本属植物的果实除了富含大量营养成分外同时也含有多种重要的功效成分。蔷薇果黄酮类提取物能有效地对抗油脂的氧化[7]。Schwager等[8]通过体外试验发现狗蔷薇Rosa canina L.的果实(全果和去种子的果实)提取物能有效抗炎并保护软骨组织,其中以去种子果实的提取物效果更好。此外,Guo等[9]通过动物试验证实野蔷薇R. multiflora Thunb.果石油醚提取物具有抗炎活性。另外,狗蔷薇果粉中三萜酸能抑制单核细胞释放白细胞介素从而调节免疫活性[10]。因此,本实验参考外塔尼古丽·卡米力等[6]提取蔷薇果中总黄酮工艺,结合实验室自身条件,选择工艺简单、成本较低的方法对毛叶疏花蔷薇果进行提取,分析提取物化学成分并研究药理活性。
亚慢性毒性试验在毒理学安全性评价中属第三阶段,旨在观察受试物以不同剂量水平长期染毒后对动物的毒作用性质和靶器官,并初步确定最大无作用剂量,为确定慢性毒性试验的剂量和初步计算人群接触的安全水平提供依据。剂量设计时,高剂量组原则上应使动物产生明显的毒性反应,甚至可引起少量动物死亡(对于毒性较小的,尽量采用最大给药量)[11]。实验结果显示,以1.25、2.50、5.00 g/kg剂量的毛叶疏花蔷薇果提取物大鼠灌胃90 d,试验期间动物无死亡。试验初期5.00 g/kg剂量组动物活动减少,并伴有腹泻现象,但随着试验的进行,逐渐恢复。试验末各剂量组动物体质量增长值、进食量、食物利用率、脏器绝对质量、脏器系数与对照组比较差异均无统计学意义;在试验中、末期各剂量组动物血液学检测指标均在本室正常值范围内,与对照组比较差异均无统计学意义;血清生化检测发现,实验中期5.00 g/kg剂量组雌雄大鼠血清中的CR和雌性大鼠血清中的BUN水平显著升高,末期5.00 g/kg剂量组雄性大鼠血清中的CR水平仍居高不下,与对照组比较差异均具有统计学意义(P<0.05、0.01),其他生化指标均在本室正常值范围内,且各剂量组与对照组比较差异均无统计学意义;同时病理组织学检查发现5.00 g/kg剂量组部分动物肾小管和小肠可见相关病理改变。提示在本实验室条件下,5.00 g/kg剂量的毛叶疏花蔷薇果提取物对SD大鼠的肾脏和小肠有损伤作用,最大未观察到有害作用剂量(No observed adverse effect level,NOAEL)为2.50 g/kg。
根据美国食品药品监督管理局药物评价研究中心的指导意见,由NOAEL推算出其人群相应剂量(human equivalent dose,HED=动物剂量(mg/kg)×动物Km/人Km,其中Km反映的是体质量和体表面积之间的关系,一般人Km=37,大鼠Km=6,因此HED=2 500×6/37=405.41 mg/kg),从而计算出人体最大安全推荐剂量(maximum recommended starting dose,MRSD)约为40 mg/kg(MRSD=HED/10)。本研究中最高剂量达到了MRSD的125倍。探究其毒作用的靶器官,由于野生蔷薇果中的黄酮类化合物有泻下作用[12],这是引起高剂量组动物在试验开始时腹泻的主要原因,也是试验末造成动物小肠病理改变的主要因素之一。肾功能指标的改变鉴于其随着试验进程有逐渐恢复的趋势,而非不可逆损伤,原因还有待进一步的研究确认。在此,认为毛叶疏花蔷薇果提取物在0~2.50 g/kg剂量水平是相对安全的,并建议青少年谨慎长期服用。
参考文献
| [1] |
Dubtsova G N, Negmatulloeva R N, Bessonov V V, et al. Composition and content of biologically active substances in rose hips [J]. Vopr Pitan, 2012, 81(6): 84-88.
|
| [2] |
田 莉, 史 红, 田树革, 等. 维药材疏花蔷薇果提取物的体外抑菌作用研究 [J]. 安徽农业科学, 2012, 40(12): 7038-7039, 7057.
|
| [3] |
Widén C, Ekholm A, Coleman M D, et al. Erythrocyte antioxidant protection of rose hips (Rosa spp.) [J]. Oxid Med Cell Longev, 2012: 621579.
|
| [4] |
肖 辉, 张月明, 朱功兵, 等. 野蔷薇果提取物对不同肿瘤细胞抑制作用 [J]. 中国公共卫生, 2010, 26(7): 858-859.
|
| [5] |
梁颂华, 周文革. 新疆野蔷薇果汁工艺研究 [J]. 食品与发酵工业, 2002, 28(2): 84-86.
|
| [6] |
外塔尼古丽∙卡米力, 阿布拉江∙克依木. 维药蔷薇果总黄酮的提取工艺研究 [J]. 食品研究与开发, 2012, 33(2): 81-84.
|
| [7] |
张春兰, 叶 林, 吴晓军, 等. 蔷薇果黄酮类物质对油脂的抗氧化作用 [J]. 中国油脂, 2010, 35(1): 44-46.
|
| [8] |
Schwager J, Richard N, Schoop R, et al. A novel rose hip preparation with enhanced anti-Inflammatory and chondroprotective effects [J]. Mediators Inflamm, 2014: 105710.
|
| [9] |
Guo D, Xu L, Cao X, et al. Anti-inflammatory activities and mechanisms of action of the petroleum ether fraction of Rosa multiflora Thunb. hips [J]. J Ethnopharmacol, 2011, 138(3): 717-722.
|
| [10] |
Saaby L, Nielsen C H. Triterpene acids from rose hip powder inhibit self-antigen and LPS-induced cytokine production and CD4+ T-cell proliferation in human mononuclear cell cultures [J]. Phytother Res, 2012, 26(8): 1142-1147.
|
| [11] |
药物重复给药毒性研究技术指导原则 [S]. 2014.
|
| [12] |
林声在, 余 斌, 张 勉. 泻下类中药性味归经与化学成分的相关性 [J]. 中国药房, 2013, 24(15): 1436-1438.
|
 2015, Vol. 30
2015, Vol. 30

