2. 天津药物研究院 医药信息中心, 天津 300193
2. Drug Informatics Center, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
通用名:恩替诺特(entinostat)
别名:MS-275、SNDX-275、NSC-706995
化学名:N-[[4-[[(2-氨基苯基)氨基]甲酰]苯基]甲基]氨基甲酸3-吡啶基甲基酯
CAS:209783-80-2
分子式:C21H20N4O3
相对分子质量:376.4
结构见图 1
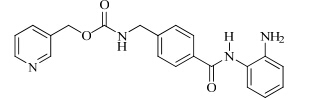 | 图 1 恩替诺特的结构Fig. 1 Structure of entinostat |
原研公司:Mitsui Pharmaceuticals Inc
药理分类:组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂
适应症:转移性乳腺癌、乳腺癌、急性髓性白血病、转移性肾癌和非小细胞肺癌
目前阶段:Ⅲ期临床(转移性乳腺癌),Ⅱ期临床(乳腺癌、急性髓性白血病、转移性肾癌、非小细胞肺癌)
给药途径:口服 2 相关背景
乳腺癌是女性最常见的恶性肿瘤之一,发病率占全身各种恶性肿瘤的7%~10%,仅次于子宫癌,已成为威胁妇女健康的主要病因。它的发病常与遗传有关,并且40~60岁绝经期前后的妇女发病率较高。它是一种通常发生在乳房腺上皮组织,严重影响妇女身心健康甚至危及生命的的恶性肿瘤之一[1]。
分子靶向治疗是乳腺癌继化疗和内分泌治疗之后的另一种有效药物治疗手段,目前运用较为广泛的靶向治疗是针对Her-2信号通路。随着肿瘤分子生物学研究的深入,一系列参与乳腺癌发生发展的非Her-2信号通路中的分子事件已十分明确,相应的靶标及抗肿瘤药物也应运而生,这些靶向药物为乳腺癌患者的治疗提供了新的手段和思路,如磷脂酰肌醇3-激酶(PI3K-AKT-mTOR)信号通路抑制剂、血管内皮细胞生长因子受体(VEGFR)抗血管生成信号通路抑制剂、表皮生长因子受体(EGFR)和成纤维细胞生长因子受体(FGFR)抑制剂、聚腺苷酸二磷酸核糖转移酶(PARP)抑制剂、周期蛋白依赖性激酶4/6(CDK4/6)抑制剂、鸡肉瘤病毒基因(Src)抑制剂和HDAC抑制剂等。
雌激素受体(ER)是乳腺癌生长的关键调节基因,它的表达水平密切影响乳腺癌进展与治疗结果。ER表达不足对乳腺癌进展至关重要。HDAC在正常细胞中通过改变染色质的结构发挥控制基因表达的关键作用,而在肿瘤细胞中该酶异常表达并导致可逆的基于表观遗传学的耐药性。试验研究表明,HDAC1的过度表达与ER表达不足和转录活性降低有关联,HDAC1通过促进细胞增殖影响乳腺癌进展,因此抑制HDAC1的表达或活性为乳腺癌治疗提供潜在靶点[2]。
恩替诺特是Syndax制药公司的主要候选产品,中文译名“恩提诺特”,已经在800名癌症患者身上研究观察实体瘤与恶性血液病的客观肿瘤反应。恩替诺特可选择性地针对与肿瘤生物学最相关的HDAC亚型,能使肿瘤细胞中失控基因的表达正常化,从而恢复对其他靶向治疗药物的灵敏度。恩替诺特因其在乳腺癌和肺癌获得的出色临床结果,正准备开展关键的III期临床试验。恩替诺特是第一个在乳腺癌II期临床随机对照研究中得到阳性结果的HDAC抑制剂,也是唯一一个处于乳腺癌晚期临床开发的HDAC抑制剂。
恩替诺特于2013年9月被FDA授予突破性疗法认定[3],与芳香化酶抑制剂依美西坦(阿诺新、exemestane)联用,用于经非甾体芳香酶抑制剂(NSAIs)治疗后病情恶化的绝经乳腺癌患者,治疗局部复发或雌激素受体阳性的转移性乳腺癌。FDA基于一项Ⅱ期临床试验结果指定恩替诺特为突破性治疗药物,该研究表明恩替诺特与依美西坦连用能延长无进展生存率和总生存率。 3 合成路线[4]
3-(2-羟乙基)吡啶和二羰基咪唑(CDI)在四氢呋喃(THF)中于10 ℃搅拌1 h。向反应液中加入4-氨甲基苯甲酸、1,8-二氮杂二环[5.4.0]十一碳-7-烯(DBU)和三乙胺的THF混悬液,在室温下搅拌5 h,反应液旋蒸除去THF后溶于水中,用盐酸酸化溶液析出固体,滤过,滤饼分别用水和甲醇洗涤,得到纯化的化合物1。
化合物1和CDI在THF中于60 ℃下搅拌3 h,待酰基咪唑基形成后,将澄清溶液冷却至室温,向溶液中加入1,2-苯二胺和三氟乙酸(TFA),继续搅拌16 h。反应混合物旋蒸除去THF,粗产物在己烷和水混合液中搅拌1 h后滤过干燥。滤饼在二氯甲烷中研磨清洗两次,得到纯化的恩替诺特。
恩替诺特的合成路线见图 2。
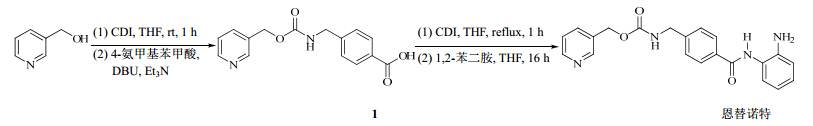 | 图 2 恩替诺特的合成路线Fig. 2 Synthetic route of entinostat |
恩替诺特在核小体内的组蛋白乙酰化/去乙酰化中发挥重要作用,主要通过抑制组蛋白去乙酰化 作用,在体内和体外促进血液和癌细胞基因的表达。恩替诺特能够诱导p21WAF-1/CIP-1基因的表达,而不依赖于p53的活性。多项体内和体外研究表明恩替诺特具有抗肿瘤活性[5,6]。
临床前药理研究表明恩替诺特在口服和静脉注射下的血浆浓度峰值(tmax)分别为30~40、10 min。无论哪种给药方式,恩替诺特在大鼠、小鼠和狗体内半衰期(t1/2)相似,均约为1h。口服给药的生物利用度约为81%。在所有物种中都表现出骨髓抑制的剂量限制毒性(DLT)[7]。
一项纳入了晚期实体瘤或淋巴瘤患者的Ⅰ期临床试验,评估最大耐受剂量(MTD)和DLT,为开展Ⅱ期试验推荐剂量,并评估恩替诺特的药动学和药效学。结果显示,按照每日剂量服药,第一剂量水平就超过了最大耐受剂量。初步分析人体内药动学表明,恩替诺特的t1/2为39~80 h,MTD为10 mg/m2,DLT反应包括恶心、呕吐、疲劳和厌食。恩替诺特的暴露量为剂量相关性,呈线性药动学。免疫荧光分析在所有剂量水平恩替诺特都能增加外周血管单个核细胞中组蛋白H3的乙酰化[8]。 5 临床研究 5.1 Ⅱ期临床
2008年5月,开始了一项多中心、双盲的II期临床试验(NCT00676663),共纳入130名绝经后非甾体芳香酶抑制剂(NSAIs)耐药的晚期激素受体阳性乳腺癌患者。这些患者被随机分为治疗组(64例)和对照组(66例),治疗组服用依西美坦25 mg/d,以及恩替诺特5 mg/周;对照组则服用依西美坦25 mg/d,以及安慰剂。研究主要终点为无进展生存期(PFS)。同时为了评估恩替诺特的活性,亦采集一部分患者的血液来测定蛋白质赖氨酸乙酰化水平。
恩替诺特和依西美坦联合治疗组取得了较依西美坦单用组明显的效果,基于“意向性分析”,PFS由单药的2.3个月延长至4.3个月,总生存期为探索性的终点,总生存期(OS)由单药的19.8个月延长至28.1个月。治疗组的分子标记物即蛋白质赖氨酸乙酰化水平与延长PFS相关[9],提示蛋白质赖氨酸乙酰化的水平可以作为一种评价患者能否从恩替诺特中获益的分子标志物。基于这项研究数据,FDA已批准恩替诺特为突破性治疗药物。目前,进一步的III期临床试验正在积极进行中。 5.2 Ⅲ期临床
2014年6月30日,Syndax制药公司宣布国家癌症研究所(NCI)的癌症治疗和诊断部门(DCTD)和FDA就恩替诺特治疗晚期乳腺癌患者关键的Ⅲ期临床试验计划达成了一致,开始招募首个受试对象。该项随机的Ⅲ期临床试验(E2112)评估恩替诺特与依西美坦(类固醇芳香酶抑制剂)联合用药的有效性,主要指标为是否改善激素受体阳性(HR+)的绝经期妇女和男性乳腺癌患者的PFS和/或OS [10]。试验预计于2017年年中完成。 6 安全性
Ⅱ期临床试验中,乏力和中性粒细胞减少症是最常见的3/4级毒性反应。恩替诺特和依西美坦联合治疗组由于不良反应导致治疗中断的比例明显高于依西美坦单用组。 7 结语
组蛋白去乙酰化酶通过组蛋白的去乙酰化,使DNA更紧地缠绕在组蛋白上,从而导致这些DNA不易被基因转录因子接触,结果导致与细胞分化、细胞周期阻滞、肿瘤免疫、受损细胞凋亡等有关的蛋白的表达受到抑制,促进癌症的发展[11]。因此抑制组蛋白去乙酰化酶的作用能有选择性地恢复癌症抑制因子和其他抗癌基因的表达。组蛋白去乙酰化酶为治疗癌症提供了新靶点。恩替诺特是一种新颖的口服HDAC1抑制剂,不论作为单一药剂或是与现有商业可获得的靶向治疗药物的组合,都具有安全性和有效性,使其有别于其他HDAC抑制剂。目前完成的临床前、Ⅰ期和Ⅱ期临床试验也都证实了本品安全性和有效性,FDA根据其一项Ⅱ期临床试验结果指定本品为突破性治疗药物。Ⅲ期临床试验也已开始,期待后续试验进展结果,如能在Ⅲ期临床中得到预期的结果,将会解决尚未满足的临床用药需求,给大批晚期乳腺癌患者带来更多的生存获益。
| [1] | 崔艳丽, 金玉洁, 田 苗, 等. 周期蛋白依赖性激酶4/6抑制剂palbociclib [J]. 现代药物与临床, 2014, 29(10): 1178-1182. |
| [2] | Kawai H, Li H, Avraham S, et al. Overexpression of histone deacetylase hdac1 modulates breast cancer progression by negative regulation of estrogen receptor α [J]. Int J Cancer, 2003, 107(3): 353-358. |
| [3] | Syndax.com. Syndax's entinostat receives breakthrough therapy designation from FDA for treatment of advanced breast cancer [OL]. [2013-09-11]. http://www.syndax.com/ assets/Entinostat%20Breakthrough%20Designation.pdf. |
| [4] | Gediya L K, Belosay A, Khandelwal A, et al. Improved synthesis of histone deacetylase inhibitors (HDIs) (MS-275 and CI-994) and inhibitory effects of HDIs alone or in combination with RAMBAs or retinoids on growth of human LNCaP prostate cancer cells and tumor xenografts [J]. Bioorg Med Chem, 2008, 16(6): 3352-3360. |
| [5] | Bouchain G, Delorme D. Novel hydroxamate and anilide derivatives as potent histone deacetylase inhibitors: synthesis and antiproliferative evaluation [J]. Curr Med Chem, 2003, 10(22): 2359-2372. |
| [6] | Jaboin J, Wild J, Hamidi H, et al. MS-27-275, an inhibitor of histone deacetylase, has marked in vitro and in vivo antitumor activity against pediatric solid tumors [J]. Cancer Res, 2002, 62(21): 6108-6115. |
| [7] | Acharya M R. Clinical pharmacology of MS-275, a histone deacetylase inhibitor [D]. Richmond: Virginia Commonwealth University, 2005. |
| [8] | Ryan Q C, Headlee D, Acharya M, et al. Phase I and pharmacokinetic study of MS-275, a histone deacetylase inhibitor, in patients with advanced and refractory solid tumors or lymphoma [J]. J Clin Oncol, 2005, 23(17): 3912-3922. |
| [9] | Yardley D A, Ismail-Khan R R, Melichar B, et al. Randomized phase II, double-blind, placebo-controlled study of exemestane with or without entinostat in postmenopausal women with locally recurrent or metastatic estrogen receptor-positive breast cancer progressing on treatment with a nonsteroidal aromatase inhibitor [J]. J Clin Oncol, 2013, 31(17): 2128-2135. |
| [10] | Syndax. First patient enrolled in ECOG-ACRIN phase III trial of Syndax's entinostat [OL]. [2014-06-30]. http:// www.syndax.com/assets/140630_ECOG%20-%20E2112% 20First%20Patient.pdf. |
| [11] | Pandolfi P. Histone deacetylases and transcriptional therapy with their inhibitors [J]. Cancer Chemother Pharmacol, 2001, 48(1 Suppl): S17-S19. |
 2015, Vol. 30
2015, Vol. 30

