2. 天津医科大学肿瘤医院 国家肿瘤临床医学研究中心, 天津 300060
2. National Clinical Research Center for Cancer, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China
胰腺癌早期诊断困难,发展迅速,预后差。据统计2013年美国胰腺癌死亡率为恶性肿瘤第4位,5年存活率是6%,虽然10%~15%的患者可以手术切除,但复发率高[1]。目前吉西他滨是进展期胰腺癌的首选化疗药物,但肿瘤原发性和(或)获得性耐药严重降低了化疗效果。三磷酸腺苷结合转运体G2(ABCG2)是新发现的多药耐药蛋白,研究发现ABCG2与肿瘤干细胞分化状态和干细胞发育有关[2],并有推测肿瘤是由于其干细胞或SP侧群细胞高表达ABCG2,而易形成多药抗性[3],也有研究证明ABCG2介导了一些肿瘤的耐药[4, 5, 6, 7]。因此本实验对吉西他滨活化PI3K/AK/ABCG2分子抑制胰腺癌细胞化疗敏感性及相关分子机制进行了研究。
1 材料胰腺癌和癌旁组织的标本来自术前没有放疗或化疗接受胰腺切除术的胰腺腺癌患者。在本研究使用人体组织由中国抗癌协会批准。胰腺癌细胞株SW1990、Capan-2、PANC-1购买于中国科学院上海细胞库。
吉西他滨(200 mg/支,产品批号C214435SA)购自美国礼来公司,兔抗人P-AKT/Ser473抗体(产品批号9271)购自美国Cell Signaling Technology公司,兔抗人AKT抗体(产品批号10176-2-AP)及小鼠抗人ABCG2抗体(产品批号60080-1-Ig)购自美国Proteintech公司,PE标记ABCG2流式抗体(产品批号561180)购自美国BD公司;CCK-8购自日本同仁化学研究所。LY294002(产品批号9901)购自Cell Signaling Technology公司,AKT干扰RNA由上海吉玛公司设计合成,鼠源β-actinIgG(产品批号ZS-512)、辣根酶(horseradish peroxidase,HRP)标记山羊抗鼠IgG(产品批号ab6789)购自英国abcam公司,HRP标记山羊抗兔IgG(产品批号ZB-2301)购自北京中杉金桥生物技术有限公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记山羊抗小鼠IgG(产品批号4408)购自Cell Signaling Technology公司,PI购自海门市碧云天生物技术研究所。
2 方法 2.1 细胞培养胰腺癌细胞株SW1990、Capan-2用含10%胎牛血清(FBS,美国Hyclone公司)的RPMI-1640培养液(美国Hyclone公司),人胰腺癌细胞PANC-1在含10%胎牛血清的DMEM培养液(美国Hyclone公司)中,37 ℃,5% CO2条件下常规培养。
2.2 免疫组化手术切除胰腺癌组织标本(n=15),手术前未接受放化疗,4%中性多聚甲醛液体固定,取材厚度<5 mm,蜡块包埋,4 μm厚度切片,60 ℃烤片3 h,常规脱蜡,置于抗原修复液(pH 6.0)中,微波炉中火修复4次,6 min/次,0.01 mol/L磷酸盐缓冲液(PBS)冲洗;3% H2O2室温孵育10 min羊血清室温封闭1 h,PBS漂洗;加ABCG2抗体(1∶100),4 ℃过夜孵育,PBS漂洗,滴加HRP标记二抗室温孵育2 h,PBS洗脱,DAB显色,镜下监测显色过程,适时终止反应。苏木精染核,脱水,封片,镜下观察。计算阳性细胞率,以阳性细胞率<10%为阴性,>10%为阳性[8]。
阳性细胞率=平均阳性细胞数/平均细胞总数
2.3 Western blotting使用蛋白裂解液(美国Invitrogen公司)提取组织或细胞总蛋白,二喹啉甲酸(BCA)法蛋白定量,蛋白样品均匀点样于10% SDS-聚丙烯酰胺凝胶(SDS-PAGE)上,110 V电泳1.5 h,随后85 V转膜2 h,低温转至聚偏二氟乙烯膜(PVDF,美国Millipore公司)上,5%脱脂奶粉室温封闭1 h,一抗按以下比例稀释4 ℃孵育过夜,P-AKT(1∶1 000),AKT(1∶1 000),ABCG2(1∶1 000),β-actin(1∶2 000),TBST充分清洗后,分别按1∶10 000加入HRP标记的羊抗兔IgG或羊抗鼠IgG二抗,常温孵育1 h,TBST充分清洗后,使用ECL化学发光免疫蛋白检测剂(美国Millipore公司)检测蛋白表达,蛋白表达量用目标蛋白与内参β-actin吸光度值的比值表示,每例标本重复6次,应用ImageJ分析软件统计数据,计算蛋白表达结果。
2.4 RNA干扰将对数生长期的细胞以2×105/mL的浓度接种于6孔板,贴壁培养24 h,弃去旧培养基,每孔加入1 600 μL基本培养基,按200 μL基本培养基中加入4 μL lipofectamine 2000(美国Life Technologies公司)的比例轻轻混匀转染试剂,室温静置5 min,再按200 μL基本培养基中加入12 μL siRNA的比例混匀干扰RNA,最后将稀释好的siRNA与siRNA-Mate试剂混匀,室温放置20 min,形成siRNA/lipofectamine 2000复合物,每孔加入400 μL siRNA/lipofectamine 2000混合液,混匀。CO2培养箱培养6 h,吸出含有siRNA/lipofectamine 2000的培养基,换成10% FBS完全培养基继续培养到24 h,siRNA/AKT2干扰序列为:5′GCGGAAGGAAG UCAUCAUUTT-3′;siRNA/AKT2-2序列为:5′AAU GAUGACUUCCUUCCGC TT-3′,并设siRNA/AKT2对照。
2.5 细胞免疫荧光根据胰腺癌细胞的处理方法分为对照组、吉西他滨处理24 h组、LY294002预处理4 h后吉西他滨处理24 h组。载玻片经除自发荧光处理后,放入24孔板孔中,加入上述胰腺癌细胞悬液(2×104/孔),4%多聚甲醛固定15 min,TBST充分清洗,5%普通山羊血清工作液室温封闭1 h,TBST充分清洗,5%普通山羊血清1∶100稀释ABCG2(BXP-21)抗体4 ℃过夜,TBST充分清洗,5%普通山羊血1∶200稀释FITC标记山羊抗小鼠IgG室温孵育1 h,TBST充分清洗,PI(1 μg/mL)染核,TBST充分清洗,荧光封闭液封片,Olympus FV1000荧光共聚焦显微镜观察,呈像。
2.6 CCK8细胞毒性实验将对数生长期的肿瘤细胞按照5×104/mL的浓度接种于96孔板,每孔加入100 μL,细胞贴壁生长24 h后加入不同浓度(0、0.2、1、5、25、125 μmol/L)吉西他滨处理72 h(每个浓度重复6次),更换正常培养基,每孔加入10 μL CCK-8溶液,37 ℃孵育2~4 h,450 nm波长激发光下读取吸光度值,设加药组(As)、无细胞仅加培养基为空白组(Ab)及接种细胞不加药物为对照组(Ac),计算细胞存活率[细胞存活率=(As-Ab)/(Ac-Ab)]。
添加SiRNA/AKT2、LY294002预处理应用相同浓度梯度的吉西他滨检测细胞毒性。应用Graphpad Prism 5.01软件analysis->Dose- response- Inhibition->log(Inhibitor) vs. normalized response- Varible slope,并选取Least squares fit模块,计算IC50值。应用LY294002预处理PANC-1细胞后,在IC50浓度吉西他滨刺激0、3、12、24、48、72 h,观察其细胞毒性的变化。
2.7 流式细胞仪检测流式细胞仪检测细胞膜表面ABCG2蛋白阳性表达(ABCG2+)细胞数,细胞浓度调至(2~3)× 105/mL,铺六孔板,用IC50浓度的吉西他滨处理上述3种胰腺癌细胞,处理时间分别为0、3、12、24、48、72 h。若加LY294002预处理,则吉西他滨处理时间为24 h,检测不同处理条件ABCG2+细胞数表达。0.25%胰蛋白酶收集细胞,并用0.01 mol/L PBS液清洗2次,4 ℃离心(1 000 r/min)5 min,加入PBS稀释的PE标记ABCG2(1∶200)抗体400 μL,4 ℃孵育1 h,PBS清洗后用Flow Cytometry Buffer(美国Sigma公司)重悬浮细胞,并调整细胞浓度至1×106/mL,移至流式管中,应用BD FACSCalibur流式细胞仪上样检测,应用FlowJo 7.6软件分析数据绘图。
2.8 统计学处理数据用`x ± s表示,两两比较用χ2检验,多组数据组间用Levene test检测,方差齐性后采用多因素方差分析及Student-Newman-Keuls test、multiple comparisons test比较,应用SPSS 16.0统计软件。
3 结果 3.1 胰腺癌ABCG2蛋白在胰腺癌组织、癌旁组织细胞中的表达情况免疫组化检测结果显示ABCG2在癌组织、癌旁组织均有表达,癌组织比胰腺癌组织中的表达明显增加(n=15),癌组织中ABCG2阳性率为67.5%,癌旁中ABCG2阳性率为23.5%。ABCG2蛋白表达位于肿瘤细胞质、细胞膜,见图 1。
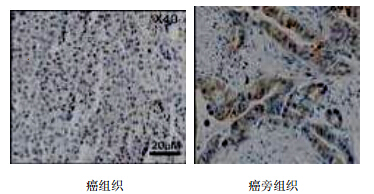 | 图 1 ABCG2蛋白在胰腺癌组织和癌旁组织中的表达Fig. 1 Expressions of ABCG2 protein in pancreatic cancer tissues and carcinoma sides tissues |
选择高、中、低不同病理分化胰腺癌细胞系Capan-2、SW1990和PANC-1,用蛋白免疫印迹方法检测ABCG2总蛋白的表达情况,结果发现ABCG2蛋白在3株细胞系均有表达,不同分化胰腺癌细胞总ABCG蛋白与ABCG+细胞数有明显差异,Capan-2细胞中最明显。结果见图 2。
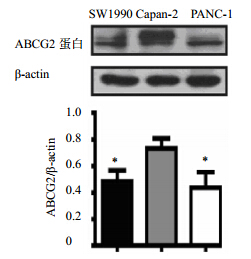 | 与Capan-2组比较:P<0.05 P < 0.05 vs Capan-2 group图 2 ABCG2蛋白在胰腺癌细胞系Capan-2、SW1990和PANC-1中的表达Fig. 2 Expression of ABCG2 protein in pancreatic cancer cell lines Capan-2,SW1990,and PANC-1 |
应用流式细胞技术检测胰腺癌细胞膜ABCG2蛋白表达以观察ABCG2+细胞数,发现3株细胞ABCG2+细胞数有明显差异,而PANC-1的ABCG2+细胞数最多,见图 3。
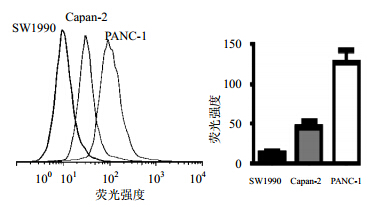 | 图 3 胰腺癌细胞系细胞膜ABCG2蛋白表达Fig. 3 Expressions of ABCG2 protein in cell membrane |
吉西他滨刺激72 h后3株细胞总ABCG2无明显变化,见图 4。
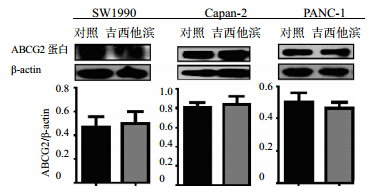 | 图 4 吉西他滨对胰腺癌细胞ABCG2蛋白表达的影响Fig. 4 Effect of gemcitabine on ABCG2 protein expression in pancreatic cancer cells |
选上述胰腺癌细胞株,用吉西他滨刺激后检测细胞毒性和IC50值,并观察吉西他滨对ABCG2蛋白表达和ABCG2+细胞数的影响,结果显示3株细胞的IC50有明显差异,PANC-1的IC50值最高,见表 1。
| 表 1 胰腺癌细胞系吉西他滨IC50值 Table 1 IC50 values of gemcitabine in pancreatic cancer cells |
用吉西他滨刺激后观察吉西他滨对ABCG2+细胞数的影响,结果表明ABCG2+细胞数在3株细胞系均有明显增加,PANC-1呈显低敏感性,ABCG2+增多明显,见图 5。
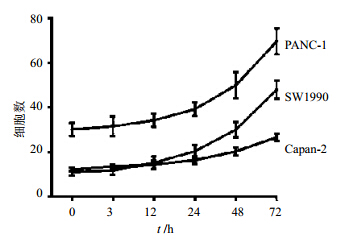 | 图 5 吉西他滨对ABCG2+细胞数的影响Fig. 5 Effects of gemcitabine on ABCG2+ cell number |
根据上述结果选择PANC-1细胞株进行相关机制试验。蛋白免疫印记实验显示用30 μmol/L吉西他滨处理PANC-1细胞株0、15、30、45 min以及2、3 h后p-AKT蛋白表达水平呈显增加趋势,并有时间相关性,P-AKT的表达在30 min时最高之后逐渐降低。见图 6。
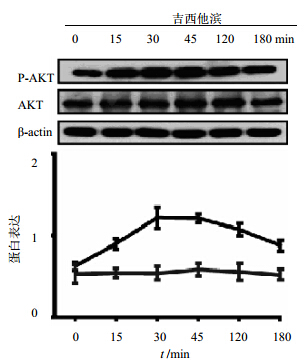 | 图 6 吉西他滨对p-AKT蛋白表达影响Fig. 6 Effect of gemcitabine on p-AKT expression |
PANC-1分别在吉西他滨、LY294002(50 μmol/L)和LY294002+吉西他滨处理后,细胞总ABCG2蛋白表达无明显变化,见图 7。
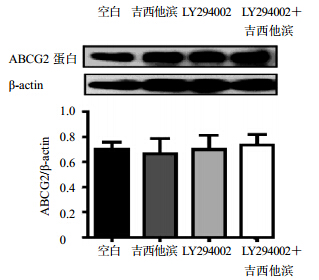 | 图 7 总ABCG2蛋白表达Fig. 7 Total ABCG2 protein expression |
流式细胞仪检测吉西他滨可明显诱导ABCG2+的表达,而抑制PANC-1的PI3K/AKT表达后,ABCG2+细胞表达数明显减少,见图 8。
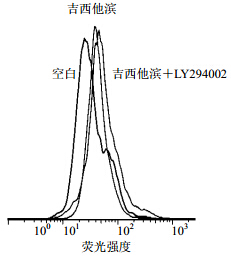 | 图 8 流式细胞仪检测ABCG2+表达Fig. 8 FCM result of ABCG2+ expressions |
分别用吉西他滨、吉西他滨+LY294002处理PANC-1细胞后,免疫荧光共聚焦技术观察细胞膜表面的ABCG2蛋白荧光表达情况,显示胰腺癌细胞ABCG2蛋白表达有质膜移位现象,结果见图 9。
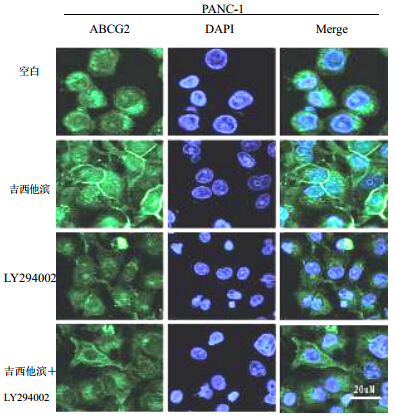 | 图 9 免疫荧光共聚焦观察细胞膜表面的ABCG2蛋白表达Fig. 9 Immunofluorescence confocal results of ABCG2 expression in cell membrane |
应用LY294002(50 μmol/L)或应用siRNA技术进行AKT2基因敲除干预细胞株后,再加入吉西他滨以浓度梯度处理细胞,进行CCK8毒性试验,结果发现胰腺癌细胞生存率下降,肿瘤细胞吉西他滨药敏性明显增加(siRNA/AKT2-1和siRNA/ AKT2-2实验结果相同)。应用30 μmol/L吉西他滨结果不同时间处理PANC-1,显示PANC-1细胞毒性增加有时间相关性,72 h时生存率最低,应用LY294002(50 μmol/L)干预,较比对照组细胞药物毒性明显增强,见图 10。
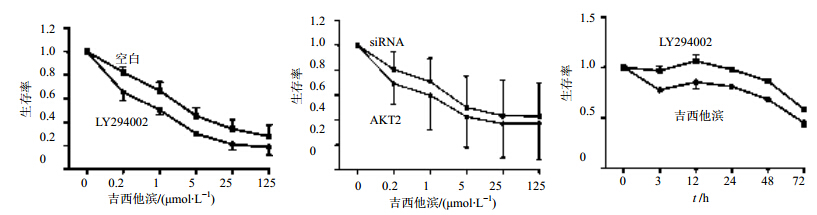 | 图 10 PANC-1细胞不同实验条件下生存率检验Fig. 10 PANC-1 cell’s surviral rate under different situation |
吉西他滨是胰腺癌化疗的首选药物,但是胰腺肿瘤的内源性或获得性药物耐受性(multidrug resistance,MDR)是导致化疗失败的主要原因。ABC转运体蛋白超家族跨膜蛋白是引起耐药的主要原因之一。ABC转运蛋白与底物结合后,使ATP水解,诱导蛋白质构象发生改变,疏水性药物可以由脂质双分子层直接进入转运通道并排出细胞,导致肿瘤细胞化疗抵抗[9]。对ABC转运体与吉西他滨药物敏感性的研究,为胰腺肿瘤耐药检测和化疗增敏剂的开发提供理论基础。近年新发现的ABC转运体超家族成员ABCG2在肿瘤化疗耐药中有重要作用,其作用机制研究已受到普遍关注。
ABCG2在人体不同组织中有表达,并能维持器官组织生理功能,如正常小肠和结肠上皮顶膜细胞、脑、肝和前列腺组织都有明显表达[10, 11]。近年报道肿瘤ABCG2高表达可作为不良预后的观测指标[12, 13, 14, 15, 16],国内也有报道ABCG2在胰腺癌中表达明显高于癌旁组织,并与肿瘤生物学特征相关[17]。本研究应用胰腺癌组织检测ABCG2在胰腺癌和癌旁组织的蛋白表达量,所得结论与有关报道相同,同时发现ABCG2总蛋白与胞膜蛋白(ABCG2+细胞数)在分化不同的胰腺癌细胞系中均有不同程度表达。因此,胰腺癌ABCG2蛋白表达水平结合ABCG2+细胞数的变化,作为临床监测指标,观察肿瘤的发生与发展应更具有客观性。
已有报道证明ABCG2是与肿瘤多药耐药相关的跨膜蛋白[18, 19, 20, 21],ABCG2分子由655个氨基酸构成,含有1个跨膜结构域和1个ATP结合域,被称为半分子ABC转运蛋白。人的ABCG2 基因含有16个外显子,总长为66 kb,位于4q22 染色体上,是4号染色体上唯一ABC的转运蛋白[22]。ABCG2是吉西他滨的主要转运蛋白之一,区别于ABC家族的其他耐药蛋白,ABCG2需以同源或异源二聚体结合形式在细胞膜表面通过蛋白构象变化执行其转运功能,当ABCG2从细胞膜转移至胞浆时丧失转运效能。本研究证实在不同病理分化细胞系中ABCG2蛋白的不同表达。通过流式技术检测ABCG2+细胞数观察吉西他滨对ABCG2的影响,发现吉西他滨能介导胰腺癌细胞ABCG2胞膜蛋白表达增加,但对ABCG2总蛋白影响不明显,证实吉西他滨不是通过增加胰腺癌细胞ABCG2转运蛋白含量,而是诱导了ABCG2蛋白细胞膜转移,增加胞膜ABCG2同源或异源二聚体蛋白含量,增强转运蛋白的外排功能,这一作用可能促进了胰腺癌吉西他滨耐药,所以,认为对胰腺癌ABCG2+细胞数动态观察,较ABCG2的含量将更有助于检测肿瘤化疗敏感性,并对制定化疗方案有指导意义。
近年研究表明PI3K/Akt信号通路在许多恶性肿瘤中活化与实体瘤多药耐药有关,Han等[23]发现胃癌AGS细胞中上调PI3KAkt的表达导致P-gP相关耐药,Yuan等发现卵巢癌耐吉西他滨细胞株A2780CP中存在PI3K/Akt通路的过度活化,有研究报告胰腺癌中激活PI3K/Akt通路,可介导吉西他滨细胞的化疗抵抗[24, 25, 26],并研究发现在神经胶质瘤及肝癌中PI3K/Akt/mTOR通路引起ABCG2从胞浆向胞膜移位[27, 28]。本研究发现吉西他滨可提高胰腺癌细胞P-AKT的水平,并应用流式细胞检测和免疫荧光共聚焦方法,观察PI3K/AKT信号通路对ABCG2+细胞数和ABCG2蛋白细胞定位分布的影响,结果证实吉西他滨活化AKT使ABCG2+细胞数和ABCG2蛋白胞膜定位增加,而应用AKT基因敲除与AKT抑制剂可逆转上述效果,并增强吉西他滨抗肿瘤敏感性,提示胰腺癌细胞吉西他滨继发性耐药机制可能是活化PI3K/AKT信号分子,促进ABCG2质膜移位,增强了ABCG2转运蛋白外排功能,抑制胰腺癌化疗敏感性,因此,吉西他滨联合AKT抑制剂可起到对胰腺癌化疗的增敏效果。
总之,吉西他滨可活化PI3K/AKT信号分子,促进ABCG2质膜移位,使药物敏感性下降。提示作为临床监测指标,ABCG2蛋白表达结合ABCG2+细胞数,对观察肿瘤发生发展更具有客观性。对ABCG2+细胞数动态检测将会有助于观察肿瘤化疗敏感性。联合AKT抑制剂可增加胰腺癌对吉西他滨化疗敏感性。本研究结果为有效的选择个体化疗方案、检测化疗敏感性,以提高治疗效果提供参考。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30. |
| [2] | Hirschmann-Jax C, Foster A E, Wulf G G, et al. A distinct "side population" of cells with high drug efflux capacity in human tumor cells [J]. Proc Natl Acad Sci USA, 2004, 101(39): 14228-14233. |
| [3] | Robey R W, To K K K, Polgar O, et al. ABCG2: a perspective [J]. Adv Drug Deliv Rev, 2009, 61(1): 3-13. |
| [4] | Rudin C M, Liu W, Desai A, et al. Pharmacogenomic and pharmacokinetic determinants of erlotinib toxicity [J]. J Clin Oncol, 2008, 26(7): 1119-1127. |
| [5] | Robey R W, Polgar O, Deeken J, et al. ABCG2: determining its relevance in clinical drug resistance [J]. Cancer Metastasis Rev, 2007, 26(1): 39-57. |
| [6] | Goler-Baron V, Sladkevich I, Assaraf Y G. Inhibition of the PI3K-Akt signaling pathway disrupts ABCG2-rich extracellular vesicles and overcomes multidrug resistance in breast cancer cells [J]. Biochem Pharmacol, 2012, 83(10): 1340-1348. |
| [7] | Goler-Baron V, Assaraf Y G. Structure and function of ABCG2-rich extracellular vesicles mediating multidrug resistance [J]. PloS One, 2011, 6(1): e16007. |
| [8] | Jia X, Li X, Xu Y, et al. SOX2 promotes tumorigenesis and increases the anti-apoptotic property of human prostate cancer cell [J]. J Mol Cell Biol, 2011, 3(4): 230- 238. |
| [9] | 王丽娟, 刘克辛. 介导肿瘤多药耐药的ATP结合盒转运体的研究进展 [J]. 药物评价研究, 2014, 37(2): 173- 177. |
| [10] | Maliepaard M, Scheffer G L, Faneyte I F, et al. Subcellular localization and distribution of the breast cancer resistance protein transporter in normal human tissues [J]. Cancer Res, 2001, 61(8): 3458-3464. |
| [11] | Fetsch P A, Abati A, Litman T, et al. Localization of the ABCG2 mitoxantrone resistance-associated protein in normal tissues [J]. Cancer Lett, 2006, 235(1): 84-92. |
| [12] | Dou J, Wen P, Hu W, et al. Identifying tumor stem-like cells in mouse melanoma cell lines by analyzing the characteristics of side population cells [J]. Cell Biol Int, 2009, 33(8): 807-815. |
| [13] | Yajima T, Ochiai H, Uchiyama T, et al. Resistance to cytotoxic chemotherapy-induced apoptosis in side population cells of human oral squamous cell carcinoma cell line Ho-1-N-1 [J]. Int J Oncol,2009, 35(2): 273-280. |
| [14] | Wang Y H, Li F, Luo B, et al. A side population of cells from a human pancreatic carcinoma cell line harbors cancer stem cell characteristics [J]. Neoplasma, 2008, 56(5): 371-378. |
| [15] | Wielinga P, Hooijberg J H, Gunnarsdottir S, et al. The human multidrug resistance protein MRP5 transports folates and can mediate cellular resistance against antifolates [J]. Cancer Res, 2005, 65(10): 4425-4430. |
| [16] | Cusatis G, Sparreboom A. Pharmacogenomic importance of ABCG2 [J]. Pharmacogenomics, 2008, 9(8): 1005- 1009. |
| [17] | 王 洋, 谢 强,张德巍. 胰腺癌组织中ABCG2、MRP-1 的表达及临床意义 [J]. 中国医学工程, 2013, 21(3): 9-11. |
| [18] | Doyle L A, Yang W, Abruzzo L V, et al. A multidrug resistance transporter from human MCF-7 breast cancer cells [J]. Proc Natl Acad Sci USA, 1998, 95(26): 15665- 15670. |
| [19] | Ross D D, Karp J E, Chen T T, et al. Expression of breast cancer resistance protein in blast cells from patients with acute leukemia [J]. Blood, 2000, 96(1): 365-368. |
| [20] | Benderra Z, Faussat A M, Sayada L, et al. Breast cancer resistance protein and P-glycoprotein in 149 adult acute myeloid leukemias [J]. Clin Cancer Res, 2004, 10(23): 7896-7902. |
| [21] | Wilson C S, Davidson G S, Martin S B, et al. Gene expression profiling of adult acute myeloid leukemia identifies novel biologic clusters for risk classification and outcome prediction [J]. Blood, 2006, 108(2): 685- 696. |
| [22] | Allikmets R, Schriml L M, Hutchinson A, et al. A human placenta-specific ATP-binding cassette gene (ABCP) on chromosome 4q22 that is involved in multidrug resistance [J]. Cancer Res, 1998, 58(23): 5337-5339. |
| [23] | Han Z, Hong L, Wu K, et al. Phospho Akt mediates multidrug resistance of gastric cancer cells through regulation of P-gp, Bcl-2 and Bax [J]. J Exp Clin Cancer Res, 2007, 26(2): 261-268. |
| [24] | Arlt A, Gehrz A, Müerkster S, et al. Role of NF-kappa B and Akt/PI3K in the resistance of pancreatic carcinoma cell lines against gemcitabine-induced cell death [J]. Oncogene, 2003,22(21): 3243-3251. |
| [25] | Wei W T, Chen H, Wang Z H, et al. Enhanced antitumor efficacy of gemcitabine by evodiamine on pancreatic cancer via regulating PI3K/Akt pathway [J]. Int J Biol Sci, 2012, 8(1): 1-14. |
| [26] | Voutsadakis I A. Molecular predictors of gemcitabine response in pancreatic cancer [J]. World J Gastrointest Oncol, 2011, 3(11): 153. |
| [27] | Bleau A M, Hambardzumyan D, Ozawa T, et al. PTEN/PI3K/Akt pathway regulates the side population phenotype and ABCG2 activity in glioma tumor stem-like cells [J]. Cell Stem Cell, 2009, 4(3): 226-235. |
| [28] | Hu C, Li H, Li J, et al. Analysis of ABCG2 expression and side population identifies intrinsic drug efflux in the HCC cell line MHCC-97L and its modulation by Akt signaling [J]. Carcinogenesis, 2008, 29(12): 2289-2297. |
 2015, Vol. 30
2015, Vol. 30


